Napsin A、 TTF-1 及 CK7 在恶性胸水中对肺腺癌的诊断价值
2021-04-15钟玲
钟 玲
广州医科大学附属第二医院病理科 (广州 510260)
恶性胸水 (malignant pleural effusion, MPE) 是原发于胸膜的恶性肿瘤或其他部位的恶性肿瘤转移至胸膜导致的胸腔积液, 平均生存期为 4 ~7月[1]。 在日常工作中对恶性胸水进行细胞蜡块包埋切片, 可获得与肿瘤组织形态相近的形态, 加以免疫组化的检测可以对肺原发性恶性胸水和继发的恶性胸水进行分类。 细胞蜡块联合免疫组化检测特别是Napsin A、 TTF-1 标记能获得更精准的诊断[2-3], 同时CK7 做为肺腺癌分化的客观评价指标[4]。 本文回顾性分析189 例恶性胸水细胞蜡块切片及免疫组化结果, 探讨免疫组化标记Napsin A、TTF-1 和CK7 和肿瘤标记物CEA 在肺腺癌胸水中的诊断价值。 在恶性胸水的研究中首次将胸水细胞蜡块免疫组化及胸水肿瘤标记物综合起来分析,期望对晚期肺腺癌患者准确的病理诊断提供更充分的依据。
1 材料与方法
1.1 材料
收集广州医科大学附属第二医院病理科2017 年1 月—2019 年 11 月所有行 Napsin A、 TTF-1 及 CK7免疫组化检测的恶性胸水的细胞蜡块的患者资料。
1.2 制作细胞蜡块
取30 mL 胸水 (血性标本时可加入3%醋酸乙醇10 mL 进行溶血处理) 放入50 mL 离心管中,离心机2 000 r/min, 离心5 min, 弃上清, 如果沉淀物不够时可加入少量蛋清或反复离心, 收集沉淀物之后, 直接加10 mL 95%酒精充分摇匀, 离心机2 000 r/min, 离心10 min, 弃上清, 取底部沉淀物, 用拷贝纸包埋放进10%中性福尔马林固定,与常规小组织进行脱水处理。 常规包埋、 3 ~4 μm切片, HE 染色。
1.3 免疫细胞化学方法
观察常规HE 切片进行, 将有可疑异型成分的蜡块选取出来进行免疫组化染色, 根据镜下形态及相关病史选择不同的抗体 (均包含Napsin A、TTF-1、 CK7), 采用 EnVision 两步法。 抗体及试剂均购自福州迈新公司。
1.4 免疫组化结果判读标准
以10% 及以上的目标细胞出现定位 (胞核、胞膜或胞浆) 清晰的棕褐色或黄色颗粒为阳性表达, <10% 或完全不着色为阴性表达。
1.5 统计分析
计数资料用n(%) 表示; 连续变量采用中位数 (四分位间距) 表示。 计数资料的比较采用χ2检验; 两组间比较采用Mann-whitney U 非参数检验, 受试者工作特征曲线 (AUC 曲线) 分析并确定血清和胸水CEA 的最佳诊断临界值并计算曲线下面积 (AUC),P<0.05 为差异有统计学意义,使用SPSS 17.0 统计软件进行统计。
2 结 果
2.1 细胞蜡块HE 切片
细胞蜡块切片中背景干净, 对比较明显, 细胞形态与常规组织学中形态相似, 避免了细胞学涂片的细胞重叠、 退变等不利于观察的因素。 大部切片中可见较多巨噬细胞和间皮细胞, 肿瘤细胞异型性明显, 容易辨认。
2.2 恶性胸水的细胞学类型及组织来源
在189 例恶性胸水标本中, 其中155 例为肺腺癌细胞, 部分病例细胞聚集成三维立体球状结构, 部分病例可见乳头状或腺腔样结构, 细胞核浆比明显升高, 可见核分裂。 1 例为肺小细胞癌细胞, 癌细胞胞浆少, 近乎裸核, 异型性明显。1 例为恶性黑色素瘤细胞, 瘤细胞胞浆内可见明显的黑色素颗粒, 细胞核核仁明显, 表现明显的失粘附性。 见表1。
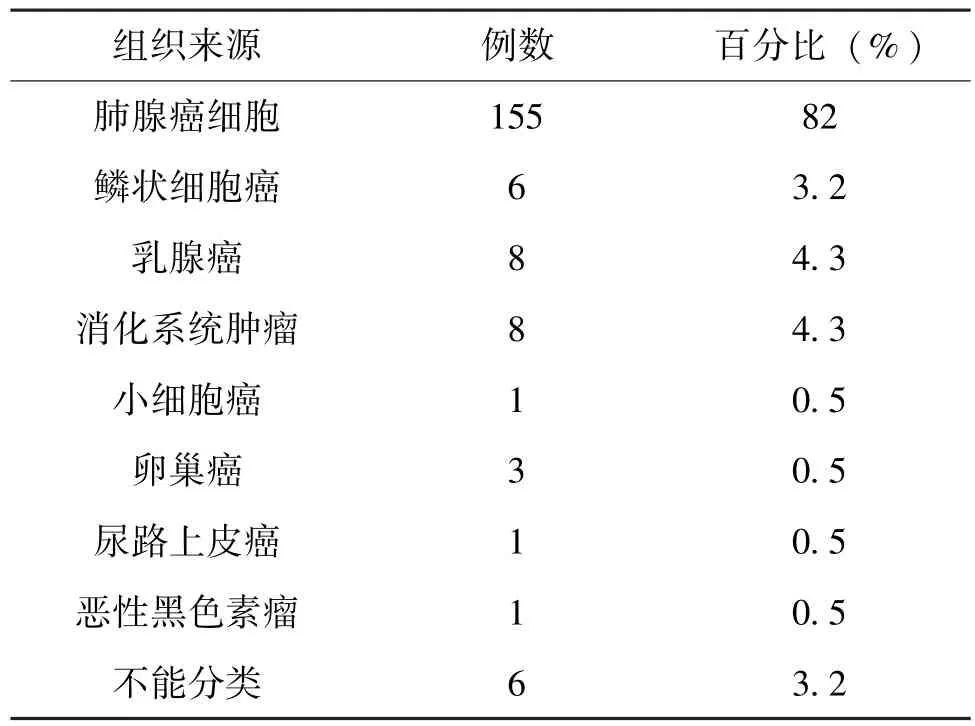
表1 189 例恶性胸水中组织来源
2.3 恶性胸水的免疫组化表达情况
除了 CK7、 TTF-1 及 Napsin A 外, 基于形态学及病史考虑, 再增加部分抗体, 有乳腺癌病史患者细胞学出现ER、 PR、 Mammaglobin 阳性时诊断为转移性乳腺癌。 既往有下肢恶性黑色素瘤病史时, 结合 S-100、 HMB45、 Melan A 弥漫阳性时诊断为转移性恶性黑色素瘤细胞。 有部分病例细胞异型性明显, 血及胸水中的CEA 表达均有不同程度的升高, 免疫组化CEA、 CK 均有表达, 且临床无明确病史且影像学检查也未见实质性占位, 这种情况考虑为恶性胸水, 但是来源不明。
免疫组化结果分析 Napsin A 蛋白阳性颗粒定位于胞浆, 在肺腺癌及其他肿瘤所致的恶性胸水标本中的阳性表达率分别为83.9%及16.1% (差异有统计学意义,P<0.001)。 TTF-1 蛋白阳性颗粒定位于胞核, 在肺腺癌及其他肿瘤所致的恶性胸水标本中的阳性表达率分别为93.5%及6.5%(差异有统计学意义,P<0.001)。 CK7 蛋白阳性颗粒定位于胞浆及胞膜, 在肺腺癌及其他肿瘤所致的恶性胸水标本中的阳性表达率分别为98.1%、1.9% (差异有统计学意义,P<0.001)。 所有病例Napsin A、 TTF-1 和 CK7 表达情况见表 2。
2.4 为了进一步研究胸水CEA、 血清CEA、 免疫组化标记Napsin A、 TTF-1 和CK7 在肺腺癌源性胸水的诊断价值, 我们将所有患者分为肺腺癌组和非肺腺癌组, 患者的一般情况和胸水CEA 和血清CEA 水平及免疫组化标记Napsin A、 TTF-1 和CK7表达情况见表3。 结果表明, 两组患者的年龄无统计学差异 (P>0.05), 但肺腺癌组患者男性比例更高, 差异有统计学意义 (P=0.019); 相对于非肺腺癌组, 肺腺癌组患者的血清CEA 和胸水CEA 水平升高, 其差异有统计学意义 (P均<0.05); 与非肺腺癌组相比较, 肺腺癌组患者的Napsin A、 TTF-1和CK7 表达升高 (P均<0.05)。
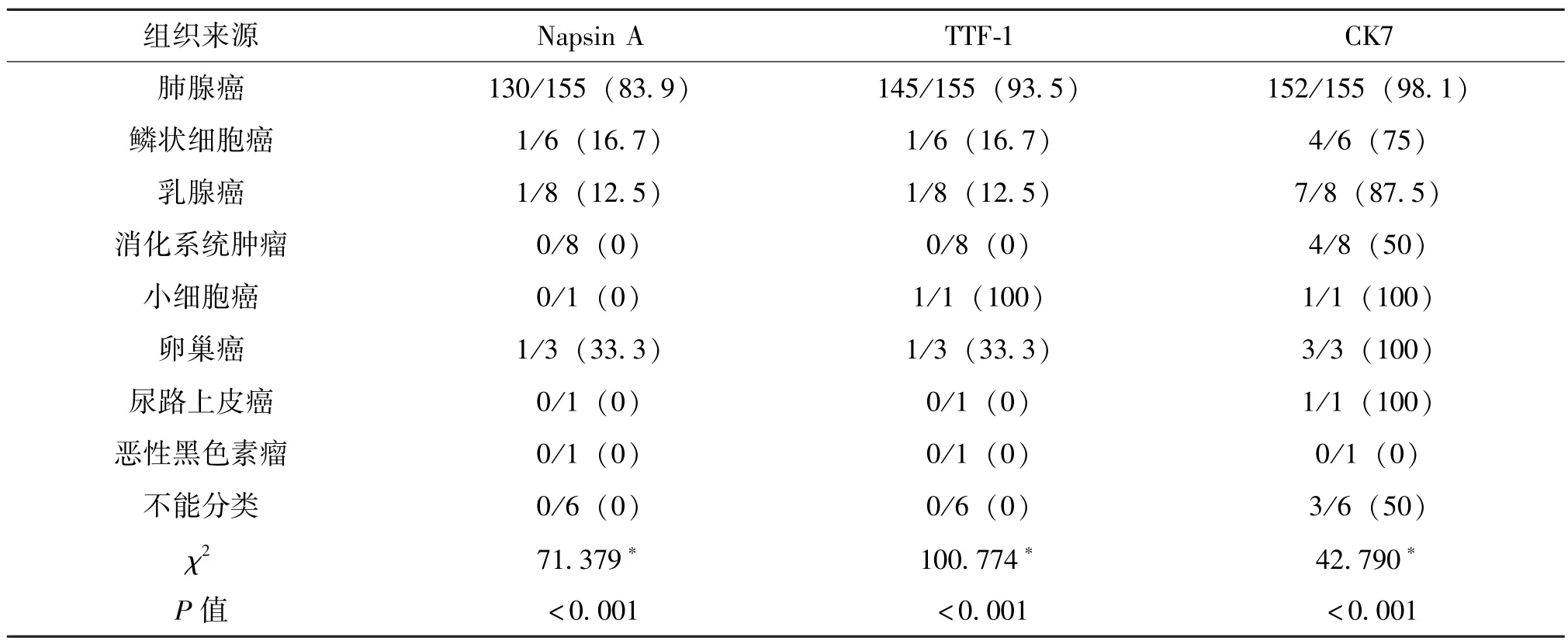
表2 189 例恶性胸水中Napsin A、 TTF-1、 CK7 的表达情况 %

表3 胸水肺腺癌与非肺腺癌比较
2.5 在肺腺癌和其它恶性肿瘤所致恶性积液的鉴别诊断中, Napsin A 诊断肺腺癌的敏感度为83.9%, 特异度为93.9%; TTF-1 诊断肺腺癌的敏感度为93.5%, 特异度为90.9%; CK7 诊断肺腺癌的敏感度为98.1%, 特异度为42.4%。
2.6 采用ROC 曲线绘制血清CEA 和胸水CEA 诊断肺腺癌的曲线下面积见图1。 测得血清CEA 的ROC 曲线面积为0.627,P=0.022, 其诊断肺腺癌的参考值: 7.16 ng/mL, 其诊断肺腺癌的敏感度为69.7%, 特异度为58.5%; 胸水 CEA 的 ROC 曲线面积为0.699,P=0 <0.001, 其诊断肺腺癌的参考值: 90.04 ng/mP, 其诊断肺腺癌的敏感度为69.0%, 特异度为66.7%。
3 讨 论
正常胸腔内有少许浆液, 有润滑作用, 但是在病理状态下浆液可明显增多。 以往, 胸水增多的病因以结核多见, 但是随着恶性肿瘤的增加,恶性胸水不断增多。 细胞蜡块的普及对提高恶性胸水的诊断有很大的帮助。 胸水细胞蜡块具有可重复性、 观察性高及特异度强等优点, 目前在国外许多国家已成为细胞学常规诊断技术[5]。 细胞蜡块结合免疫组化抗体的应用能提高恶性胸水的检出率并进一步判断其组织来源[6-7]。

图1 血清CEA 和胸水CEA 诊断肺腺癌的ROC 曲线
本研究共入选了189 例恶性胸水标本, 结合HE 切片观察、 患者病史及免疫组化 Napsin A、TTF-1 及CK7 等结果综合分析, 我们进一步评估Napsin A、 TTF-1 及CK7 对肺腺癌与其它恶性肿瘤的鉴别能力, 我们将患者分为肺腺癌组和非肺腺癌组, 结果表明, 在本组155 例肺腺癌所致的胸水中Napsin A 敏感度为83.9%, 特异度为93.9%。Napsin A 是一种显著表达于肺和肾脏的天门冬氨酸蛋白酶, 是肺腺癌的一种标记物[8]。 Napsin A 在肺腺癌中的表达与组织学类型和分化程度具有相关性[9], 在原位腺癌、 微浸润腺癌及贴壁型肺癌中100%表达, 但是在浸润性粘液腺癌中阳性率不到50%, 因此当一个浸润性粘液腺癌所致的胸水中Napsin A 可能是阴性表达, 这时与TTF-1、 CK7进行组合诊断更具有诊断价值, 也能避免一部分表达Napsin A 的肿瘤如乳头状透明细胞肾细胞癌[10]及卵巢透明细胞癌[11]的误诊。 本研究中出现了1 例卵巢透明细胞癌转移至胸水, 出现了Napsin A 及CK7 阳性、 TTF-1 阴性表达情况, 结合病史可以避免诊断为肺腺癌细胞的可能。
TTF-1 又称为甲状腺转录因子, 主要分布在成人的内胚层分化甲状腺滤泡细胞呼吸道II 型肺泡上皮等, 属于II 型肺泡的特异度标志物, 可用于肺腺癌诊断。 在排除甲状腺癌后的 TTF-1 的表达水平可作为肺癌的一项特异度标志物, 将TTF-1 和其他抗体联合检测, 可对肺腺癌等进行确诊。文献报道TTF-1 在肺腺癌所致的胸水敏感度在79.2% ~92.6% 之间[12-13]。 本研究的 TTF-1 敏感度为93.5%, 略高于文献, 可能与本研究中非肺源性肿瘤例数较少有关。 本研究显示TTF-1 在肺腺癌所致的胸水特异度为90.9%, 与文献报道[14]的71.1% ~90%相符, 表明在鉴别恶性胸水来源时TTF-1 是个较好的指标。 在本组155 例肺腺癌所致的胸水中Napsin A 敏感度及特异度均较TTF-1 低。 这与Turner 等[15]报道在肺腺癌中表达相符。
CK7 属于角蛋白的一种亚型, 一般情况下,主要表达于肺、 乳腺、 卵巢等上皮处, 在2014 版专家共识[9]中表明CK7 在肺腺癌中100%表达, 敏感度极高; 但是特异度较低。 本研究中表明CK7诊断肺腺癌的敏感度为98.1%, 特异度为42.4%,与共识是接近的[9]。 癌细胞在胸水中处于浸泡状态, 存在一定程度的CK7 抗原丢失, 因此胸水细胞标本CK7 的表达较低。 CK7 在57.7%的非腺癌中阳性表达, 因此, 在肺腺癌鉴别诊断中, 不宜单独使用, 应该联合其他特异度较高的抗体。
然而三者均具有较高的敏感度, Napsin A 和TTF-1 的特异度高达90%以上, 而CK7 的特异度较低, 因而根据指南将三者联合应用, 能在最大程度上诊断出肺腺癌。
目前已有学者将肿瘤标记物CEA 用于肺腺癌的临床诊断中, 有研究表明CEA 是肺癌的一个很好标记物, 且胸水检测优于血清, 在肺腺癌显著升高[16]。本研究对比了血清和胸水CEA 对肺腺癌组及非肺源性恶性胸水组织的鉴别诊断能力。 结果表明, 无论是胸水CEA 还是胸水CEA 在肺腺癌和其它恶性肿瘤的鉴别中均有统计学意义, 使用AUC 曲线测得血清CEA 的其诊断肺腺癌的参考值: 7.16 ng/mL; 胸水CEA 肺腺癌的参考值: 90.04 ng/mL, 与文献[17]中的 (69.98 ±10.65) ng/mL 相近。
综上所述, Napsin A、 TTF-1 及 CK7 在恶性胸水中具有重要价值, 三者的联合应用能极大提高肺腺癌与其它恶性肿瘤来源胸水的鉴别能力, 同时胸水及血清的CEA 值可以做为一个鉴别诊断的参考依据。
