SPOP上调c-Jun蛋白表达并促进肾癌细胞的增殖和侵袭
2021-04-14吴林慧朱雪莲
吴林慧,余 珂,崔 悦,朱雪莲,杨 正,马 佳
蚌埠医学院1肿瘤基础研究与临床检验诊断重点实验室,3检验医学院,4检验医学院生物化学与分子生物学教研室,安徽 蚌埠233030;2安徽省阜阳市妇女儿童医院检验科,安徽 阜阳236000
肾癌是我国泌尿系统最常见的恶性肿瘤,在西方国家肾细胞癌被列入患病率前十名的恶性肿瘤[1]。近年来,肾癌的发病率有逐年增加的趋势,大多数国家的年增长率约为2%~3%。20%~25%的肾癌患者早期即可发生转移,转移肾癌患者的5年生存率不超过10%[19]。系统性治疗转移性肾透明细胞癌有了很大的进展,靶向治疗药物血管表皮生长因子和mTOR被批准用于治疗转移性肾癌[2]。靶向治疗与免疫治疗相结合的联合治疗将是未来转移性肾癌治疗的重要策略[3]。尽管如此,仍有相当一部分患者对靶向治疗产生耐药,并伴随肿瘤恶化,最终导致死亡。因此,深入研究肾癌的相关分子机制将为肾癌的治疗提供新的有效靶点。SPOP蛋白是E3泛素连接酶cullin3的接头分子,构成E3泛素连接酶复合体,在蛋白的泛素化和降解中起着重要作用[4]。SPOP参与调控肿瘤的发生,SPOP在肾癌组织中阳性表达要高于正常对照组织,且与肿瘤的分级、分期、转移、预后相关[5-6]。目前研究已发现Cdc20[7]、TRIM24[8]、ATF2[9]、SIRT2[10]、LATS1[11]等均可被SPOP组成的E3泛素连接酶复合体降解,同时,SPOP也可以作为底物进行泛素化修饰和降解[12]。已有相关文献报道SPOP表达的增加与肾细胞癌的转移成正相关,并诱导上皮细胞间质化和促进肾癌ACHN细胞的侵袭[13];在肾癌A498和ACHN细胞沉默SPOP表达后,抑制肾癌细胞的迁移和诱导细胞的凋亡[14];而目前过表达SPOP后对肾癌细胞凋亡能力的影响并无报道,因此本研究使用786-O、A704、Caki-2三株细胞来充分研究SPOP对肾癌细胞株生物学功能的影响,发现SPOP在肾癌的生长凋亡等起关键作用。并且在研究中发现在肾癌细胞中SPOP能上调c-Jun蛋白的表达,而c-Jun被认为是生长和分化的关键调控分子,其蛋白产物是转录因子激活蛋白-1(AP-1)的组成部分,由Jun和Fos基因家族的同二聚体或异二聚体组成,通过亮氨酸拉链结构域二聚并结合于DNA序列[17],因此本研究以期为肾癌的临床治疗提供理论和实验依据。
1 材料和方法
1.1 材料
SPOP 质粒和对照(EV)由本实验室保存;Lipofectamine3000(Invitrogen);SPOP 抗体(Abcam),c-Jun(cell signaling technology),Anti-Vinculin(Servicebio)、TUNEL BrightRed 凋亡检测试剂盒(Vazyme);胎牛血清(CLARK),四甲基偶氮唑蓝(MTT)(Sigma);RPMI 1640,DMEM,Mccoy's 5A培养基(自Hyclone);Transwell小室和基质胶(BD)。
1.2 细胞培养和细胞转染
细胞培养:肾癌细胞786-O、A704、Caki-2购自上海酶研生物科技有限公司,分别使用含有10%浓度的血清+1%的青霉素-链霉素抗生素的RPMI 1640,DMEM,Mccoy's 5A 培养基,加入相应的完全培养基将细胞放入含5%CO2的37 ℃细胞培养箱中培养,2~3 d 换液,待细胞长至90%以上后传代处理或者做其他相关实验。细胞转染:收集对数生长期细胞,制成单细胞悬液,计数后,均匀接种20万的细胞于六孔板内,待24 h 后细胞长至70%左右的密度转染空载及pcDNA3.1-SPOP 组,转染按照Lipofectamine3000 说明书操作。
1.3 细胞克隆形成实验及MTT法测细胞增殖
克隆形成实验:转染后24 h收集细胞并计数,取5000个细胞接种于6孔板,7 d后用瑞吉氏染液染色拍照,A液染色1 min,在A液的基础上,加B液染色5 min,用纯水润洗六孔板后拍照;MTT法测细胞增殖:转染后24 h收集细胞并计数,取5000个细胞接种于96孔板,设置5个复孔,72 h后每孔加20 μL MTT溶液,4 h后吸去MTT加200 μL DMSO溶液溶解甲臜结晶,30 min后用酶联免疫检测仪测吸光度A490nm。
1.4 创伤愈合实验
六孔板内细胞转染后24 h用10 μL短枪头划痕(记为0 h),在显微镜下拍照留存图片;于划痕后24 h观察细胞迁移情况(记为24 h),在显微镜下拍照留存图片做后续分析[15]。
1.5 Transwell 检测细胞迁移和侵袭
细胞转染24 h后用胰酶消化各组细胞并计数,在24孔板内将细胞接种于未包被(细胞迁移实验)和包被(细胞侵袭实验)基质胶的Transwell小室,做相应的迁移、侵袭实验,方法同我们近期发表的文章[16],培养24 h后先用4%多聚甲醛固定15 min,再用结晶紫染色15 min处理,最后在高倍镜下随机计数5个视野的穿膜细胞数并拍照记录。
1.6 TUNEL法检测细胞凋亡
在玻底培养皿培养细胞,转染72 h后,用PBS漂洗载玻片2次,再用4%多聚甲醛固定,在4 ℃放置25 min,透膜用Proteinase K溶液作用10 min,再加TUNEL反应标记液在37 ℃条件下放置60 min,最后用DAPI染液复染10 min,在荧光显微镜下随机计数5个视野凋亡细胞并拍照记录。
1.7 反转录实时定量聚合酶反应(Real-time PCR)
细胞经过转染24 h 后提取总RNA,反转录成cDNA,再按照荧光定量试剂盒说明书进行操作。PCR所用引物序列如下:SPOP:5'-GCCCTCTGCAGTAA CCTGTC-3' (Forward),5'-GTCTCCAAGACATCCGA AGC-3'(Reverse);c-Jun: 5'-CAACATGCTCAGGGAA CAGGTG-3' (Forward),5'-CTCAGCCCTGACAGTC TGTTCTC-3'(Reverse);内参GAPDH:5'-TATAAATT GAGCCCGCAGCC-3' (Forward),5'-ATGAAGGGGT CATTGATGGCA-3'(Reverse)。
1.8 蛋白免疫印迹
收集转染后的细胞用RIPA(加PMSF)裂解液在冰上裂解30 min,离心后用BCA 试剂盒进行蛋白定量检测,再进行SDS-PAGE 电泳,电泳过后转膜至PVDF 膜,5%牛奶封闭2 h,一抗过夜孵育(4 ℃),次日洗膜后二抗室温孵育2 h,显影后对条带做灰度值扫描。以目的条带和内参的灰度值比值做蛋白表达的定量分析。
1.9 统计学分析
本实验结果采用Graphpad Prism6作图,采用t检验分析,比较组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 SPOP促进肾癌细胞的克隆形成能力及增殖能力
克隆形成实验结果(图1A、B)及MTT结果(图1C~E)显示,SPOP除能影响肾癌细胞的迁移和侵袭,还能促进肾癌细胞的生长能力。

图1 SPOP促进肾癌细胞的克隆形成能力及增殖能力Fig.1 SPOP promote clonal formation and proliferation of renal carcinoma cells.A:Renal cancer 786-O cells transfected with a vehicle plasmid(EV)and SPOP-overexpressing plasmid(SPOP).B:Caki-2 cells transfected with a vehicle plasmid (EV) and SPOP-overexpressing plasmid. C, D, and E:Viability of 786-O cells, CaKi-2 cells and A704 cells transfected with the vehicle plasmid (EV) and SPOP-overexpressing plasmid,respectively.**P<0.01,*P<0.05,***P<0.01 vs control group.
2.2 SPOP促进肾癌细胞的迁移和侵袭
与对照组相比,SPOP过表达能促进786-O细胞和Caki-2细胞的迁移能力(图2A、B);Transwell实验结果显示,与对照组相比,SPOP过表达组肾癌细胞迁移和侵袭数量显著增加(图2C~E)。
2.3 SPOP抑制肾癌细胞的凋亡
TUNEL实验结果显示,在肾癌786-O细胞和Caki-2 细胞过表达SPOP 后,SPOP 显著抑制细胞凋亡(图3A、B)
2.4 过表达SPOP后c-Jun蛋白的表达相应增强
Western blotting实验发现SPOP能上调c-Jun蛋白表达(图4C、D);Real-time PCR结果显示c-Jun mRNA水平无明显变化(图4A、B)。
3 讨论
SPOP既是癌基因又是抑癌基因,例如,在小细胞肺癌当中SPOP是抑癌基因[20];在肝癌细胞中,研究证明SPOP能抑制肝癌细胞的增殖和迁移[21];而在肾癌中,SPOP被认为是一种癌基因,有研究显示,敲除SPOP可以抑制肾癌细胞的生长和诱导凋亡[14,22-23],SPOP能促进肾癌细胞体外成瘤能力及增殖能力[24];在肾透明细胞癌的细胞质中,SPOP表达升高,可诱导细胞增殖和促进肾脏肿瘤的发生。而在正常细胞中,SPOP位于细胞核内,可诱导细胞凋亡[19]。此外,SPOP可以诱导肾癌细胞发生EMT(上皮细胞像间质细胞的转变),促进肿瘤细胞的侵袭,其机制与SPOP 升高β-catenin 和TCF4 的表达有关[13]。因此,SPOP可能是肾癌治疗的潜在分子靶点[19,25]。
对于SPOP在肾癌中的研究尚未完善,因此本研究主要研究SPOP对肾癌恶性生物学功能方面的影响及相关的分子机制,实验结果表明,过表达SPOP后肾癌细胞株的生长和侵袭能力增强,与前期报道结果一致,本研究还发现,在肾癌细胞中过表达SPOP后,该肿瘤细胞的迁移能力增强,凋亡能力被抑制,并且本研究还使用了786-O细胞、A704细胞以及Caki-2细胞,目前并无相关研究报道SPOP对A704细胞功能作用的影响,本实验进一步完善了SPOP在肾癌786-0和Caki-2细胞的相关功能研究。因此本实验结果充分体现了SPOP在肾癌发生的过程中起到关键作用。在分子机制方面,本研究在筛选SPOP靶基因时,还发现c-Jun也是SPOP的目标靶蛋白之一。c-Jun在细胞因子信号转化、生长、分化或凋亡过程中起着重要作用[26],且有研究发现c-Jun分子在肾癌中高表达[18],但是c-Jun发挥作用的具体靶点为何需要进一步去阐释。目前国内外并无相关研究报道SPOP与c-Jun的相关关系,然而本实验在研究中发现SPOP在转录后水平能上调c-Jun蛋白的表达,尽管如此,SPOP具体调控c-Jun的分子机制为何还需要进一步去探究。
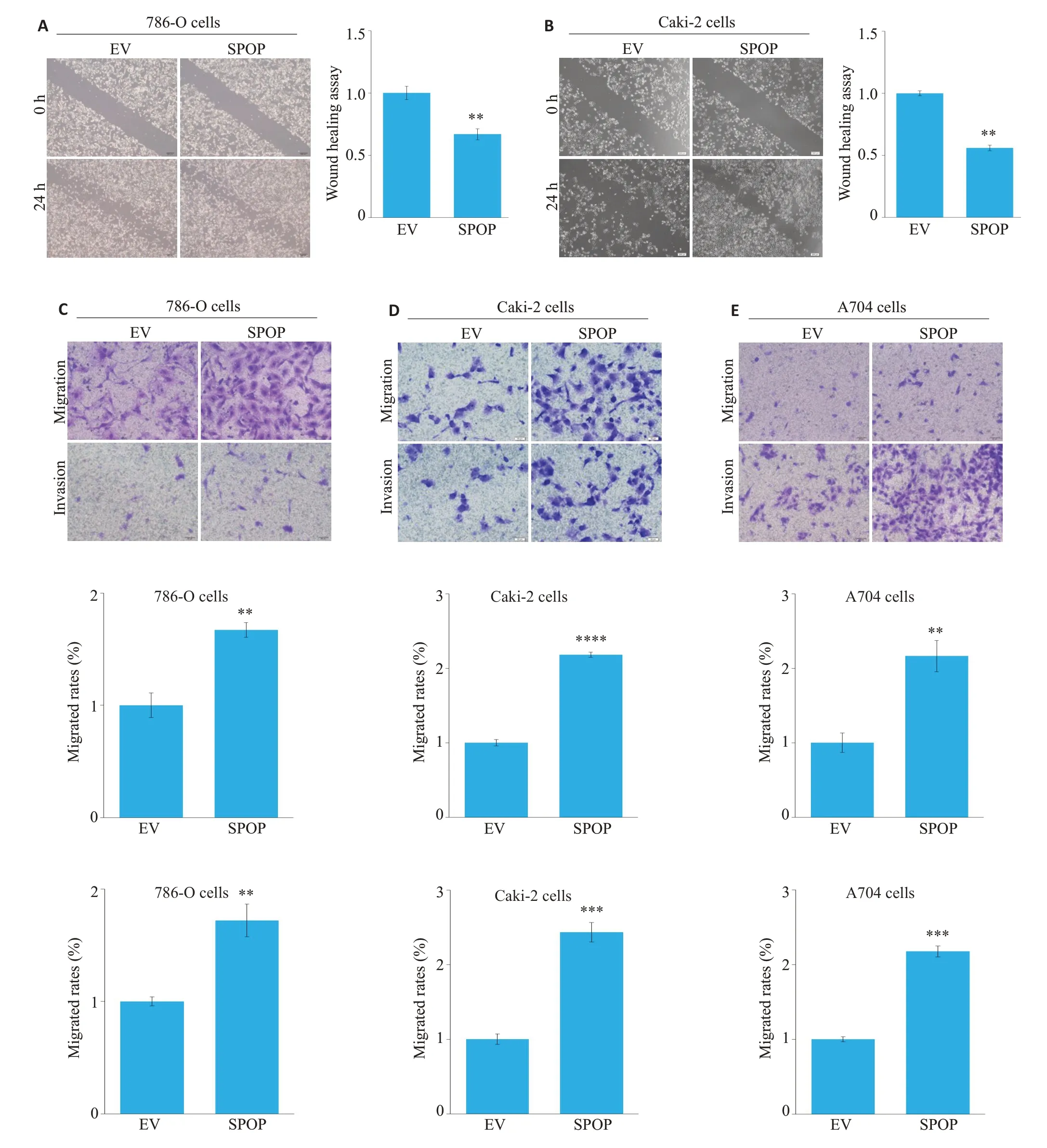
图2 SPOP促进肾癌细胞的迁移和侵袭Fig.2 SPOP promotes migration and invasion of renal carcinoma cells.A,B:Wound-healing assay of 786-O cells and Caki-2 cells transfected with a vehicle plasmid (EV) and SPOP-overexpressing plasmid. (**P<0.01, ***P<0.001 vs control group). C:Invasion and migration assays of 786-O cells,Caki-2 cells and A704 cells transfected with the vehicle plasmid(EV)and SPOPoverexpressing plasmid,respectively.**P<0.01,***P<0.001,****P<0.0001 vs control group.
综上所述,SPOP能促进肾癌细胞的增殖、迁移和侵袭,抑制肾癌细胞的凋亡,促进肾癌恶性生物学功能的进展,并且能上调c-Jun蛋白的表达,将为后续肾癌的临床治疗提供新靶点和新思路,但是对于SPOP在分子机制方面的研究还需要进一步去探索。
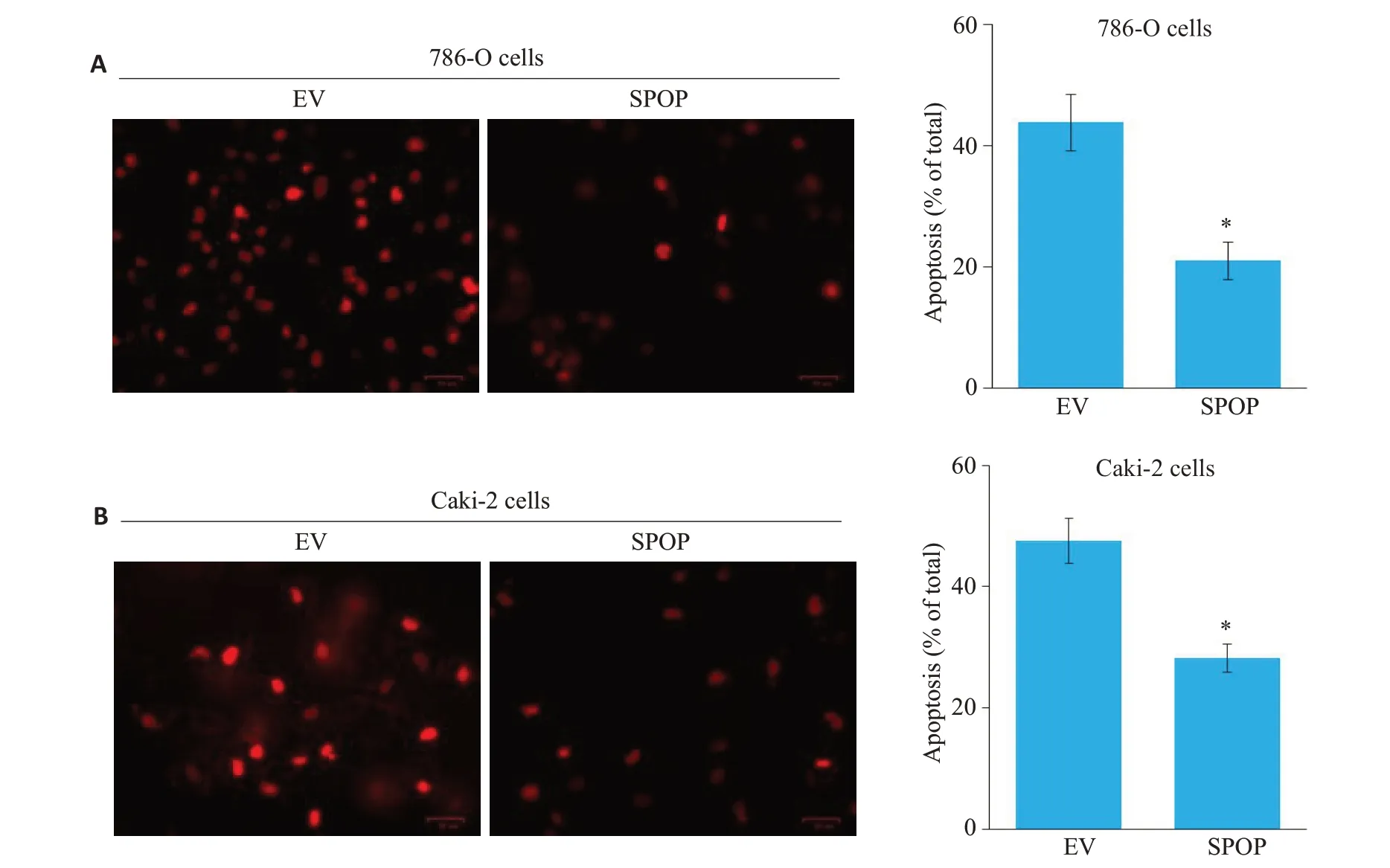
图3 SPOP抑制肾癌细胞的凋亡Fig.3 SPOP overexpression inhibits apoptosis of renal carcinoma 786-O cells (A) and Caki-2 cells (B) (*P<0.05 vs control group).
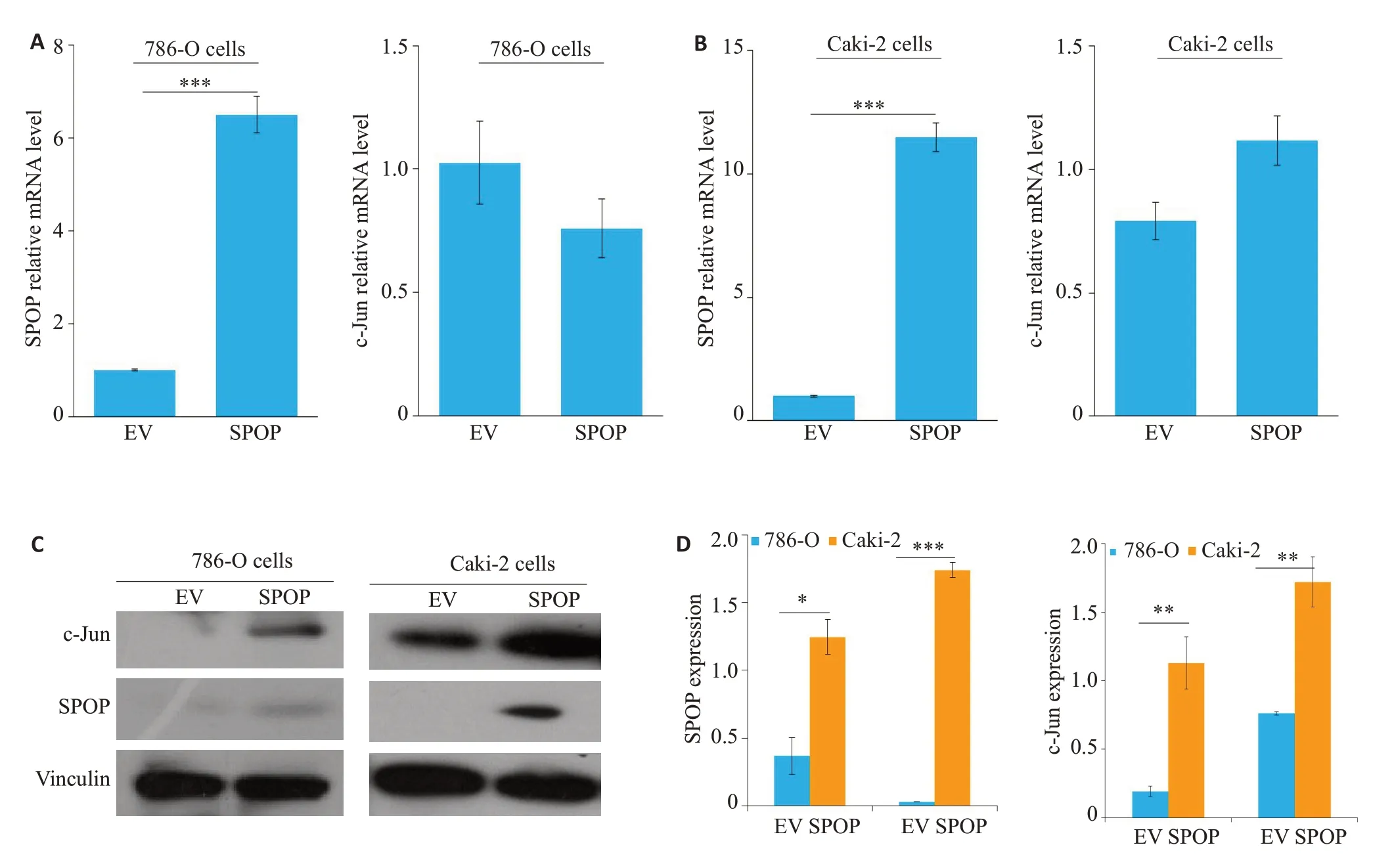
图4 过表达SPOP后c-Jun蛋白的表达相应增强Fig.4 Expressions of c-Jun and SPOP at mRNA and protein levels in 786-O cells and CaKi-2 cells over-expressing SPOP.A, B:Real-time PCR of c-Jun and SPOP mRNA expressions in 786-O cells and CaKi-2 cells,respectively(***P<0.001,****P<0.0001 vs control group). C, D: Western blotting of c-Jun and SPOP protein expressions in SPOP-overexpressing 786-O cells and CaKi-2 cells(C)and quantitative analysis of the results(D)(*P<0.05,**P<0.01,***P<0.001 vs control group).