前列环素和血栓素A2 在机械通气致兔肺通透性增加中的作用机制
2021-04-14李丽莎马文婕刘星玲朱晓燕
李丽莎,李 江,杨 泳,刘 娜,郭 欣,邹 曦,马文婕,刘星玲,朱晓燕,刘 睿
1云南省第一人民医院麻醉科,云南 昆明650032;2昆明医科大学医学机能实验中心,云南 昆明650500;3昆明医科大学基础医学院,云南 昆明650500
肺通透性增加是呼吸机诱导的肺损伤(VILI)的早期关键病理变化环节,肺内炎症介质的大量生成是其重要致病因素[1-2]。在众多的炎症介质中,前列环素(PGI2)是一种强效内源性扩血管和抗血小板聚集物质,而血栓素A2(TXA2)具有强烈的缩血管和促血小板聚集作用。二者分别由前列腺素H2 经前列环素合酶(PGIS)和血栓素合酶(TXS)直接代谢生成[3]。正常生理状态下,它们的比值保持在一恒定水平,此种平衡状态对维持机体的正常机能具有重要意义[4-5]。
我们前期研究发现,单肺通气实验动物肺内大量生成的PGI2和TXA2以及PGI2/TXA2比值的降低是造成实验动物肺通透性增加的重要原因[6]。但有关PGI2和TXA2调控机械通气(MV)实验动物肺通透性的具体作用机制,以及PGI2/TXA2比值变化会对肺通透性产生怎样的影响,目前均不十分清楚。
大量研究发现,肿瘤坏死因子-α(TNF-α)表达水平的增高是造成肺通透性增加的重要原因[7-9]。PGI2及其类似物的生物学活性作用与下调TNF-α表达有关[10-11],而TXA2 的生物学活性作用可通过上调TNF-α而实现[12-13]。据此我们推测TNF-α是PGI2和TXA2的共同作用通路,上调PGI2/TXA2 比值具有抗VILI 保护作用,而下调PGI2/TXA2比值则会加重VILI。
本研究在MV致兔肺损伤动物模型中,分别观察PGIS抑制剂反苯环丙胺和TXS抑制剂达唑氧苯对实验动物肺内TNF-α生成和肺通透性的影响,阐明PGI2和TXA2在MV致肺通透性增加中的作用机制,为临床药物防治VILI提供一定的实验研究基础。
1 材料和方法
1.1 材料
多功能麻醉机(Aestiva/5 7900,Datex Ohmeda.Inc,美国);麻醉监护仪(S/5 Compact,通用电器医疗集团芬兰公司);多参数心电监护仪(M8003A,飞利浦公司);酶标仪(Model NO 550,BIO RAD);显微照相系统(DM4000B,LEICA);达 唑 氧 苯(sc-492401 Santa Cruz);反苯环丙胺(S9464 Selleck);MLCK 抗体(ab76092,abcam);GAPDH 抗体(2118,CST);PGI2(CEA727Ge,优尔生)和TXA2(CEB396Ge,优尔生)检测试剂盒;TNF-α检测试剂盒(GOY-E1354,TSZ);48只健康日本大耳白兔,体质量2.2~2.5 kg,雌雄各半,购自昆明医科大学实验动物中心。本研究项目获云南省第一人民医院医学伦理委员会批准(2015LH026)。
1.2 方法
1.2.1 实验设计 实验动物随机均分为6组(n=8):溶剂治疗组(V组);反苯环丙胺治疗组(T组);达唑氧苯治疗组(D组):溶剂治疗+MV组(VM组);反苯环丙胺治疗+MV组(TM组)和达唑氧苯治疗+MV组(DM组)。
1.2.2 机械通气的实施、术中监测和麻醉维持 戊巴比妥钠(30 mg/kg)经耳缘静脉注入麻醉后,颈正中切口分离暴露气管、左侧颈总动脉和右侧颈静脉。左颈总动脉置管持续监测动脉血压,右侧颈静脉置管恒速输注林格氏液(10 mL·kg-1·h-1),维持血压波动在基础值±20%之间。随后,非MV实验动物麻醉状态下保留自主呼吸,MV各组经右颈静脉注入芬太尼(8 μg/kg)和维库溴铵(0.2 mg/kg),待实验动物呼吸停止后插入带套囊气管导管(ID 2.0 ~2.5 mm),接呼末CO2监测仪和麻醉机,实施时长为2 h的MV:吸入氧浓度(FiO2)=1.0;潮气量(VT)=20 mL/kg,调整呼吸频率(RR)维持呼末CO2在35~45 mmHg范围内,吸气时间:呼气时间(I∶E)=1∶2。MV过程中以恒速输注丙泊酚(8 mg·kg-1·h-1)和瑞芬太尼(10 μg·kg-1·h-1),每30 min追加维库溴铵0.1 mg/kg维持麻醉。
1.2.3 反苯环丙胺和达唑氧苯的给予方法 参照他人研究[14-15]和我们之前预实验的方法,将反苯环丙胺和达唑氧苯分别以10 mg/mL和15 mg/mL的浓度溶解于生理盐水中,药物治疗组于取材前2 h或MV即刻经右侧颈静脉给予各自对应的药物(反苯环丙胺:10 mg/kg;达唑氧苯:15 mg/kg),并于取材前1 h或MV 1 h时再次追加之前用量的1/2。溶剂治疗组则在相应时间点给予同等容积的溶剂。
1.2.4 肺组织取材 V组、T组和D组实验结束后经耳缘静脉注入3%戊巴比妥钠(30 mg/kg)麻醉状态下取材,MV实验动物于实验结束后取材。收集各组实验动物左肺支气管肺泡灌洗液(BALF)用于测定肺通透性指数和TNF-α含量,右肺用于检测其余各指标。
1.2.5 肺通透性的评价方法
1.2.5.1 肺通透性指数和肺湿/干质量(W/D)比值测定肺通透性指数和肺W/D比值(右肺上叶)测定的方法同之前实验研究[16]。
1.2.5.2 肺通透性增加的分子标志物测定 肌球蛋白轻链激酶(MLCK)的表达水平可作为反映肺通透性增加程度的分子标志[17]。运用Western blot检测右肺上叶MLCK蛋白表达水平(具体方法详见1.2.9)。
1.2.6 肺组织学评分 靠右肺上叶外1/2内侧处切取肺组织,行HE染色。参照之前方法[6,16]在光学显微镜下对肺组织进行形态学评分。
1.2.7 肺PGI2、TXA2 含量及PGI2/TXA2 比值测定TXA2和PGI2在体内的半衰期分别为30 s和3 min,难以直接测定,目前均以各自稳定代谢产物TXB2和6-KPGF1α分别作为反映TXA2和PGI2含量的指标[4,6,8]。运用相应ELISA试剂盒检测右肺中间两叶TXB2和6-KPGF1α含量,计算6-K-PGF1α/TXB2比值。
1.2.8 肺组织和BALF中TNF-α含量测定 运用ELISA试剂盒检测肺组织和BALF中TNF-α含量,具体方法按试剂盒说明书进行操作。
1.2.9 Western blot实验 称取肺组织100 mg,向其中加入1 mL 组织裂解液,电动匀浆机器匀浆后冰浴裂解10 min,4 ℃12 000 r/min 离心10 min,吸取上清液,BCA法测定蛋白浓度。各样本均恒上样量70 μg,60 V电压电泳30 min,90 V电压电泳40 min,100 V电压湿转法转膜2 h。TBST充分洗膜。室温封闭1 h,加入对应浓度的一抗(MLCK,1∶1000;GAPDH,1∶2000),4 ℃孵育过夜。洗膜后加入HRP标记二抗(abmart,1∶2000),室温孵育1 h。TBST漂洗PVDF膜4次,5 min/次。将配制好的HRP 底物显色液(millipore)滴加到待显影的PVDF膜上并涂抹均匀,采用化学发光仪(Bio-Rad)采集图片,所得图片用Image J软件分析灰度值。
1.3 统计学处理
所有数据为计量资料,以均数±标准差表示,采用SPSS 23.0软件进行统计学分析。多组间的比较采用单因素方差分析,两两比较采用SNK法,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组动物肺通透性指标变化和肺组织学评分
单纯给予溶剂、反苯环丙胺或达唑氧苯治疗对实验动物肺通透性相关指标[肺湿/干质量比值(图A)、肺通透性指数(图B)和肌球蛋白轻链激酶蛋白(图C1,C2)表达水平]和肺组织学评分(图D)无显著影响;VM组实验动物肺通透性和肺组织学评分明显增高(P<0.05);反苯环丙胺治疗使MV实验动物肺通透性和肺组织学评分进一步增加(P<0.05),而达唑氧苯治疗可显著降低MV实验动物肺通透性和肺组织学评分(P<0.05,图1)。

图1 各组动物肺通透性评价指标和肺组织学评分Fig.1 Lung W/D ratio(A),pulmonary permeability index(B),expression of MLCK protein(C1 and C2)and histological scores(D)in different groups.▲P<0.05 vs V group.★P<0.05 vs VM group.◇P<0.05 vs TM group.V:Vehicle treatment group.T:Tranylcypromine treatment group.D:Dazoxiben treatment group.VM:Vehicle treatment plus mechanical ventilation group.TM:Tranylcypromine treatment plus mechanical ventilation group.DM:Dazoxiben treatment plus mechanical ventilation group.
2.2 肺组织形态学(HE染色)
V组、T组和和D组实验动物肺组织部分区域见毛细血管扩张充血、肺泡腔内少量炎症细胞外,无明显病理改变。VM组动物肺组织肺泡腔内较多红细胞和炎症细胞浸润,肺泡壁增厚和渗出,TM组实验动物上述病理学改变较VM组明显加重,而DM组却显著减轻(图2)。
2.3 各组动物BALF和肺组织TNF-α含量
单纯给予溶剂、反苯环丙胺或达唑氧苯不影响实验动物BALF(图3A)和肺组织(图3B)TNF-α含量;VM组实验动物BALF和肺组织TNF-α含量均明显增加(P<0.05),TM组实验动物BALF和肺组织TNF-α含量进一步增加(P<0.05),而DM 组实验动物BALF 和肺组织TNF-α含量明显降低(P<0.05,图3)
2.4 各组动物肺组织6-K-PGF1α和TXB2 含量及6-KPGF1α/TXB2比值变化情况

图2 各组动物肺组织HE染色Fig2 Lung histology in different groups (HE staining, original magnification: ×400). A: Group V. B: Group T. C:Group D.D:Group VM.E:Group TM.F:Group DM.
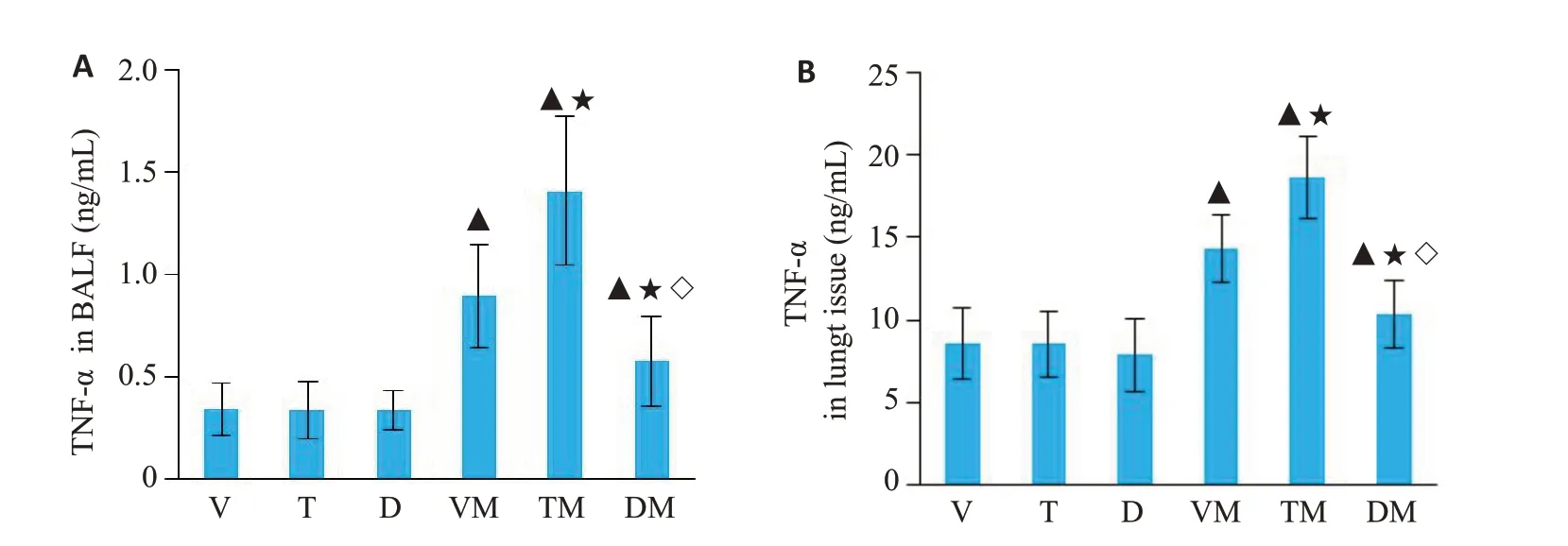
图3 各组动物BALF和肺组织TNF-α含量Fig.3 Contents of TNF-α in BALF(A)and lung tissue(B)in different groups.▲P<0.05 vs V group,★P<0.05 vs VM group,◇P<0.05 vs TM group.
单纯给予溶剂或抑制剂治疗对非MV实验动物肺内6-K-PGF1α和TXB2含量及6-K-PGF1α/TXB2比值均无显著影响;MV实验动物肺内6-K-PGF1α和TXB2含量及6-K-PGF1α/TXB2比值均显著增加(P<0.05);反苯环丙胺使MV实验动物肺内6-K-PGF1α含量显著减少(P<0.05),6-K-PGF1α/TXB2比值下降(P<0.05);达唑氧苯明显减少MV实验动物肺内TXB2生成(P<0.05),进一步增加6-K-PGF1α/TXB2比值(P<0.05,图4)。
3 讨论
虽然目前将VT设置为6~8 mL/kg(理想体质量)的“肺保护性通气策略”已得到临床广泛认可。但肺CT扫描显示,对于非均质性肺部疾病(如非均质性肺气肿、ARDS等)的患者来说,采用潮气量小于10 mL/kg的“非伤害性”通气模式,局部肺组织的潮气量往往都超过了20 mL/kg[18]。对于ARDS患者,即使将潮气量设置为7 mL/kg,通气局部肺组织的潮气量仍接近20 mL/kg[19]。所以,在本研究中,我们将潮气量为设置为20 mL/kg,以期对临床实际工作提供一定的实验研究基础。
研究发现,MV实验动物肺内PGI2和TXA2大量生成,出现明显的肺损伤。这与我们之前的研究结果相同[6]。但在之前的研究中,我们发现右侧单肺通气实验动物通气侧肺组织PGI2/TXA2比值较假手术实验动物显著降低[6],而在本研究中却发现VM组实验动物肺组织PGI2/TXA2比值较V组显著增加。Wilson等[20]认为只有VT高达30~40 mL/kg才会对小鼠肺组织造成不可逆的损伤。研究发现,大潮气量通气20 min即可引起的实验大鼠肺水含量和肺泡腔蛋白含量的增加,如果大VT降低得比较快,上述肺损伤恢复得也比较快[21]。在之前研究中,我们对实验动物实施的是为时2 h VT=20 mL/kg的单肺通气加1 h VT=20 mL/kg的双肺通气,而本研究仅对实验动物实施了为时2 h VT=20 mL/kg的双肺通气。所以我们推测出现此现象的原因是之前研究所用通气参数设置对通气侧肺组织已产生了不可逆的损害,使之处于失代偿状态。而在本研究所用通气参数设置情况下,实验动物肺组织可能处于代偿状态。此外,本研究结果提示,PGI2/TXA2比值的变化或许可作为判断MV实验动物肺损伤处于代偿还是失代偿状态的指标。

图4 各组动物肺组织6-K-PGF1α和TXB2含量及6-K-PGF1α/TXB2比值变化Fig.4 Contents of 6-K-PGF1α(A)and TXB2(B)and 6-K-PGF1α/TXB2 ratio(C)in lung tissues in different groups.▲P<0.05 vs V group,★P<0.05 vs VM group,◇P<0.05 vs TM group.
由于PGI2 具有抗肺通透性增加保护作用,而TXA2有促进肺通透性增加作用。本研究发现VM组实验动物肺组织PGI2/TXA2比值增高的同时却出现了明显的肺损伤。虽然本研究不能对此现象的本质做出确切解释,但正如PGI2对大鼠全脑缺血再灌注损伤具有保护作用,而TXA2会加重该损伤,与正常对照相比,全脑缺血-再灌注组实验动物PGI2/TXA2比值显著增高的同时,却出现了明显的神经元损伤一样[4]。我们推测可能是机体自身防御机能被激活的结果。大量研究发现,PGI2与其受体结合后可通过多种途径下调TNF-α表达[22-24],而TXA2会促进TNF-α表达[8,25-26],但本研究却发现VM 组实验动物PGI2/TXA2 比值显著增加的同时,却出现了TNF-α生成的明显增多。对此,我们推测可能是VM组实验动物肺组织PGI2/TXA2比值显著增加并不足以消除其它致病因素介导TNF-α表达水平的增加,亦或增加的PGI2对TNF-α的抑制作用明显弱于增加的TXA2对TNF-α表达的促进作用。但鉴于本研究的局限性,其中具体作用机制仍需进一步深入阐明。
研究进一步发现,减少MV实验动物肺内TXA2的生成会造成肺组织TNF-α表达水平的降低并减轻MV诱导的肺通透性增加,而减少MV实验动物肺内PGI2的生成会造成肺组织TNF-α表达水平的增高并加重MV诱导的肺通透性增加,这一研究结果提示TXA2可通过上调TNF-α表达引起MV实验动物肺通透性增加,而PGI2可通过下调TNF-α表达减轻MV诱导的肺通透性增加。除此之外,研究还发现MV实验动物BALF和肺组织TNF-α含量增高或降低的同时伴随着MLCK表达水平的增高或降低。由于MLCK的活化可直接引起肌动蛋白-肌球蛋白收缩和横向细胞肌动蛋白束(应力纤维)形成,造成细胞收缩和内皮细胞屏障功能破坏。这一研究结果提示TNF-α造成MV实验动物肺通透性增加的机制与上调肺组织MLCK表达水平有关。其具体作用机制可能与TNF-α使细胞内钙离子浓度增加[12],核因子-κB 激活[27]等有关。
综上所述,本研究首次证实了TXA2可通过上调TNF-α/MLCK信号通路活性引起MV实验动物肺通透性增加,而PGI2可通过下调TNF-α/MLCK信号通路活性发挥其抗MV诱导的肺通透性增加保护作用。但鉴于本研究的局限性和肺通透性调控机制的复杂性,对于PGI2和TXA2对TNF-α调控作用大小、具体机制,以及除TNF-α外,PGI2和TXA2是否还可通过其它信号通路调控肺通透性等问题均待于进一步的深入研究。