麝香保心丸对小鼠动脉粥样硬化斑块形成的影响及相关机制探讨
2021-04-09戴婷何文明麦一峰
戴婷 何文明 麦一峰
动脉粥样硬化(atherosclerosis,AS)是一种慢性进行性疾病,以血管内膜形成粥样斑块为特征,主要累及大中型动脉,造成血管腔狭窄、血管壁弹性减弱[1-2],从而引起相应器官继发性改变,重则导致脑卒中、心肌梗死等。在我国,AS 的患病率不断上升,对社会和经济的发展造成了严重负担[3]。麝香保心丸是一种中药制剂,含有七种常见的中药物质,包括麝香、人参提取物、牛黄、肉桂、蟾酥、苏合香和冰片[4],在冠心病中广泛使用,并具有一定疗效[5-7],但目前对其抗AS 作用机制的研究并不深入。本研究使用载脂蛋白E(apolipoprotein E,ApoE)基因敲除小鼠以建立AS 动物模型,探讨麝香保心丸对小鼠AS 斑块形成的影响,并从脂质代谢、炎症级联反应、斑块稳定性等方面探索相关机制,现报道如下。
1 材料和方法
1.1 实验动物 SPF 级6 周龄健康雄性C57BL/6小鼠10 只,重量(20.0±2.0)g;6 周龄健康雄性ApoE-/-小鼠20 只,重量(25.0±1.8)g,均购于北京维通利华公司,由宁波大学医学院动物房饲养,批准编号:2018-01。
1.2 药物、试剂和仪器 高脂饲料购自北京博泰宏达生物有限公司(批号:2017072304,规格2 kg)。麝香保心丸由上海和黄药业有限公司生产。白介素(interleukin,IL)-1βELISA 试剂盒购自美国R&D Systems 公司,单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)ELISA 试剂盒购自武汉华美生物工程有限公司;TRIzol 试剂购自美国Ambion 公司;HiFiScript cDNA 第一链合成试剂盒购自北京康为世纪生物科技有限公司;FS essential DNA green Marker 购自美国罗氏公司;引物均购自深圳华大基因股份有限公司;抗α-平滑肌肌动蛋白(alphasmooth muscle actin,α-SMA)抗体(ab5694)、抗CD68 抗体(ab125212)和抗CD31(ab28364)抗体均购自美国abcam 公司;免疫组化试剂盒、油红O染色液均购自北京索莱宝科技有限公司。全自动生化分析仪为深圳库贝尔生物科技有限公司产品;高速冷冻离心机、PCR 仪为德国Eppendorf 公司产品;荧光定量PCR 仪为美国Roche 公司产品(LightCycler 480Ⅱ);冰冻切片机和酶标仪均为美国Thermo公司产品;普通光学显微镜为日本Olympus 产品;倒置相差显微镜为Nikon 仪器(上海)有限公司产品。
1.3 方法
1.3.1 动物分组 10 只C57BL/6 小鼠作为对照组,普通饲料喂养。20 只ApoE-/-小鼠高脂饲料喂养8周建立AS 模型后,按照随机数字表法分为两组:APOE-/-模型组10 只,采用0.9%氯化钠溶液灌胃,1 mL/d;麝香保心丸组10 只,将麝香保心丸30 mg/kg溶于1 mL 0.9%氯化钠溶液灌胃,1 mL/d,剂量按照小鼠与人体表面积换算成等效剂量。每组灌胃1 次/d,持续8 周后无小鼠死亡,处死各组小鼠,取血液及病理标本用于后续实验。
1.3.2 血清脂质水平及IL-1β、MCP-1 水平检测各组小鼠眼球静脉取血约1 mL,室温静置30 min,3 000 r/min 离心10 min 后取上清液,采用全自动生化分析仪检测血清中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoproteincholesterol,HDL-C)和低密度脂蛋白胆固醇(low density Lipoprotein cholesterol,LDL-C)水平。按照ELISA 试剂盒说明书的步骤,使用ELISA 法检测各组小鼠血清中炎症因子IL-1β 和促炎细胞因子MCP-1 水平。
1.3.3 主动脉大体油红O 染色 小鼠腹腔注射10%水合氯醛0.2 mL 麻醉,麻醉后立刻暴露心脏,经左心室快速注射0.9%氯化钠溶液以清除残余血液,取小鼠心脏主动脉开口处至腹主动脉肾动脉分支处的主动脉组织,分离周围结缔组织后纵向剖开血管,油红O 染料染15 min,用70%酒精分化3 min,蒸馏水冲洗后平铺拍照,采用Image J 软件分析图像。
1.3.4 主动脉根部冰冻切片油红O 染色 取用分离后的小鼠心脏及主动脉,剪取小鼠心脏主动脉开口处的组织,4%多聚甲醛4 ℃过夜后再分别放入20%及30%蔗糖溶液梯度脱水处理各24 h,OCT 包埋后放入液氮速冻,-80 ℃保存。冰冻切片机以8 μm厚度进行连续切片,从显微镜下能观察到主动脉瓣膜形状开始进行标记,各组小鼠选取相同标记号的切片进行油红O 染色。切片室温回温,蒸馏水浸泡1 min,60%异丙醇浸润2 min,油红O 染液孵育15 min,60%异丙醇调色5 s,流水冲洗5 min,苏木素复染1 min,盐酸酒精分化3 s,流水冲洗反蓝,中性树脂封片。切片拍照后采用Image J 软件分析图片中AS 斑块的面积。
1.3.5 小鼠主动脉及肝脏组织中细胞因子、脂质代谢相关基因mRNA 的相对表达量检测 检测小鼠主动脉组织中IL-8、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、MCP-1、基质金属蛋白酶1(matrix metalloproteinase-1,MMP-1)、微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3-Ⅱ,LC3-Ⅱ)、自噬相关基因p62(Sequestosome 1,p62)和Beclin1 mRNA 的相对表达量,肝脏组织中胆固醇调节元件结合蛋白(sterol-regulatory element binding proteins,SREBP)-2、低密度脂蛋白受体(low density lipoprotein receptor,LDLR)、ATP 结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)和ATP 结合盒转运体G1(ATPbinding cassette transporter G1,ABCG1)mRNA 的相对表达量。分别研磨小鼠主动脉组织和肝脏组织,用TRIzol 试剂提取总RNA,测定RNA 浓度和纯度后逆转录为cDNA,最后在荧光定量PCR 仪中进行反应。PCR 反应引物序列见表1。反应体系为20 μL,反应条件为:94 ℃预变性5 min,PCR 循环95 ℃10 s,56 ℃20 s,72 ℃30 s,72 ℃延伸1 min,共45 个循环。采用2-ΔΔCT法对结果进行分析。
1.3.6 主动脉斑块中α- 平滑肌肌动蛋白(alphasmooth muscle actin,α-SMA)、CD68 和CD31 蛋白的表达检测 选取相对应编号的各组小鼠主动脉根部冰冻切片,选用平滑肌细胞抗体α-SMA,巨噬细胞标志物CD68 和内皮细胞标志物CD31,按照免疫组化试剂盒步骤分别检测相应蛋白的表达量。在400 倍显微镜下观察,免疫组化阳性染色为棕黄色或棕褐色,每例随机观察3 个以上视野,阳性率=平均光密度/阳性着色面积×100%。
1.4 统计学处理 采用SPSS19.0 统计软件,计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果

表1 PCR 反应引物序列
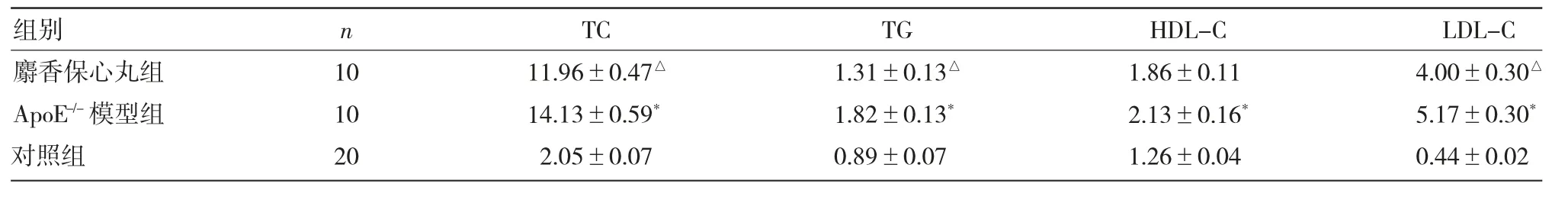
表2 各组小鼠血清脂质水平比较(mmol/L)
2.1 各组小鼠血清脂质水平比较 见表2。
由表2 可见,与对照组小鼠比较,ApoE-/-模型组小鼠血清TC、TG、HDL-C 和LDL-C 水平均升高,差异均有统计学意义(均P<0.01);与ApoE-/-模型组比较,麝香保心丸组小鼠血清TC、TG 和LDL-C均降低,差异均有统计学意义(均P<0.05),HDL-C水平虽有降低,但差异无统计学意义(P>0.05)。
2.2 各组小鼠血清IL-1β 和MCP-1 水平比较见表3。

表3 各组小鼠血清IL-1β 和MCP-1 水平比较(pg/mL)
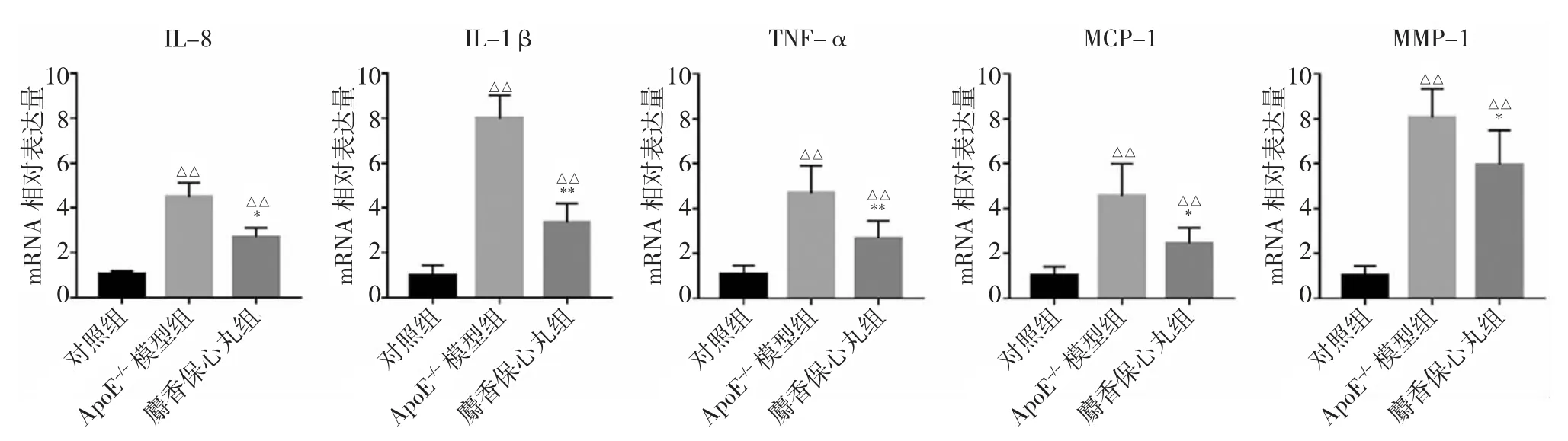
图3 各组小鼠主动脉组织中炎症因子和细胞因子mRNA 的相对表达量比较(注:与对照组比较,△△P<0.01;与ApoE-/-模型组比较,*P<0.05,**P<0.01。IL 为白介素,TNF 为肿瘤坏死因子,MCP 为单核细胞趋化蛋白,MMP 为基质金属蛋白酶)
由表3 可见,与对照组小鼠比较,ApoE-/-模型组小鼠血清IL-1β 和MCP-1 水平增加,差异均有统计学意义(均P<0.01);与ApoE-/-模型组比较,麝香保心丸组小鼠血清IL-1β 和MCP-1 水平降低,差异均有统计学意义(均P<0.05)。
2.3 各组小鼠主动脉大体AS 斑块油红O 染色结果 见图1(插页)。
由图1 可见,对照组小鼠主动脉壁光滑平整,无AS 斑块产生;ApoE-/-模型组小鼠主动脉壁可见大量被油红O 染红的AS 斑块,占整条主动脉的比例约为26.3%±2.0%,斑块大小不一,多位于动脉分叉处;麝香保心丸组小鼠主动脉壁可见AS 斑块,占整条主动脉的比例约为17.0%±1.3%,较ApoE-/-模型组减少,差异有统计学意义(P<0.05)。
2.4 各组小鼠主动脉根部切片AS 斑块油红O 染色结果 见图2(插页)。
由图2 可见,对照组小鼠主动脉根部切片中组织的形态正常,内膜结构完整,中膜平滑肌排列整齐,管腔内无赘生物;ApoE-/-模型组小鼠主动脉根部切片中可明显观察到中膜的平滑肌层被炎性细胞浸润、破坏,管腔内存在被油红O 染成红色的AS 斑块组织,斑块面积为(419 841±26 590)μm2,内含大量胆固醇结晶和坏死核心;麝香保心丸组小鼠主动脉根部也存在斑块组织,斑块面积为(533 710±24 309)μm2,较ApoE-/-模型组减少,差异有统计学意义(P<0.05)。
2.5 各组小鼠主动脉组织中炎症因子和细胞因子mRNA 的相对表达量比较 见图3。
由图3 可见,与对照组小鼠比较,ApoE-/-模型组小鼠主动脉组织中IL-8、IL-1β、TNF-α、MCP-1、MMP-1 mRNA 的相对表达量均升高,差异均有统计学意义(均P<0.01);与ApoE-/-模型组比较,麝香保心丸组小鼠主动脉组织中IL-8、IL-1β、TNF-α、MCP-1 和MMP-1 mRNA 的相对表达量均下降,差异均有统计学意义(均P<0.05)。
2.6 各组小鼠肝脏组织中脂质代谢相关基因mRNA 的相对表达量比较 见图4。
由图4 可见,与对照组小鼠比较,ApoE-/-模型组 小 鼠 肝 脏 组 织 中SREBP-2、LDLR、ABCA1 和ABCG1 mRNA 的相对表达量差异均无统计学意义(均P>0.05);而与ApoE-/-模型组比较,麝香保心丸组小鼠肝脏组织中SREBP-2、LDLR 和ABCA1 mRNA 的相对表达量上调,差异均有统计学意义(均P<0.05)。
2.7 各组小鼠主动脉组织中平滑肌细胞、巨噬细胞和内皮细胞含量比较 见图5(插页)。
由图5 可见,与对照组小鼠比较,ApoE-/-模型组小鼠主动脉组织中平滑肌细胞含量降低,巨噬细胞含量增加,差异均有统计学意义(均P<0.05),内皮细胞含量差异无统计学意义(P>0.05);与ApoE-/-模型组小鼠比较,麝香保心丸组小鼠主动脉组织中巨噬细胞含量减少(P<0.05),而平滑肌细胞和内皮细胞含量差异均无统计学意义(均P>0.05)。
2.8 各组小鼠主动脉组织中自噬相关基因mRNA的相对表达量比较 见图6。
由图6 可见,与对照组小鼠比较,ApoE-/-模型组小鼠主动脉组织中自噬相关基因LC3-Ⅱ和Beclin1 mRNA 相对表达量下降,差异均有统计学意义(均P<0.05),p62 mRNA 的相对表达量差异无统计学意义(P>0.05);与ApoE-/-模型组比较,麝香保心丸组小鼠主动脉组织中p62 mRNA 相对表达量下降,Beclin1 和LC3-ⅡmRNA 相对表达量上升,差异均有统计学意义(均P<0.05)。

图4 各组小鼠肝脏组织中脂质代谢相关基因mRNA 的相对表达量比较(与ApoE-/-模型组比较,*P<0.05;SREBP 为胆固醇调节元件结合蛋白,LDLR 为低密度脂蛋白受体,ABCA1 为ATP 结合盒转运体A1,ABCG1 为ATP 结合盒转运体G1)
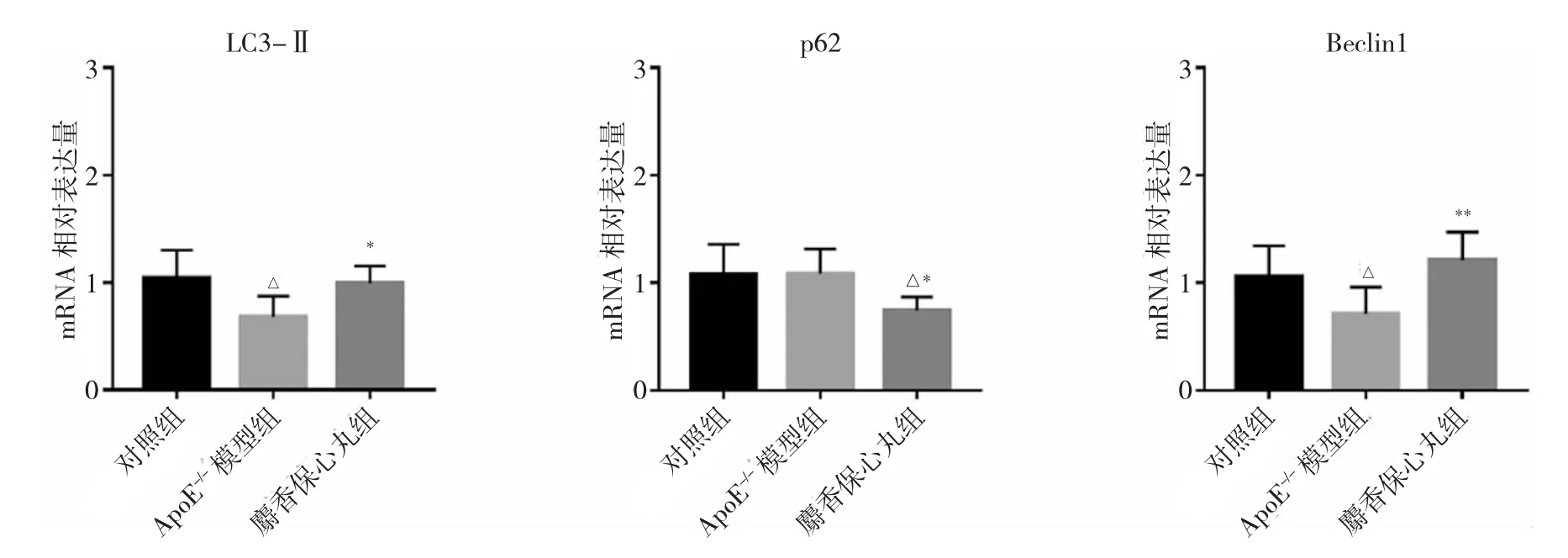
图6 各组小鼠主动脉组织中自噬相关基因mRNA 的相对表达量比较(与对照组比较,△P<0.05;与ApoE-/-模型组比较,*P<0.05,**P<0.01。LC3-Ⅱ为微管相关蛋白1 轻链3)
3 讨论
异常的慢性炎症反应是加速斑块发生发展和增加斑块不稳定性的主要因素[8]。在AS 斑块形成的过程中,各种刺激诱使内皮细胞活化,增加炎性细胞因子和促炎因子的释放,如IL-8、MCP-1 等,促进了血液单核细胞的募集和黏附[9]。单核细胞渗入内皮下并被诱导转变为巨噬细胞,产生MMPs 和大量炎症因子,加剧了局部炎症反应[10],从而促进了AS 斑块的形成。MMP-1 属于MMP 家族,能有效降解细胞外基质[9],因此巨噬细胞分泌的MMP-1 增加会破坏细胞外基质合成与降解的平衡,加剧AS 斑块的不稳定,促进斑块的破裂。我们之前的研究已证明通过抑制炎症可有效抑制AS 的进程[11],本实验在用麝香保心丸治疗后,主动脉组织中炎症因子IL-8、IL-1β、TNF-α 和细胞因子MCP-1、MMP-1 的基因表达显著下调,血液中IL-1β 和MCP-1 水平也显著降低。因此,麝香保心丸可以通过抑制炎症反应来减缓AS斑块的发展,并且也起到了稳定AS 斑块的作用。
此外,AS 斑块的稳定性与斑块的形态相关,晚期AS 斑块中坏死核心区域的不断扩大会诱发斑块破裂,引起急性心脑血管事件[8]。本研究显示,麝香保心丸显著减轻了整条主动脉和主动脉根部的AS斑块病变负担,小鼠AS 斑块中的炎性巨噬细胞含量降低,坏死核心区域面积也有所下降,这都有助于增强AS 斑块的稳定性,对疾病的结果具有积极影响。
除了异常的炎症反应外,血脂异常,特别是血清LDL-C 水平升高,也是引起AS 发生和发展的关键因素之一[12]。肝脏是参与脂质转运和代谢的重要器官,在维持血液和细胞内脂质水平中发挥着重要的作用[13]。麝香保心丸在脂质代谢中的调节作用也越来越受到人们的关注,在其所含的多种化学成分中,有两种胆汁酸,即熊去氧胆酸和鹅去氧胆酸,可抑制胆固醇的产生,治疗高甘油三酯血症[14]。与之前的结果相似[15-16],在给予麝香保心丸治疗8 周后,AS 小鼠的血脂代谢紊乱也有了明显的改善,血清TC、TG 和LDL-C 水平明显降低。肝脏中与胆固醇代谢密切相关的基因,如SREBP-2、LDLR 和ABCA1 mRNA 相对表达量显著上调。SREBP-2 负责调控包括LDLR在内的胆固醇合成相关基因的转录及表达,LDLR的表达上调使之与LDL 的结合增加,加快清除血液中的LDL,延缓AS 斑块的发展[17]。ABCA1 则介导胆固醇流出至无脂的载脂蛋白A1,从而促进细胞内脂质外流。因此,麝香保心丸可能通过加快胆固醇清除以及促进细胞内胆固醇逆转运来减少AS 斑块内泡沫细胞的堆积,降低血液循环中过量的脂蛋白对内皮细胞的氧化损伤而发挥抗AS 的作用。
研究表明,麝香保心丸可以清除活性氧,通过抑制内皮细胞线粒体依赖性凋亡而抑制AS 的发展[17]。自噬是一种保守的进化过程,其通过溶酶体途径降解并循环利用细胞内物质,从而积极响应细胞的应激状态以维持稳态[18]。自噬缺陷或自噬能力受损会使细胞清除能力下降,引起应激、氧化、炎症反应等,因此与AS 的发生、发展密切相关[19-20]。许多文献报道也证明自噬在AS 的发展中参与了脂质代谢和胆固醇稳态的调节[21-22]。本研究发现,AS 小鼠在麝香保心丸治疗后,主动脉组织中自噬相关基因P62 的表达量下调,而Beclin1 和LC3-Ⅱ的表达量上调,说明麝香保心丸还可能通过激活自噬来抑制AS 斑块的发展。
综上所述,麝香保心丸能抑制AS 斑块的发展,具有抗AS 的效果,其作用机制可能与抑制炎症反应,增加斑块稳定性,促进胆固醇清除和逆转运,以及激活自噬有关。