应用液相色谱-高分辨离子轨道阱质谱法检测人干血点中的睾酮酯
2021-03-03何根业
杨 声,闫 宽,何根业,温 超
(国家体育总局反兴奋剂中心 兴奋剂检测实验室,北京 100029)
睾酮是人体内分泌腺产生的内源性激素,在有机化学上属于甾体激素的一种,能够促进人体蛋白质的合成、提高肌肉力量和质量、促进骨髓造血、保持成年男性的雄性体征,对生殖系统也具有重要作用。化学、制药行业已发展出一大类蛋白合成雄性类固醇药物(Anabolic Androgen Steroid,AAS)。AAS也是运动员和体育健身爱好者容易滥用的物质,早在1976年就被国际奥林匹克委员会(International Olympic Committee,IOC)和世界反兴奋剂机构(World Anti-Doping Agency,WADA)禁用。在运动员被判兴奋剂阳性的药物中,AAS的阳性率高居首位,例如,WADA(2018)公布的统计数据表明,全球实验室共检测344 177例样品,其中AAS(S1类)的阳性例数占全部禁用物质的43%,位居第一。因此,针对该类药物的研究一直是反兴奋剂领域的重要内容之一。
检测AAS的主要方式是尿检,即通过收集运动员的尿样进行分析检测。从尿样中检测AAS等甾体类药物的主要技术是气相色谱质谱联用法(GC-MS),该方法至今已有近 50年的历史(Halket,1993;Horning,1968;Shackleton,1986;Shackleton et al.,1968)。2011年起,世界各国反兴奋剂实验室陆续开始对GC-MS技术进行升级换代,采用气相色谱-串联质谱(GC-MS/MS)技术检测甾体类药物(Eenoo et al.,2011),GC-MS/MS的灵敏度比GC-MS提高了一个数量级,可达到1 ng/mL的水平。
自2000年悉尼奥运会开始,采集血液样本作为兴奋剂的检测方法相继建立,例如,从血液中检测促红细胞生成素在兴奋剂检测中发挥着重要作用。2004年的雅典奥运会上,血液中检测生长激素的方法首次在奥运会上使用。伴随着科技的发展,越来越多的新技术应用到反兴奋剂领域。2011年,德国实验室率先采用干血点技术结合液质-高分辨联用法检测兴奋剂药物,该方法可以对多种睾酮的制剂药物进检测(Thomas et al.,2011,2012)。2019年3月,随着WADA干血点国际合作项目的启动,中国反兴奋剂中心与IOC、WADA、美国反兴奋剂机构(USADA)、德国科隆兴奋剂检测实验室、日本东京兴奋剂检测实验室等多个国际体育组织合作,成立了指导委员会和专家组,有力地推动了该技术在实际检测中的应用。经过近两年的研究,我国率先建立了干血点检测方法,并通过ISO-17025质量管理体系的认可,将在2022年北京冬奥会、冬残奥会上对各国运动员使用。
1 研究对象与方法
1.1 受试者招募与血液样品采集
招募6名健康成年男性志愿者为研究对象,年龄24~40岁,体质量63~72 kg。对受试者一次肌肉注射0.25 g的十一酸睾酮注射液。在肌肉注射之前,留取受试者空白血液和尿液样品,注射后4 h、8 h、12 h、24 h、36 h、48 h留取血液样本,之后每3天采集一次静脉血。人体试验的伦理申请已经国家体育总局反兴奋剂中心伦理委员会批准(编号:201906),且受试者均已签署知情同意书。
1.2 样品处理方法
干血点样品的制备:从静脉血样中吸取20 μL血液,滴到Whatman DMPK-C型滤纸卡上,每张滤纸卡滴4个血点,室温下干燥2 h后制成备用。
样品处理方法参考文献并进行了一定改良(Forsdahl et al.,2013,Tretzel et al.,2014)。具体步骤为:剪取一片20 μL干血点样品于玻璃试管中,加入50 μL D3-睾酮内标溶液(2 ng/mL)、1 mL碳酸钠/碳酸氢钠缓冲液(pH值9.5)和1 mL甲醇溶液,用震荡器混匀,然后加入4 mL叔丁基甲醚进行液液萃取,摇床震荡10 min后进行离心,转速4 000 rpm,离心4 min。取出上层有机相转移至新试管中,使用55℃氮气流吹干。用100 μL的甲氧胺溶液(10 mM)进行衍生化反应,80℃反应30 min,将样品离心后(4 000 rpm,4 min)转移至样品瓶中,取10 μL进样。
1.3 试剂
醋酸睾酮酯(CAS 1045-69-8)、丙酸睾酮酯(CAS 57-85-2)、苯甲酸睾酮酯(CAS 2088-71-3)、环戊丙酸睾酮酯(CAS 58-20-8)、苯丙酸睾酮酯(CAS 1255-49-8)、庚酸睾酮酯(CAS 315-37-7)、癸酸睾酮酯(CAS 5721-91-5)、十一酸睾酮酯(CAS 5949-44-0)均购自Sigma-aldrich公司。甲醇、叔丁基甲醚、甲酸均为HPLC级、氘代D3-睾酮购自Sigma-aldrich公司。甲酸铵为HPLC级试剂,购自Fluka公司。碳酸氢钠、碳酸钠、氢氧化钠购自国药试剂公司。纯水使用国产纯水机制备(北京爱思泰克科技公司),纯水电阻值大于18.0 MW。
1.4 仪器和参数设置
液相色谱-高分辨离子轨道阱质谱仪(Thermo Dionex Ultimate 3000 LC/Q Exactive Plus)和液相色谱柱[Thermo hypersil GOLDTM(100× 2.1 mm,1.9 μm)]均来自美国赛默飞公司。流动相A为水相,含10 mM甲酸铵(0.05%甲酸)水溶液。流动相B为有机相,为色谱级纯度的甲醇(0.1%甲酸)。流速为0.25 mL/min。
流动相梯度:0~2 min,65%溶剂B;2~9.5 min,65%~100% 溶剂 B;9.5~13 min,100% 溶剂 B;13~15 min,100%~65%溶剂B。柱温箱温度为35℃。离子化模式为正离子采集。干燥气流量为8 L/min(450℃)。离子传输管温度为300℃,分辨率为17 500。质量偏差5 ppm以下。扫描模式为Full scan(50~750 m/z)和PRM模式。
2 实验结果
衍生化前,几种睾酮酯的分子离子的精确质量不同,但去掉甾环上17位上的侧链后,都是一样的睾酮分子,8种睾酮制剂的分子结构见图1。睾酮的酯型药物经过离子源在正模式采集下,分子发生裂解,分子离子为[M+H]+,同时二级质谱可获得一些特征碎片离子,如97.064 8、109.064 8、253.194 7、289.215 5的碎片离子。这些碎片都是睾酮的甾环碎裂后形成的特征碎片。醋酸睾酮酯的特征碎片和质谱图见图2。
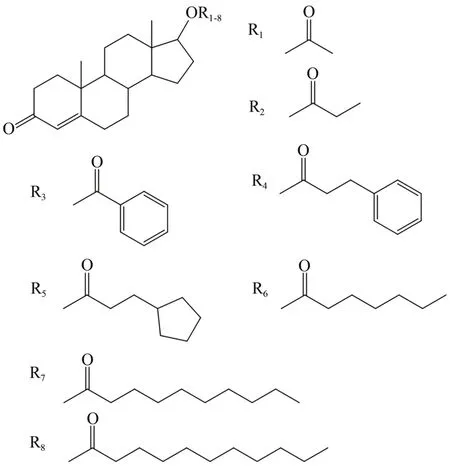
图1 8种睾酮酯的分子结构Figure 1.The Molecular Structure of Eight Testosterone Esters

图2 醋酸睾酮酯的质谱图Figure 2.The Mass Spectrum of Testosterone Acetate
衍生化后,分子在A环的3位氧原子被甲氧胺的氮原子取代,形成肟的结构,再经过ESI离子源的裂解,原来m/z为97.064 8的离子成为了m/z为126.091 2的离子,而m/z为109.064 8的则转变成m/z为138.091 0的特征离子碎片(图3)。
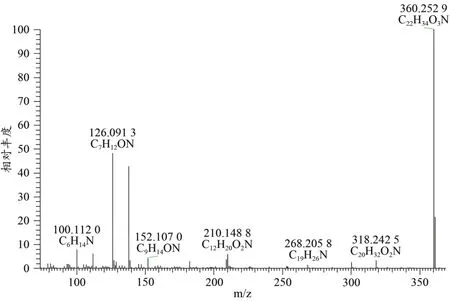
图3 衍生化后醋酸睾酮酯形成的E/Z型肟的质谱图Figure 3.The Mass Spectrum of E/Z Isomers of Testosterone Acetate Oxime
2.1 检测限
配制8种睾酮酯的对照品标准溶液1 mg/mL,逐级按10 ng/mL、5 ng/mL、2.5 ng/mL、1.0 ng/mL、0.5 ng/mL、0.25 ng/mL、0.125 ng/mL的浓度梯度进行稀释,然后添加到空白全血中,按样品提取方法进行处理,经液相色谱-高分辨离子轨道阱质谱仪分析后,根据特征离子的色谱图信噪比>3估计检测限。本研究中,十一酸睾酮酯的检测限为0.3 ng/mL,其他7种睾酮酯的检测限为0.1 ng/mL,与文献报道结果接近(Forsdahl et al.,2015)。
2.2 提取回收率
取睾酮酯的标准品溶液,分别稀释成10 ng/mL、5 ng/mL、1.0 ng/mL、0.5 ng/mL的浓度,一份添加50 μL内标溶液(D3-T)到10个空白全血中提取后备用;另一份添加50 μL内标溶液后,直接使用初始流动相复溶,分别进样后计算提取回收率。结果显示,各浓度的回收率在50%~86%。
2.3 日内和日间精密度
实验的日内精密度经测定小于15%。日间精密度连续测定3天,日间精密度为12%~25%。说明样品会随着时间的推移而部分降解,因此,在实验过程中样品制备完毕后应及时进行检测。
2.4 应用于人体试验后血液样品的检测情况
采用本实验建立的方法对受试者服用睾酮十一酸酯0.25 g后,取干血点样本20 μL(1个血点)进行检测,结果可以检测到睾酮十一酸酯的原型药物,并且在停用药物后7~14天仍能被检测到。实验结果可以作为使用了外源性睾酮类兴奋剂的直接证据。
3 讨论
3.1 干血点技术的特点
干血点是一种血样的保存方式的统称,是将外周血液标本(新生儿的脚跟、成人指尖或者耳垂等部位采集到的少量血液)保存到滤纸片上,干燥后用于临床疾病筛查、药理研究、药物代谢研究的方法统称。该技术起源于20世纪60年代,由美国微生物学家Robert Guthrie于1963年为筛查新生儿遗传病——苯丙酮尿症所创立(Scriver,1998)。它的特点是取样创伤小,采取血液样本,只需干燥,对样品的保存温度没有特殊要求,但低温(-20℃)干燥环境将延长样品的保存期限。对样品采集人员的性别也没有要求,而且对运动员的隐私也进行了最大程度上的保护,因此是运动员容易接受的一种采样方式。
3.2 干血点技术的难点
睾酮根据来源可分为内源性睾酮和外源性睾酮,内源性睾酮即人体细胞分泌的睾酮,外源性睾酮即人工制药合成的睾酮制剂。当外源性睾酮进入人体后,如何与自身的睾酮进行区分充满难度。首先,如何发现体内的睾酮增多就是一个难题。睾酮的分泌与种族、年龄、性别、遗传等因素有关,并且存在个体差异,有学者建立了部分人群血清睾酮正常值的参考范围,但反兴奋剂检测多采用尿检,测定的是尿样中的睾酮,血清中的值只能作为参考。常规的检测方法是通过测定一系列内源性睾酮代谢物的浓度和比值,如5α-雄烷二醇、5β-雄烷二醇、雄酮、本胆烷醇酮等,与已经建立的人群参考值进行比较,找出浓度指标、代谢物之间浓度比值异常的可疑样本后,再借助同位素比质谱技术进行确证,才能准确区分内源性和外源性睾酮。
同位素比质谱技术可以测定睾酮分子中的碳原子的同位素比值(13C/12C),从分子的同位素构成上显示出差异(Becchi et al.,1994),它的原理是用于人工合成睾酮的化学原料的碳元素与人体通过食物摄入的含碳化合物存在差异。但该方法也存在一些不足,例如,检测灵敏度不如干血点法,其次,如果采用植物甾醇提取的原料来合成睾酮,就很难发现碳元素分布上的差异。
血浆中存在一种酯酶,可以将进入体内的睾酮制剂水解,转变成跟人体分泌的睾酮一样的形式,因此难以被检测到。干血点技术是一种直接检测睾酮酯的方法,其优势在于巧妙地通过使血液脱水后干燥,降低了血浆中的酯酶活性,甚至使酯酶失去活性,使得微量的样品中仍然有完整的睾酮制剂分子,一旦被检测到,可以肯定其使用了外源性睾酮制剂。
3.3 干血点技术可检测的药物种类
干血点是一种血样的保存方式,因此不仅睾酮类兴奋剂可以通过该方法进行检测,其他种类的兴奋剂,如刺激剂甲基麻黄碱(Kojima et al.,2016)、麻醉剂(Verplaetse et al.,2015)、镇痛剂曲马多(Luginbühl et al.,2020)、糖皮质激素、小肽类(Lange et al.,2020)、促红细胞生成素(EPO)和生长激素(GH)等可用干血点技术进行检测(荆京等2021;Yuan et al.,2021)。然而,由于现行的 WADA 规定中,仅对尿样中特定刺激剂的结果判定有阈值方面的要求,对于干血点的浓度阈值如何判定还在讨论中。未来随着研究的不断深入与完善,系统的干血点技术体系将逐渐建立。
3.4 睾酮酯衍生化后形成的E/Z型肟的结构推测
睾酮酯分子中含有羰基与甲氧胺在甲醇溶液中可以发生反应,生成的产物在有机化学上叫做肟。由于构型上存在E/Z异构体,根据WADA的要求(WADA,2021),需要做进一步的鉴定。通过一系列的实验观察,发现采用不同温度、日光照射、甚至室温条件下放置,均能形成E/Z型的睾酮酯的肟产物,区别只是产率不同。本研究中的色谱分离条件,比文献中的分离度更优。例如,有研究虽然提到反应形成了E/Z型异构体,但没有进一步对异构体进行鉴定;而且文献中采用的液相分离条件也无法实现基线分离(Gray et al.,2011)。因此,建议采用羟胺试剂而非甲氧胺进行衍生化,使色谱分离时的E/Z两个异构体在色谱图上呈现一个合并的“单峰”形式(Forsdahl et al.,2013)。也有文献中显示出不完全的分离效果,色谱峰呈现肩峰特征(Tretzel et al.,2014)。有研究报道,实现了睾酮酯的基线分离,但内标物质氘代睾酮的肟却仍然是一个单峰(Gray et al.,2011),说明还有改进的余地。而本研究可以做到氘代睾酮肟的E/Z异构体的分离,虽然它的17位上只是一个羟基,没有长的侧链,色谱图上仍可显示出双峰特征。
根据有机化学中立体化学与光化学反应的有关理论(邢其毅等,1983),在反应生成的机理上,热力学上容易生成的结构较多为E型,而Z型由于空间构型上不利于形成而占比较少。因此做出以下推断,Hypersil GOLDTM色谱柱采用水-甲醇为流动相时,色谱图上保留时间早、丰度较小的色谱峰为Z型睾酮酯的肟产物,保留时间晚、丰度较大的色谱峰为E型睾酮酯的肟产物(图4、图5)。由于本研究是从色谱-质谱技术上进行结构推断的异构体,其可靠性还有待其他波谱学技术的验证。
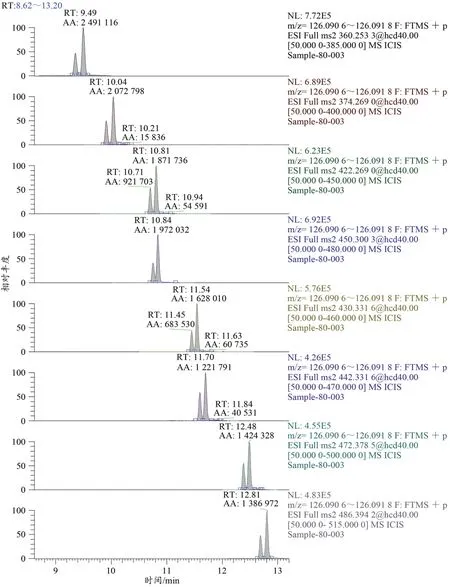
图4 8种睾酮酯的提取离子色谱图Figure 4.The Extracted Ion Chromatogram of Eight Testosterone Esters

图5 衍生化后睾酮酯肟的E/Z构型Figure 5.E/Z Configuration of Testosterone Ester Oxime
4 结论
本实验方法不仅适用于血液样品的检测,也适用于保存在滤纸片上的干血点样品的检测。该检测方法灵敏、快速。使用了十一酸睾酮的受试者的血液样本,在停用后7~14天仍可检出十一酸睾酮酯的原型,因此,为控制睾酮类药物制剂的滥用提供了可靠的检测方法。本研究采用液相色谱技术实现了8种睾酮酯的肟化产物的同分异构体的基线分离,并首次对E和Z型异构体进行了结构推测,可以满足WADA的相关要求。干血点技术作为常规尿检、血检的重要补充手段,使得对外源性睾酮酯的检测又多了一项新技术。
