大豆种皮多糖对模拟肠液流变特性和肠道菌群的影响
2021-01-15黄靖航杨立娜赵亚凡雒明朔王胜男周大宇
黄靖航,杨立娜*,赵亚凡,林 芊,韩 琳,雒明朔,王胜男,宋 虹,周大宇,刘 贺
(1 渤海大学食品科学与工程学院 辽宁锦州121013 2 辽宁省粮谷类食品生物高效转化工程研究中心 辽宁锦州121013)
大豆种皮作为大豆深加工过程的主要副产物,约占大豆总质量的8%,其成分的86%均为碳水化合物的复合物[1]。微波辅助萃取法具有穿透性强,选择性高,加热均匀、快速和提取时间短等优点[2]。大豆种皮多糖不仅具有增稠性、凝胶性和乳化性等功能特性,还具有较高的营养价值,在食品生产加工中具有重要的生物学作用[3-4]。许多研究表明,酸法提取的植物多糖具有较高的提取率和生理活性[5-6]。采用微波辅助酸法萃取可显著提高大豆种皮多糖得率,充分发挥其功能和生物学特性,提高大豆产业的附加值。
在人体肠道中存在庞大的微生物群(主要为细菌),数量约1013~1014,其种类繁多,有500~1 000 个种类[7]。研究表明,多糖可以调节肠道菌群,促进益生菌的生长,维护微生态平衡[8]。徐永杰等[9]发现牛蒡多糖可以有效促进小鼠肠道中乳酸菌和双歧杆菌等有益菌的增殖,且随着剂量的增加,促增殖效果也更加明显。Chen 等[10]研究表明茯砖茶多糖可被肠道菌群分解利用,可显著调节普雷沃菌和拟杆菌2 种菌群的组成和丰度。Gao 等[11]研究发现四君子汤中的均一多糖S-3-1 可以调节肠道中乳酸菌、片球菌、链球菌、类杆菌、肠球菌和梭状芽孢杆菌等菌属的丰度,并调节短链脂肪酸(SCFA)含量,影响机体免疫活性。由此可见,肠道菌群在维持人体健康和预防疾病发生的过程中扮演着重要的角色。肠道体外模拟系统是体外模拟人体肠道生理机能,研究营养物质、药物和非营养化合物的变化、相互作用以及生物可及性的有用工具[12]。本文采用体外模拟的方法探究不同萃取剂提取的大豆种皮多糖对模拟肠液流变学特性的影响,进而明晰其对肠道菌群的调节作用,为大豆种皮多糖的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆种皮,锦州大豆皮经销公司;草酸(分析纯级),天津市致远化学试剂有限公司;柠檬酸(分析纯级),天津市风船化学试剂科技有限公司;菊粉(Inulin),北京新营养科技有限公司;猪肠胃黏蛋白,上海源叶生物有限公司;BCA 试剂盒,北京索莱宝科技有限公司;粪便DNA 快速提取试剂盒,德国凯杰公司;其它化学试剂均为国产分析纯级。
1.2 仪器与设备
UV-2550 紫外-可见分光光度计,日本岛津公司;NanoDrop One 超微量分光光度计,美国赛默飞公司;DHR-1 流变仪,美国TA 公司;厌氧培养箱,上海龙跃仪器设备有限公司。
1.3 试验方法
1.3.1 水溶性大豆种皮多糖的制备 水溶性大豆种皮多糖的提取剂为草酸和柠檬酸,微波辅助萃取参数为480 W,35 min。提取流程如下:豆皮粉碎→乙醇脱色→过滤干燥→加入萃取剂→微波辅助提取→离心→真空浓缩→乙醇沉淀→干燥→大豆种皮多糖[13]。获得2 种大豆种皮多糖分别为微波辅助草酸提取大豆种皮多糖 (Microwave-assist ed oxalic acid extraction of soybean hull polysaccharide,MOSP)和微波辅助柠檬酸提取大豆种皮多糖(Microwave-assisted citric acid extraction of soybean hull polysaccharide,MCSP)。
1.3.2 大豆种皮多糖组成成分测定 水分含量的测定参照GB/T 5009.3-2010 《食品安全国家标准食品中水分的测定》直接干燥法[14];灰分含量测定参照GB/T 5009.4-2016《食品安全国家标准 食品中灰分的测定》高温灼烧法[15];粗脂肪含量测定参照GB/T 5009.6-2016《食品安全国家标准 食品中脂肪的测定》酸水解法[16];多糖含量测定参照SN/T 4260-2015 《出口植物源食品中粗多糖的测定》苯酚硫酸法[17];蛋白质含量参照BCA 试剂盒操作方法进行测定。
1.3.3 大豆种皮多糖体外模拟消化试验
1.3.3.1 粪便菌群(Fecal Microbiota,FM)的提取选取健康成年人的粪便 (不包括最近使用抗生素治疗,以及有频繁的胃肠疾病和代谢疾病的成年人)。取20 mL PBS (NaCl 8 g/L,KCl 0.2 g/L,Na2HPO41.44 g/L,KH2PO40.24 g/L)加入50 mL离心管中,加2~5 g 新鲜粪便样品,涡旋振荡混匀后称重,差重法计算需要补加的PBS,制成质量分数为10%的粪便浆液[18]。
1.3.3.2 体外模拟肠道消化 参考文献[19]的模拟肠液配方并改进,培养基组成:酵母提取物(2.25 g/L),蛋白胨(0.75 g/L),NaCl(12.5 g/L),猪胆盐(6.0 g/L),胰酶(0.9 g/L),猪胃黏蛋白(3 g/L)和L-半胱氨酸(0.37 g/L),调节pH 值至6.8。将1%MOSP 和MCSP 分别加入到培养基中,以添加1%Inulin 的培养基作为阳性对照,以不添加多糖和Inulin 的培养基作为阴性对照,将体积分数1%的肠道菌群接种到培养基中,置于37 ℃厌氧培养箱中培养。
1.3.4 肠道菌群生长变化测定 本试验分为4组:FM 对照组,MOSP+FM 发酵组,MCSP+FM 发酵组和Inulin+FM 对照组。在培养过程中取0,12,24,36,48 h 的模拟肠液,于波长600 nm 处测定OD 值及相应pH 值,绘制曲线。
1.3.5 发酵液流变特性测定 对培养0,24,48 h的模拟肠液进行黏性测定,参考文献[20]的方法并改进。采用40 mm 平行板夹具,于4 ℃下线性剪切,剪切速率为0.1~100 s-1,测定时间为300 s,连续测定30 个数据点,检测样品的表观黏度随剪切速率的变化情况。
1.3.6 细菌16S rDNA V3-V4 区高通量测序 根据粪便DNA 快速提取试剂盒操作步骤提取FM,MOSP+FM,MCSP+FM,Inulin+FM 中的模拟肠液总DNA 并定量,通过0.8%琼脂糖凝胶电泳检测DNA 提取的完整性。以细菌总DNA 为模板,用V3-V4 区通用引物341F(5’-CCTACGGGNGGCWGCAG-3’):805R(5’-GACTACHVGGGTATCTAATCC-3’)扩增。PCR 扩增条件:预变性94 ℃,3 min;94 ℃,30 s,55 ℃,20 s,72 ℃,30 s 共25 个循环,退火温度 72 ℃,5 min。利用Qubit 3.0 DNA 检测试剂盒对回收的DNA 精确定量,以便按照体积比1∶1 混合后在MiSeq 平台进行测序。PCR 扩增、测序文库制备及测序工作由上海生工生物工程股份有限公司完成。
1.3.7 数据统计分析 每个试验重复3 次,采用Origin 9.1 软件作图,SPSS 19.0 软件进行方差分析,以P<0.05 为显著性检验标准。
2 结果与分析
2.1 不同萃取剂提取的大豆种皮多糖化学组成
通过微波辅助草酸和柠檬酸萃取大豆种皮多糖发现,MOSP 得率为10.2%,MCSP 得率为5.9%。如表1所示,MOSP 的纯度、水分和脂肪含量显著高于MCSP(P<0.05),而MCSP 的蛋白质和灰分含量显著高于MOSP(P<0.05)。微波辅助酸法萃取大豆种皮多糖的得率均高于孙元琳等[21]报道的大豆皮多糖热水提取率 (2.69%)和草酸铵提取率(2.96%)。本试验结果与部分文献报道的微波辅助酸提法可以提高多糖的得率保持一致[2],主要由于微波提高了大豆皮细胞壁的破碎程度,酸处理解除了细胞壁聚合物分子间的物理化学作用,使得不溶性纤维素、木质素与多糖之间的化学键断裂,并且在低pH 值条件下多糖的溶解度降低,因此微波辅助酸提法更利于多糖分子的溶出[22-24]。然而,不同萃取剂的螯合性、酸碱性、沉淀性和还原性等化学性质不同,导致粗多糖的化学组分之间存在些许差异。

表1 MOSP 和MCSP 的化学成分Table 1 The chemical composition of MOSP and MCSP
2.2 不同多糖干预后肠道菌群的增殖情况
通过0~48 h 内发酵液的OD 值和pH 值变化,表征肠道菌群在不同培养条件下的增殖情况。OD 值的大小反映发酵液中菌群数量的多少,变化速率的大小反映菌群增殖速度的快慢[25]。如图1所示,0~12 h,MOSP 组OD 值快速上升,变化速率高于其它组;12~24 h,MOSP 组OD 值上升缓慢,变化速率低于其它组。随着发酵时间的延长,MOSP 和MCSP 组间差异逐渐变小最终趋于一致。与Inulin 组相比,MOSP 和MCSP 干预后肠道菌群的数量和增殖速度较高,表现出较好的增殖效果。MOSP 和MCSP 都能促进肠道菌群的增殖,但是MOSP 促进肠道菌群增殖的效果优于MCSP。由于不同的提取方法获得的多糖之间化学组分不同,所以在肠道菌群增殖效果方面也存在一定的差异。文献报道称枸杞多糖、人参多糖和羊栖菜多糖等都可以被肠道菌群降解并促进肠道菌群生长[26-28],与本文试验结果一致。人体肠道菌群可利用的主要营养来自于膳食中的碳水化合物,因此肠道菌群可以降解复杂的植物多糖,从中获取能量和营养供自身生长繁殖[29]。

图1 肠道菌群的生长曲线和pH 值变化曲线Fig.1 Intestinal flora growth curve and pH change curve
pH 值下降是发酵过程中的一个显著变化,主要是由于接种的微生物作用于多糖等碳水化合物,使其分解为乳酸、醋酸或其它有机酸,从而导致pH 值降低。pH 值的降低可以有效抑制杂菌生长。由图1可知,0~12 h,MOSP 发酵液的酸化程度和酸化速率均高于其它组;12~24 h,MOSP 发酵液的酸化程度缓慢下降,酸化速率低于其它组;24~48 h,各组发酵液的酸化程度趋于稳定。pH 值的变化趋势与OD 值的变化趋势相互对应,说明肠道菌群对多糖的利用程度越高,菌群数量越多,发酵液的酸化程度越高。张其圣等[30]和杨靖鹏等[31]发现乳酸菌的生长繁殖过程呈现相似的趋势,与本文的研究结果保持一致。
2.3 不同多糖发酵液的流变特性
肠液流变性的变化通常会影响肠道菌群的定殖、分布与生长,进而影响营养物质和药物的吸收效果[32]。在0~100 s-1的剪切速率下,测定了肠道菌群发酵液的表观黏度。由图1可知,在0~20 s-1的剪切速率下,0,24,48 h 各组的表观黏度均随剪切速率的增加而迅速降低,呈现剪切稀化的流动特征,因为在外力的剪切下,发酵液的结构被破坏,所以表观黏度呈现不断下降的趋势[33]。剪切速率大于20 s-1后,表观黏度下降速度基本保持一致,表现为恒定的理想牛顿流体行为[34]。随着剪切应力停止,发酵液的黏度不再变化,这种剪切稀化和凝固特性的规律更类似于人体肠道黏液实际的流变学特性[32]。张杰等[35]和Marie 等[32]的研究也发现了类似的结果。通过比较发现,0 h 时MCSP 发酵液的表观黏度较高,这是由于MCSP 的蛋白质含量较高,导致其多糖溶液的黏度较高;24 h 时MOSP 发酵液的表观黏度明显上升,高于MCSP,因为0~24 h 内肠道菌群快速利用MOSP,产生的代谢产物与MCSP 存在差异,所以改变了发酵液的表观黏度;48 h 时MOSP 和MCSP 发酵液的表观黏度趋于一致,主要因为肠道菌群发酵接近终点,发酵终产物差异较小。
2.4 肠道菌群多样性分析
经Illumina-miseq 平台16S rDNA 测序后,在97%的相似水平下,对序列进行操作分类单元(OTU)划分,OTU 数目代表物种的丰度。OTU 聚类分析结果如表2和图3所示,发酵24 h 时MOSP特有OTU 多于MCSP 和Inulin,但是3 组均低于0 h FM 组;发酵48 h 时MOSP 与MCSP 特有OTU 几乎相同,均高于Inulin 低于0 h FM 组,表明MOSP 相较于MCSP 和Inulin 可以显著提高厌氧肠道菌的丰度,但低于粪便中肠道菌的丰度。α 多样性是对单个样品中物种多样性的分析,其中Chao1 和Ace 指数反映了群落中物种的数量,Shannon 和Simpson 指数用于衡量群落多样性,Chao1,Ace,Shannon 指数值越大,Simpson 指数值越小,说明样品的物种多样性越高[36]。根据表2所示,0 h FM 组物种多样性最高,24 h 时MOSP 组物种多样性高于MCSP 和Inulin 组,根据发酵液流变特性的差异,可能因为MOSP 干预体系黏度较高,降低了有害因子对微生物的抑制速率。48 h时3 组没有明显规律,差异不大。有研究报道称体外模拟发酵会降低肠道菌群的多样性,不同的碳水化合物对肠道菌群有筛选作用[37],本试验也出现了相同的结果。如果增加不同种类碳水化合物的组合有可能大幅度提高体外模拟条件下的肠道菌群多样性。如图3所示,发酵24 h 4 组共有OTU 是15 个,而发酵48 h 4 组共有OTU 是19个。随着发酵时间的延长,处理组肠道菌群丰度趋向于正常组肠道菌群丰度。
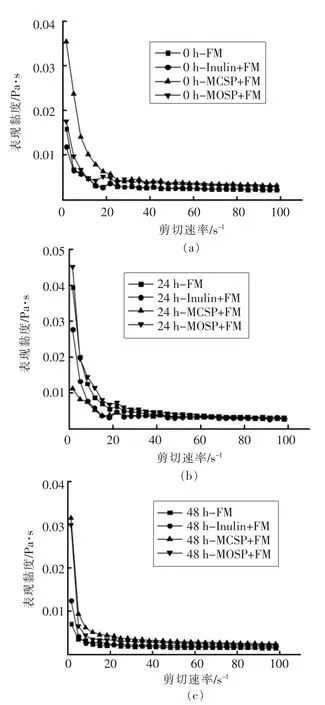
图2 剪切速率对发酵液表观黏度的影响Fig.2 Effects of shear rate on the apparent viscosities of fermentation fluid
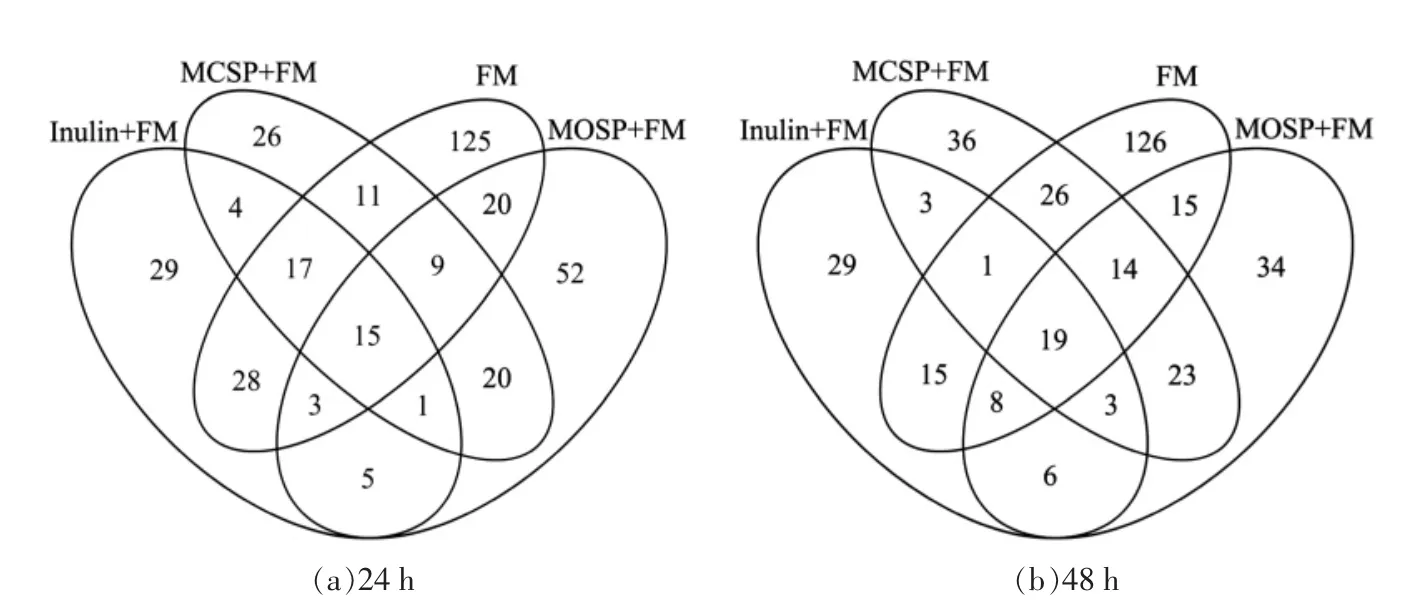
图3 肠道菌群OTU 分布韦恩图Fig.3 OTU distribution Venn diagram of intestinal flora

表2 肠道菌群的OTU 及α 多样性指数Table 2 OTU and alpha diversity index of intestinal flora
2.5 肠道菌群结构分析
由图4a,4b 可知,4 组肠道菌群中拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)是3 大优势菌,这与姚虹等[38]的研究结果一致。FM 组中拟杆菌门含量最为丰富,其次是厚壁菌门和变形菌门。Inulin 组由厚壁菌门和变形菌门组成,不同的发酵时间没有明显变化。24 h 时,MOSP 和MCSP 组以变形菌门和拟杆菌门为主,并且MOSP 的拟杆菌门含量高于MCSP;48 h 时,MOSP 和MCSP 组出现了少量的厚壁菌门,拟杆菌门含量明显增多,而且MOSP 的拟杆菌门含量依旧高于MCSP。有报道称拟杆菌主要通过PULs 的susCH/susDH 降解系统利用多糖,提高复杂聚糖的营养利用率并为维持微生态平衡贡献力量;厚壁菌门则通过gpPULs 聚糖降解系统参与聚糖降解[29,39]。本研究结果证实MOSP 和MCSP 通过增加拟杆菌门和厚壁菌门的含量来提高多糖的利用率,而且MOSP 比MCSP 对菌群的促增殖的效果更明显,可能与其诱导肠道黏液流变性差异有关。
通过UniFrac 的3D-PCoA 对不同多糖发酵液中肠道菌群落结构差异进行分析,系统进化距离代表各组物种群落结构差异,并在三维空间上表征差异,图中距离越近的点表示样品间菌群结构越相似[40]。由图4c,4d 可知,发酵24 h 时,未加权主坐标分析显示第1 主成分、第2 主成分和第3 主成分的贡献率分别为53%,30%,18%;发酵48 h 时,未加权主坐标分析显示第1 主成分、第2主成分和第3 主成分的贡献率分别为45%,34%,21%。结果表明,不同多糖发酵液中细菌群落结构差异明显,彼此间很好的分隔开来。路上云等[41]的结果也与本文相似。发酵液中细菌的构成与粪便样品相比较为简单,菌群的种类和数量也不尽相同,表明在培养过程中优势菌群大量存活下来。
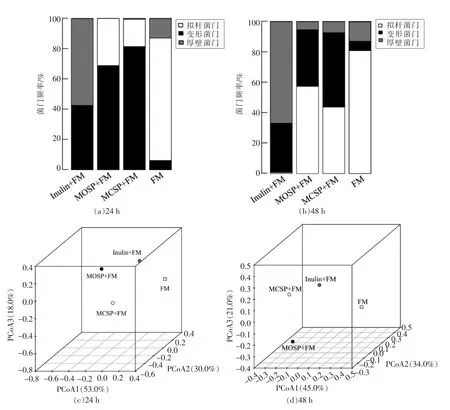
图4 肠道菌群门水平结构分类和3D-PCoA 分析Fig.4 Classification and 3D-PCoA analysis of intestinal flora structure on the phylum level
3 结论
微波辅助草酸或柠檬酸萃取的2 种大豆种皮多糖均能在一定程度上改变体外肠道模拟体系的流变学特性,并改善肠道菌群的多样性与结构特征,而微波辅助草酸萃取法获得的多糖在调整微生态平衡和发挥益生元活性方面更具优势。大豆种皮多糖酵解和调控肠道菌群平衡的分子机制,尚需要进一步研究与探索。
