果胶结构特征对果胶-β-酪蛋白复合体系性质的影响
2021-01-15梁瑞红董浩澜王学栋王日思贺小红刘成梅
梁瑞红,董浩澜,王学栋,王日思,贺小红,陈 军*,刘成梅
(1 南昌大学食品科学与技术国家重点实验室 南昌330047 2 江西旅游商贸职业学院经济管理学院 南昌330100)
蛋白质和多糖是食品中的重要组成成分,蛋白质的溶解性、乳化性、起泡性等重要功能常因多糖的参与而得到改善[1]。蛋白质-多糖复合物具有改善食品乳液稳定性[2]和凝胶稳定性[3],包埋活性成分[4],提高蛋白质的热稳定性和改善混合体系的黏度[5]等作用。在食品体系中多糖与蛋白质自发的相互作用是影响食品结构和理化性质的主要因素,目前蛋白质与多糖间的相互作用类型主要是静电作用、疏水作用、氢键作用、空间位阻效应等[6]。有文献[7]报道,多糖分子特性(分子质量、分子柔性、电荷密度)会影响蛋白质与多糖的相互作用。
果胶是存在于植物细胞的初生壁和中间层由D-半乳糖醛酸残基通过α-1,4 糖苷键连接而成的一种阴离子多糖[8],常被用作增稠剂、稳定剂、胶凝剂、乳化剂、药物递送载体[9-10]。果胶分子链上半乳糖醛酸C-6 位的羧基可被甲酯化,根据甲酯化的程度可分为高酯果胶和低酯果胶,而低酯果胶半乳糖醛酸C-6 位的羧基还可被乙酰化。果胶甲酯化度、酰胺化度和分子质量等结构特征的不同使其功能性质如溶解性、凝胶性存在差异[11]。
目前,关于果胶与蛋白的研究主要为果胶的单一结构特征(主要为酯化度)、果胶与蛋白比例、pH 值等因素对果胶与蛋白相互作用及其复合体系理化性质的影响。Schmidt 等[12]制备了不同酯化度的果胶与乳清蛋白复合物,表明复合物的乳化能力提高,果胶的酯化度不影响复合物的性能,但使用低甲基化柑橘果胶比高酯果胶得到的复合物产量更高。Li 等[13]研究pH 值与蛋白多糖比例对牛血清蛋白与果胶复合物形成以及复合体系乳化能力与乳液稳定性的影响,结果发现当pH 值和蛋白多糖比例达到可形成可溶性复合物状态时,体系的乳化能力与乳液稳定性明显提升。Sadahira等[14]用蛋清蛋白与果胶制备静电复合物并研究其起泡性,结果表明在pH 3.0,蛋白与果胶质量比为55∶1 时,蛋白-果胶复合物带净正电荷,制备的泡沫能有效抵抗析水。Perez 等[15]研究了pH 7.0 条件下乳清蛋白分别与高酯和低酯果胶在气-水界面的吸附过程,结果发现不同酯化度的果胶与蛋白具有不同的吸附机制。果胶的不同结构特征(分子质量、酰胺化度、酯化度、半乳糖醛酸含量等)如何共同影响果胶与蛋白相互作用的研究鲜有报道,且果胶的哪个结构特征起主要影响作用,目前尚不清楚。
本文选用β-酪蛋白(β-CN)为模型蛋白,它普遍存在于哺乳动物(牛、山羊、马、兔等)和人的乳汁中,是由乳腺腺泡上皮细胞合成的磷酸化蛋白质[16],具有降低过敏性,通过释放生物活性肽达到抗高血压的功能,促进某些营养成分(如钙、磷、必需氨基酸等)吸收等作用[17]。将6 种结构特征(半乳糖醛酸含量、酯化度、酰胺化度、分子质量)的果胶与β-酪蛋白复合,探讨果胶-β-酪蛋白复合体系的理化性质,并采用多元线性回归分析果胶各个结构特征性质对复合体系性质影响的贡献程度。
1 材料与方法
1.1 材料与试剂
β-酪蛋白 (分析纯),Sigma-Aldrich 公司;柑橘果胶 (LM 104 AS,LM 102 AS,LM 101 AS,LM 13 CG,121 SHOW SET,YM 150H),CP kelco 公司;磷酸(分析纯),西陇科学有限公司;氢氧化钠(分析纯),西陇科学有限公司;PBS 标品0.01 mol/L pH 7.2~7.4,北京索莱宝有限公司;考马斯亮蓝法试剂盒,碧云天生物试剂公司;玉米油(一级),益海嘉里食品有限公司;十二烷基硫酸钠(分析纯),西陇科学有限公司。
1.2 仪器与设备
F-5000 荧光分光光度计,日本Hitachi 公司;MOS-450 圆二色光谱仪,法国Bio-Logic SAS 公司;数显恒温水浴锅,江苏省荣华有限公司;DELTA320 pH 计,梅特勒-托利多仪器(上海)有限公司;QL-866 漩涡混合器,上海精密仪器仪表有限公司;Nano ZS 粒度电位仪,英国马尔文仪器有限公司;电子分析天平,梅特勒-托利多仪器(上海)有限公司;RT-10 多联磁力搅拌器,艾卡(广州)仪器设备有限公司;T18 数显型分散机,艾卡(广州)仪器设备有限公司;酶标仪,美国博腾有限公司。
1.3 方法
1.3.1 果胶与β-酪蛋白复合体系的制备 分别称取6 种果胶与β-酪蛋白于100 mL PBS 缓冲液(pH=7.4,10 mmol/L)中,在磁力搅拌器上搅拌2 h至蛋白、果胶充分溶解,配置质量浓度为0.6 mg/mL 的果胶母液和β-酪蛋白母液,并在4 ℃下存放过夜使其充分水化。
将β-酪蛋白母液、果胶母液和按1∶1 质量比例复合的β-酪蛋白-果胶混合溶液。用0.5 mol/L和0.1 mol/L 的磷酸酸化至pH=7.0,6.0,5.0,4.0,3.0 和2.0,并充分搅拌混匀[18]。
1.3.2 果胶与β-酪蛋白复合体系粒径的测定取1.5 mL 样品溶液于5 mL 比色皿中,采用Malvern Nano ZS 粒度电位仪测定上述溶液的粒径,测定温度25 ℃,温度平衡时间120 s,每个样品测量3 次,结果取平均值。
1.3.3 果胶与β-酪蛋白复合体系ζ 电位的测定取1 mL 样品溶液于电位池中,采用Malvern Nano ZS 粒度电位仪测定上述溶液的ζ 电位,测定温度25 ℃,温度平衡时间120 s,每个样品测量3 次,结果取平均值。
1.3.4 果胶与β-酪蛋白复合体系荧光光谱的测定 取pH=7.0 的按1∶1 质量比例复合的β-酪蛋白与6 种果胶混合溶液用于荧光光谱分析,每种样品溶液取3 mL 于5 mL 比色皿中,荧光分光光度计的激发波长为290 nm,扫描发射光谱的范围为300~450 nm;激发与发射的狭缝宽度均为2.5 nm[16],每个样品测量3 次。
1.3.5 果胶与β-酪蛋白复合体系圆二色谱的测定 取pH=7.0 的按1∶1 质量比例复合的β-酪蛋白与6 种果胶混合溶液用于圆二色谱分析,取360 μL 样品于比色皿中,使用MOS-450 圆二色光谱仪进行远紫外圆二色谱分析。采用光路长为1 mm 的圆口石英比色皿,扫描范围为190~250 nm,扫描步进分辨率为1 nm;以100 nm/min 扫描速度,普带宽度2.0 nm。每份样品重复扫描3 次,采用DichroWeb 在线数据库预测二级结构含量[19]。
1.3.6 溶解性测定 根据Calligaris 等[16]测定蛋白质溶解性的方法,分别取2 mL 样品溶液,在15 000 r/min 下离心15 min,取上清液。用考马斯亮蓝G-250 法测定上清液中β-酪蛋白含量,并以牛血清蛋白做标准蛋白,测定不同浓度蛋白的标准曲线,线性回归计算出上清液中蛋白的含量,同时测定不添加果胶的β-酪蛋白溶液的溶解性,每组样品测3 次,结果取平均值,所有试验操作均在室温下进行。
1.3.7 乳化性测定 根据涂越等[20]测定乳化性的方法,分别取9 mL 样品溶液,边搅拌边缓慢加入3 mL 一级玉米油,于10 000 r/min 高速均质1 min制成乳状液,从底部吸取乳状液50 μL,立即与5 mL 质量分数为0.1%的十二烷基硫酸钠混合,然后用分光光度计于500 nm 处测吸光度,试验重复3 次,结果取平均值,乳化性用吸光度大小表示。
1.3.8 起泡性测定 根据刘成梅等[21]测定起泡性的方法,分别取10 mL 样品溶液,在室温下于分散机分散1 min,转速为5 000 r/min,然后快速移至50 mL 的量筒内,记录泡沫的体积,试验重复3次。起泡性为:
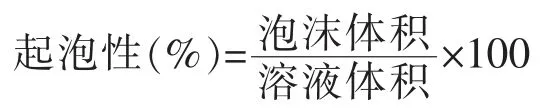
1.3.9 多元线性回归及数据分析 试验数据使用SPSS 19.0 统计软件分析,ANOVA 用于单因素方差分析,并比较不同组平均值的差异性(P≤0.05);以果胶的半乳糖醛酸含量(GA)、酯化度(DM)、酰胺化度(DA)和分子质量(Mw)作为自变量,果胶与β-酪蛋白复合体系的粒径电位、溶解性、乳化性和起泡性(在pH=7 时)作为因变量,代入SPSS 19.0,选择相应的回归参数,建立它们之间的数学函数关系,评价各自变量对因变量的贡献大小;采用Origin 2017 软件作图。
2 结果与分析
2.1 果胶的结构参数
根据本团队前期成果选用的6 种果胶[22],其结构参数如表1所示。L101、L102、L104 为低酯酰胺化果胶,L13 为低酯果胶,H121 和H150 为高酯果胶。分子质量在527~1 273 ku 之间,具有较好的代表性。
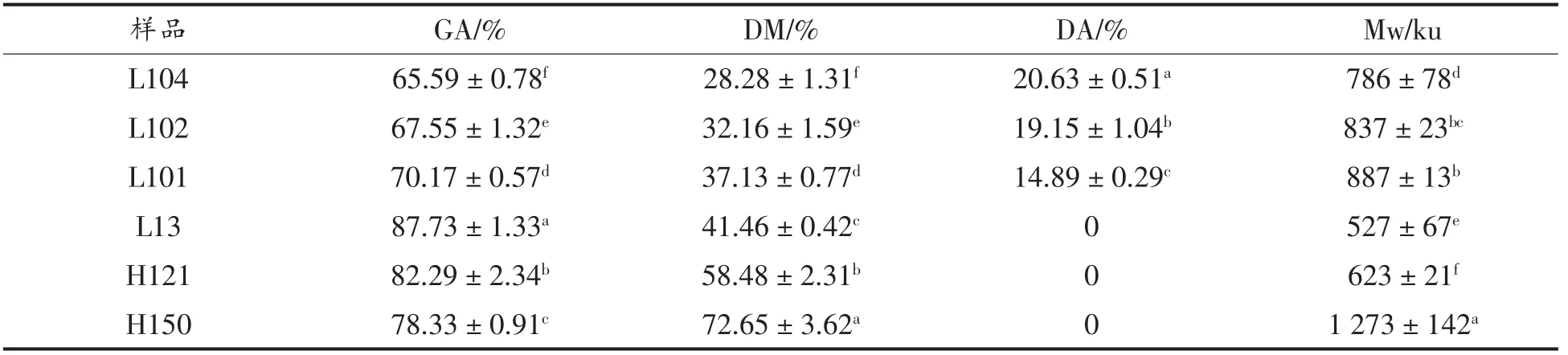
表1 果胶的结构参数Table 1 Structural parameters of pectin
2.2 不同结构特征的果胶与β-酪蛋白复合体系的粒径
如表2所示,所有体系在酸化过程中粒径均先减小后增大,并都在pH=5 时达到最小值。单一的β-酪蛋白溶液在pH=4.0,3.0,2.0 时出现少许沉淀,无法测量其粒径,可能是因为静电排斥力不足以维持蛋白的稳定,蛋白分子间的疏水作用也会引起聚集而沉淀。相比于β-酪蛋白,β-酪蛋白/果胶复合体系在pH 为3.0 和4.0 条件下更能呈现较均一的颗粒,这说明果胶的添加改善了β-酪蛋白在酸性体系下的稳定性。在pH=2 时,只有添加H150 和H121 果胶的复合体系呈现较好的稳定性,表明在强酸性条件下高酯果胶比低酯果胶对β-酪蛋白具有更强的稳定作用。这与Lam 等[23]发现在pH 3.8 时高甲氧基果胶稳定大豆分离蛋白优于低甲氧基果胶的结果一致。这可能是因为酯化度越低,果胶分子中的羧基含量越高,从而存在与β-酪蛋白更多的结合位点,导致果胶与β-酪蛋白之间的结合过于紧密,反而破坏了维持体系稳定的静电相互作用,使体系的稳定性降低[24]。
2.3 不同结构特征的果胶与β-酪蛋白复合体系的ζ 电位
如表3所示,随着pH 值的降低,ζ 电位都呈升高的趋势。pH≥4 时,β-酪蛋白和果胶都带负电,两者之间发生相互排斥作用,但由于两者的浓度都很低,果胶和β-酪蛋白可以均匀混合成一相,形成共溶体系;pH≤4 时,β-酪蛋白带正电,果胶带负电,两者可以发生静电吸附,此时复合体系的电位值发生显著变化,表明复合物的形成。当pH 低于果胶的电离常数时,果胶的电离受到抑制,从而导致果胶近乎呈电中性,两者之间已形成的复合物的结合程度会渐渐降低至完全解离,此时β-酪蛋白和果胶又恢复到共溶体系。Li 等[25]也发现pH 影响体系的状态,形成静电复合物体系、共溶体系和不溶体系。
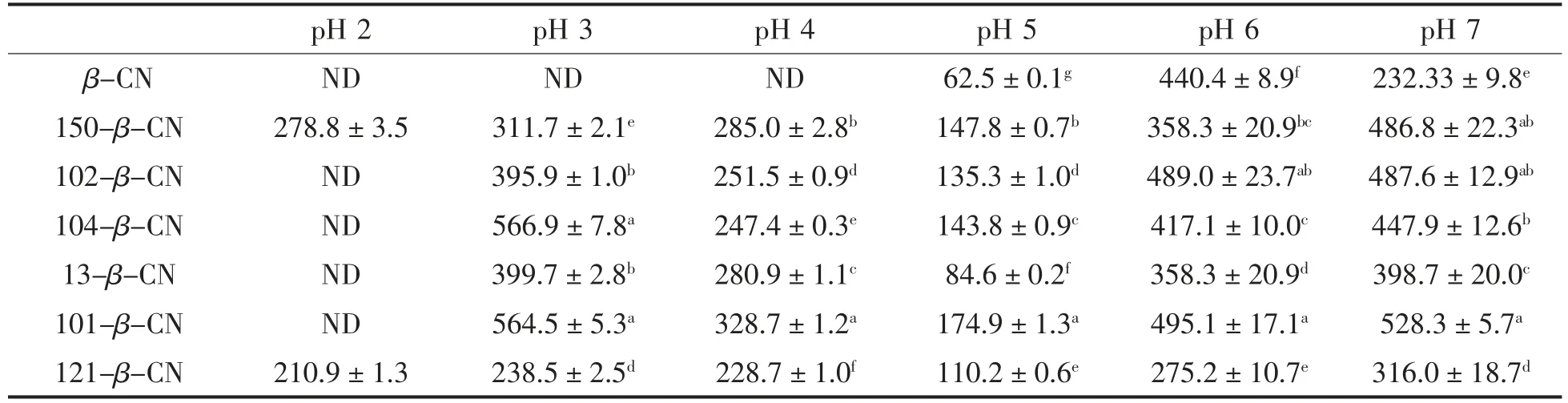
表2 不同结构特征的果胶与β-酪蛋白复合体系随pH 变化的粒径大小(nm)Table 2 Particle size of different structures of pectin and β-casein complexes as a function of pH (nm)

表3 不同结构特征的果胶与β-酪蛋白复合体系随pH 变化的电位大小(mV)Table 3 The potential of different structures of pectin and β-casein complexes as a function of pH (mV)
2.4 不同结构特征的果胶与β-酪蛋白复合体系光谱分析
2.4.1 荧光光谱 蛋白质的内源荧光主要来源于色氨酸(Trp)残基,β-酪蛋白因含有一个色氨酸残基为内源荧光蛋白质,所以可通过荧光光谱法来研究不同结构特征的果胶与β-酪蛋白之间的相互作用及蛋白质结构的变化。如图1所示,添加不同结构特征的果胶使得β-酪蛋白均发生了荧光猝灭现象,荧光猝灭包括激发态反应、能量转移、复合物形成和碰撞淬灭[26]。果胶与β-酪蛋白之间形成了静电复合物,故可导致猝灭现象的发生。不同结构特征的果胶对β-酪蛋白的猝灭程度不一样,H150 果胶的猝灭作用最大,H121、L101、L102和L13 果胶的猝灭作用次之,L104 果胶的猝灭作用最小。
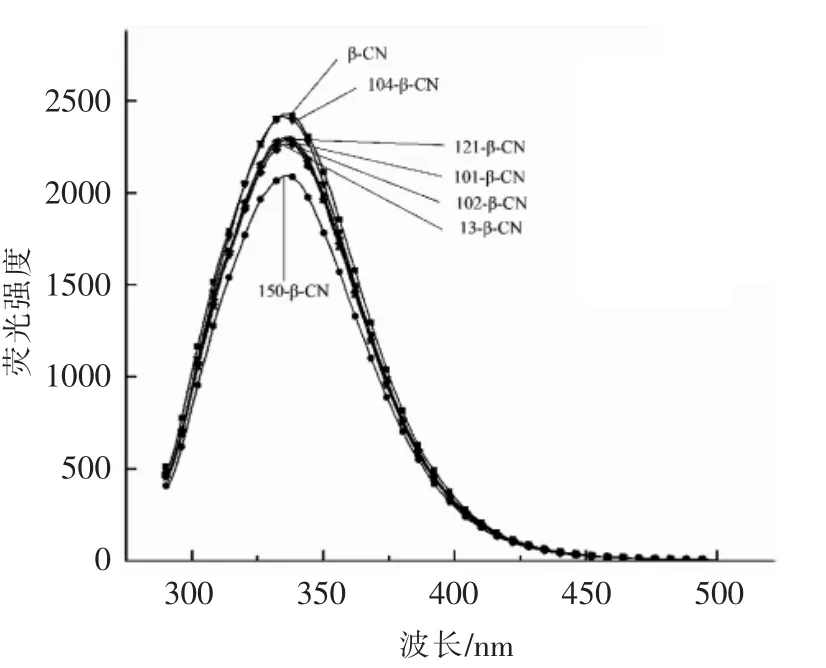
图1 不同结构特征的果胶与β-酪蛋白复合体系荧光图谱Fig.1 Fluorescence spectra of different structures of pectin and β-casein complexes
2.4.2 圆二色谱 表4为添加不同结构特征果胶后β-酪蛋白二级结构的含量,β-酪蛋白的二级结构为:26.35% α-螺旋,15.2% β-折叠,28.6% β-转角和29.85%无规卷曲。果胶的加入导致β-酪蛋白α-螺旋含量减少,β-折叠含量增加,β-转角和无规则卷曲含量没有显著变化,这说明果胶与β-酪蛋白发生相互作用后β-酪蛋白的空间结构发生了展开,部分α-螺旋发生了解体,排列重组后形成了β-折叠。不同结构特征的果胶和β-酪蛋白复合体系的二级结构含量之间没有很显著的差异。

表4 不同结构特征的果胶对β-酪蛋白二级结构含量的影响(%)Table 4 The secondary structure content of different structures of pectin and β-casein complexes (%)
2.5 不同结构特征的果胶与β-酪蛋白复合体系的性质
2.5.1 β-酪蛋白的溶解性 如图2所示,相比单一的β-酪蛋白而言,添加H150、L104 和L13 果胶的复合体系中β-酪蛋白具有更低的溶解性,而添加L102、L101 和H121 果胶的复合体系中蛋白具有更高的溶解性。这可能是因为添加不同结构特征的果胶,引入了不同的基团(羧基、酯基和酰胺基),有些基团与β-酪蛋白分子发生作用,导致其分子柔性增加,表面疏水性降低,从而溶解性增大;而有些基团使β-酪蛋白分子展开,暴露出内部的疏水基团,疏水相互作用增强,使β-酪蛋白趋于聚集或沉淀,从而溶解性降低[27]。
2.5.2 乳化性 如图3所示,相比单一的β-酪蛋白而言,所有果胶与β-酪蛋白复合体系具有更高的乳化能力,L102 和L104 果胶与β-酪蛋白复合体系乳化能力最强,L13、L101 和H121 果胶蛋白复合体系次之,H150 果胶蛋白复合体系较弱,表明低酯果胶比高酯果胶具有更强改善β-酪蛋白乳化性的能力。在乳化的过程中,果胶可通过静电作用与β-酪蛋白发生复合,从而改变β-酪蛋白在油-水界面的吸附行为和界面薄膜的流变特性,提高其乳化性[28]。低酯果胶比高酯果胶带有更多的负电荷,可能更容易与β-酪蛋白发生静电作用。

图2 不同结构特征的果胶与β-酪蛋白复合体系的溶解性Fig.2 Solubility of different structures of pectin and β-casein complexes
2.5.3 起泡性 从图4中可以看出,相比单一的β-酪蛋白而言,所有果胶与β-酪蛋白复合体系具有更高的起泡能力,H150、L102 和L101 果胶与β-酪蛋白复合体系的起泡能力较低,而添加L104、L13 和H121 果胶蛋白复合体系的起泡能力较强。关于蛋白质与多糖复合体系的研究表明:蛋白质的起泡能力会因为蛋白质与多糖形成配位体而得到提高。形成配位体一般有2 种形式:①蛋白质与多糖由于静电相互作用形成配位体;②蛋白质与多糖通过共价键形成牢固的复合物[29]。β-酪蛋白与果胶之间形成了静电复合物,降低了β-酪蛋白的疏水相互作用,导致蛋白分子在空气-水界面扩散速率加快,从而包住气泡,加快和加强气泡的产生。不同结构特征的果胶与β-酪蛋白发生静电相互作用的程度不同,所以也导致最终起泡能力的不同。
2.6 多元线性回归分析
多元线性回归分析是研究一个因变量和多个自变量间的线性关系方法,可用于分析各个自变量和因变量的相关性,并评价各个自变量对因变量的贡献程度,本文采用多元线性回归分析各果胶结构特征与果胶-β-酪蛋白复合体系性质间的相关性,并探讨各结构特征的贡献程度。如表5所示,除了溶解性回归方程的拟合相关系数R2只有0.776 以外,其它性质回归方程都表现出较好的拟合度。
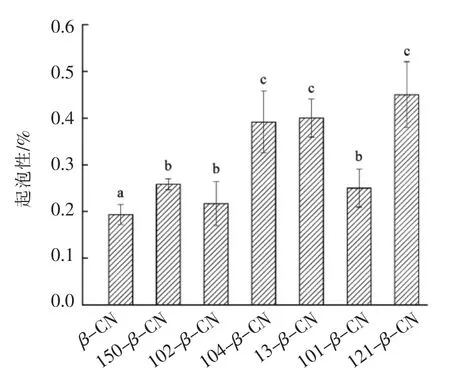
图4 不同结构特征的果胶与β-酪蛋白复合体系的起泡性Fig.4 Foaming ability of different structures of pectin and β-casein complexes
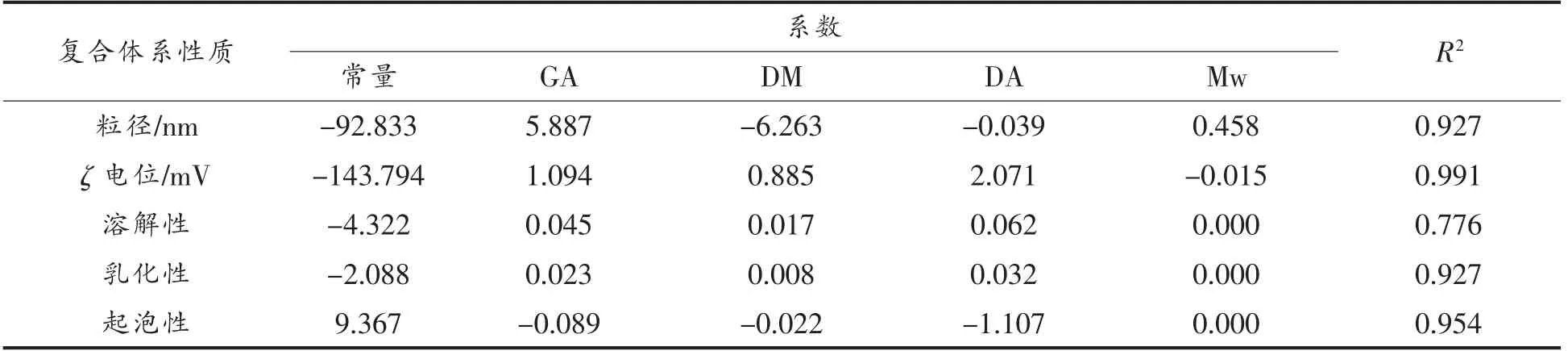
表5 多元线性回归方程系数与R2Table 5 Coefficient of multiple linear regression equation and R2
如表6所示,标准系数表示果胶结构特征和果胶与β-酪蛋白复合体系性质间的相关性。K 值的绝对值越大,表示该果胶结构特征对果胶与β-酪蛋白复合体系性质的影响越大。果胶与β-酪蛋白复合体系的粒径与GA 和Mw 呈正相关,与DM 和DA 呈负相关,Mw 对粒径的影响最大,而DA 对粒径几乎没有影响;ζ 电位与GA、DM 和DA 呈正相关,与Mw 呈负相关,DM 对其影响最大,Mw 对其影响最小;溶解性和乳化性都与GA、DM 和DA 呈正相关,与Mw 呈负相关,DA 对两者的影响最大,Mw 对两者的影响最小;起泡性与GA 和DM 呈正相关,与DA 和Mw 呈负相关,DA 对其影响最大,Mw 对其影响最小。
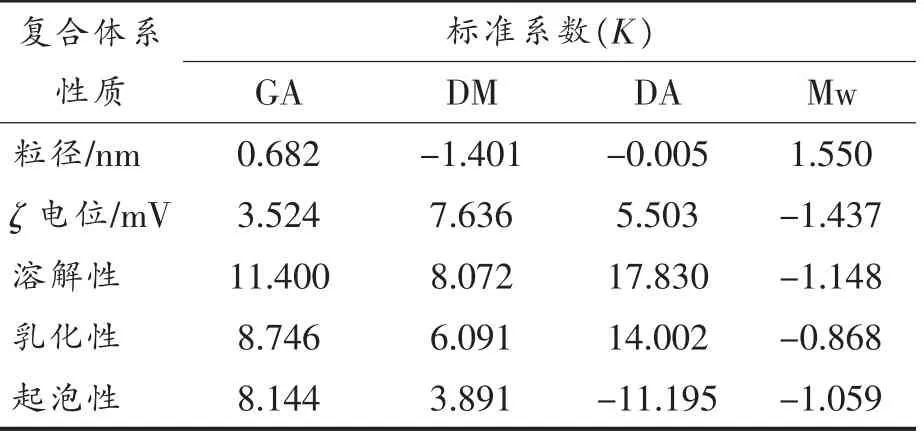
表6 多元线性回归方程标准系数Table 6 Standard coefficient of multiple linear regression equation
3 结论
研究表明不同结构特征的果胶与β-酪蛋白复合体系有着不同的结构特征和理化性质,并具有显著性差异。在果胶与β-酪蛋白复合体系中,两者之间发生了静电相互作用,高酯果胶比低酯果胶稳定体系的能力更强;果胶的添加改变了β-酪蛋白的分子结构。相比单一的β-酪蛋白而言,所有果胶与β-酪蛋白复合体系具有更高的乳化能力和起泡能力。溶解性和乳化性与GA、DM 和DA 呈正相关,与Mw 呈负相关,DA 对两者的影响最大,Mw 对两者的影响最小。起泡性与GA 和DM呈正相关,与DA 和Mw 呈负相关,DA 对其影响最大,Mw 对其影响最小。
