不同强化处理措施对铜污染土壤微生物多样性的影响
2022-06-01张国威商侃侃
张 倩,张国威,商侃侃
(上海辰山植物园,城市园艺技术研发与推广中心,上海 201602)
0 引言
随着工农业的迅速进步和发展,铜污染已成为重要的土壤环境问题,不仅导致土壤质量下降,而且还干扰土壤生物体的生命代谢,并威胁农产品质量安全[1]。由于可持续、低投资、多功能等优势,植物修复被普遍认为是一种的安全途径。木本植物具有根系发达、生长迅速且生物量大等特征,利用其对重金属污染进行修复已经成为植物修复领域的一个热点[2-3]。添加有机废弃物可以提高植物重金属提取量和修复效率,同时也可以达到“以废制污”的目的,但其对土壤重金属生物有效性及修复效果仍存在较大分歧[4]。螯合剂能够活化土壤中的重金属,从而强化植物对土壤中重金属的吸收[5]。因此,通过螯合剂和有机物覆盖的联合作用下,应该可以有效提高植物的生物量、产量和重金属利用效率。
提高植物修复效率依赖于土壤理化性质、重金属、土壤微生物等和植物之间的相互作用[6]。土壤微生物多样性和丰富度已成为衡量土壤质量高低的重要生物学指标[7]。在整个能量转化过程中,微生物起着积极作用,通过改善根际土壤质量从而促进植被的生长,达到提高植物对重金属提取量的目的。重金属会给土壤微生物带来较大的影响,包括种群增长特征、群落结构以及生理生化和遗传等方面都会对胁迫做出响应[8]。施用有机肥能够为土壤微生物提供营养物质,利于土壤微生物建群,减弱微生物间的竞争作用,进而使微生物多样性增加[9]。化学螯合剂能够活化土壤中存在的重金属对土壤微生物群落产生影响[10]。目前针对于有机物覆盖、螯合剂以及联合强化处理措施对铜污染土壤微生物多样性的影响对比研究较少。
本研究采用illumina MiSeq高通量测序技术,较于传统分析技术能够产生覆盖深度更大的数据量[11],旨在通过研究不同强化处理措施对铜污染土壤微生物多样性的影响,以期为解释土壤微生物影响植物吸收累积重金属的机理以及提高植物-微生物联合修复重金属污染效率提供了基础数据和参考。
1 材料与方法
1.1 试验场地与材料
试验场地位于上海辰山植物园土壤污染修复模拟试验场(31°4′39″N、121°11′12″E)。试验场地地区属北亚热带季风气候,年均气温17.8℃,年均日照1997.1 h,年均降水量1103.2 mm,年均蒸发量1257 mm[12]。
测定铜污染样地表层土壤(0~30 cm)的基本理化性质为:容重1.51 g/cm3,含水量24.2%,总孔隙度41.0%,pH 8.15,电导率226.7 μS/cm,有机质26.2 g/kg,水 解 氮 70.7 mg/kg,有 效 磷 8.4 mg/kg,速 效 钾297.3 mg/kg,铜含量为452.8 mg/kg。
供试植物为杂交新美柳(Salix matsudana×alba);EDTA购买于国药集团化学试剂有限公司;树枝落叶类覆盖物来自上海辰山植物园。
1.2 试验设计与处理
设置如表1共5个处理,每个处理3个重复,共计15个样地,每个样地面积3.3 m×2.3 m。2019年3月,分别用长度为25 cm杂交‘新美柳’插穗,以10株/m2扦插于土壤中,T1和T3处理进行6~8 cm树枝落叶类覆盖,CK、T0和T2覆盖6~8 cm厚度的原土。生长20天后,T2和T3处理样地加入浓度为5 mmol/L EDTA,常规管理。

表1 田间小区试验不同强化处理措施情况
1.3 土壤样品采集
于2020年9月进行土壤采集,采用“Z”型随机取样法每个样地各采集3份土样,深度约为15 cm,将3份土样进行充分混合,并除去较大的石块、杂草、根系等杂物后,过2 mm筛后将土样装于无菌封口袋中,共计15个样品(5个处理×3个重复),用于土壤微生物测序分析。
1.4 土壤微生物总DNA提取和高通量测序
采用OMEGA土壤DNA试剂盒(D5625-01)提取土壤样品DNA基因组,提取DNA的数量和质量用Eppendorf RS232G紫外可见分光光度计进行检测。以 V3-V4 区 特 异 性 引 物 338F (5′-ACTCCTACGGGAGGCAGCAG-3′) 和 806R(5′-GGACTACHVGGGTWTCTAAT-3′)[13]进行 PCR 扩增 ,采用illumina MiSeq对PCR扩增产物进行测序分析。土壤样品的微生物测序由上海美吉生物医药科技有限公司完成。
1.5 数据处理与分析
根据PE reads之间的overlap关系,将成对的reads拼接(merge)成一条序列,同时对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向,即为有效序列。
使用QIIME软件(V1.9.1)对有效序列进行识别,利用USEARCH去除没有重复的单序列后,按照97%相似性对非重复序列进行OTU聚类,基于silva数据库,采用RDP classifier贝叶斯算法(默认置信度阈值为0.7)对选出的OTU代表序列进行物种注释后开展后续的测序数据分析。
2 结果与分析
2.1 测序序列处理及优化
经数据前处理,15个样品总DNA的16S rDNA V3+V4区共得到962574条有效序列数据,序列平均长度为419 bp,与16S rDNA V3+V4区序列长度大致吻合,对15个样本进行数据抽平处理,每个样本均含56729条有效序列,为统计方便,此后提到的有效序列均为抽平后的数据。按照16S rDNA相似性≥97%为一个OTU分类单元,进行聚类后共得到7501个OTUs,并可以确定为42个门,145个纲,359个目,562个科,1060个属,2290个种。
对所有样本序列进行随机抽样,构建土壤中微生物的Shannon指数稀释曲线,由图1可以看出,5个处理的稀释曲线随着测序量的增大,OTU增加数目的速度逐渐趋于平缓,同时样品所得到的序列的覆盖度均高于97%,表明样本测序深度足够,得到的数据量合理,可反映样品中微生物群落的种类和结构。
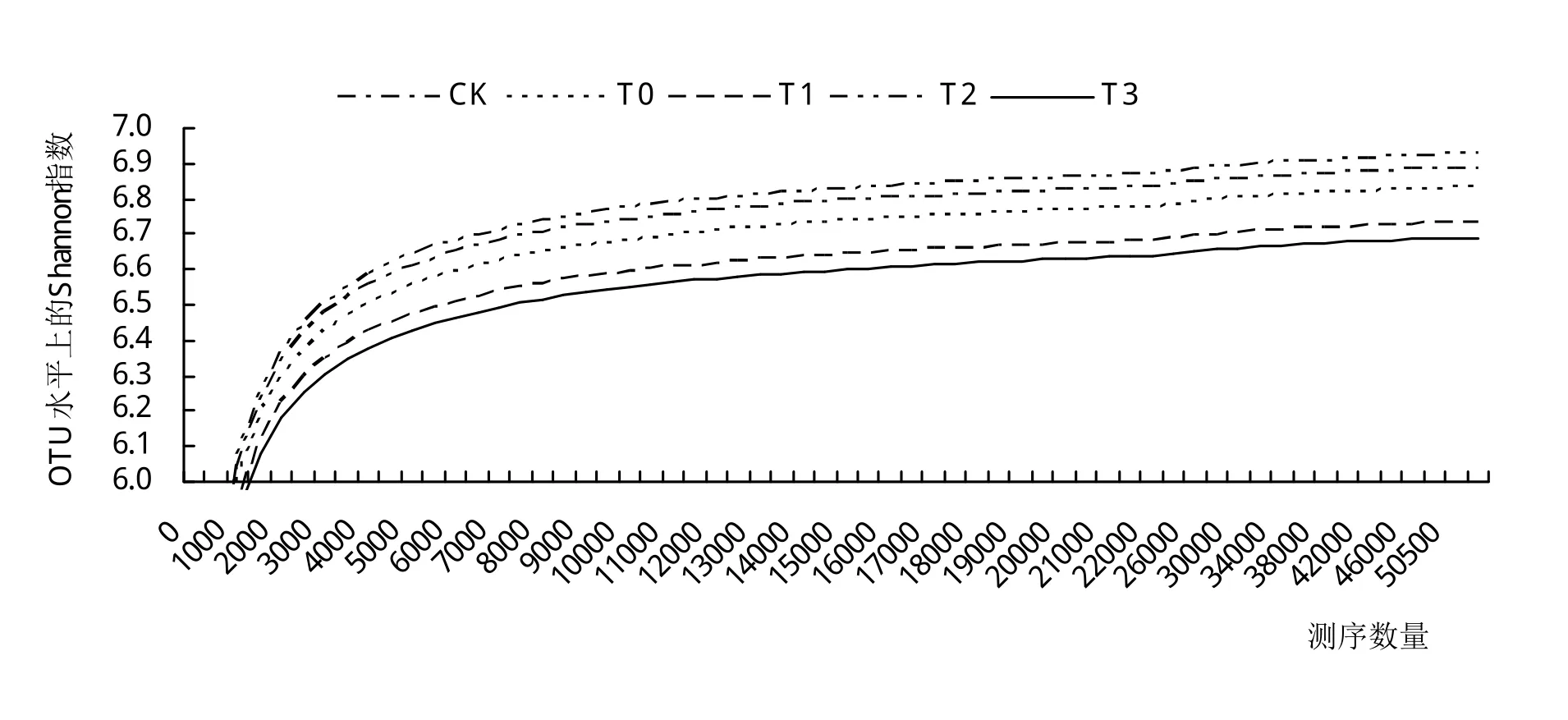
图1 不同处理土壤微生物Shannon稀释曲线
2.2 土壤微生物群落物种组成
计算不同处理土壤样品中微生物在门水平上的物种平均相对丰度,绘制了丰度聚类热图。由图2所知,不同处理土壤微生物群落组成在门水平上较为相似,优势物种相同,微生物相对丰度较大的门类为酸杆菌门 (Acidobacteria,21.80% ~25.86%)、变 形 菌 门(Proteobacteria,19.21% ~23.74%)、放 线 菌 门(Actinobacteria,12.11% ~17.53%)、绿 弯 菌 门(Chloroflexi,9.69%~12.53%)和厚壁菌门(Firmicutes,5.38%~11.50%)。T0和T1处理土壤微生物群落组成较为相似,聚为一类;CK位于较远的聚类分支上,说明空白对照与不同处理下的土壤微生物群落组成差异相对较大。

图2 不同处理土壤微生物在门水平上的丰度聚类热图
Venn图展示了不同处理土壤微生物群落共有或特有的OTU数。由图3可知,CK、T0、T1、T2和T3分别含有 4911、5217、4848、5429、5212 个 OTUs,其中2622个OTUs为5个处理的共有OTU,占比在50%以上,说明这部分微生物群落对环境改变表现出稳定性。5个处理土壤微生物群落特有的OTU分别为349、151、124、197、122个,CK处理特有OTU数最多。

图3 不同处理土壤微生物Venn图
对比CK和T0处理,共有OTU数为3679个,分别占CK和T0处理OTU总数的74.91%和70.52%;对比T0和T1处理,共有OTU数为4106个,分别占T0和T1处理OTU总数的78.70%和84.69%;对比T0和T2处理,共有OTU数为4069个,分别占T0和T2处理OTU总数的78.00%和74.95%。
2.3 土壤微生物群落多样性比较
对不同强化处理措施下土壤微生物Alpha多样性指数进行统计,通过指数组间差异分析(WelchT检验)发现,T2处理土壤微生物的多样性和丰富度均最大,且群落多样性和T1处理的差异达到了显著水平(0.01<P≤0.05)。与CK相比,铜胁迫(T0~T3处理)均增加了土壤微生物群落的丰富度(图4)。

图4 不同处理土壤微生物Alpha多样性指数
根据样本的OTU丰度信息对土壤微生物群落进行主坐标分析(PCoA),由图5可知,不同处理的3个重复均聚类在一起,说明OTU水平上5个处理的组间差异大于组内差异。基于Bray-Curtis距离进行Adonis分析,结果表明:在OTU水平上,5个不同处理土壤微生物组成具有显著差异(R2=0.5609,P=0.001)。T0和T1处理位于同一象限,说明这2个处理微生物群落结构较为相似;CK距离最远,说明和其他四组处理微生物群落差异性最大。
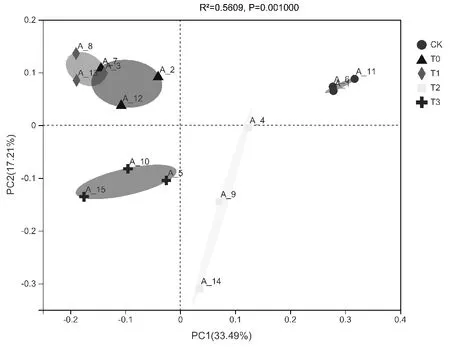
图5 不同处理土壤微生物PCoA分析
2.4 土壤微生物群落差异物种比较
基于样本中群落丰度数据,使用WelchT检验方法对不同处理土壤微生物群落进行门水平上的两组间差异显著性检验分析(图6)。

图6 不同处理土壤微生物门水平上两组间差异显著性检验分析
针对微生物群落的优势物种(相对丰度>5%),和CK相比,T0处理增加了酸杆菌门、变形菌门和厚壁菌门的相对丰度,放线菌门和绿弯菌门的相对丰度降低。和T0相比,T1处理增加了厚壁菌门、酸杆菌门和变形菌门的相对丰度,放线菌门和绿弯菌门的相对丰度降低;T2处理增加了变形菌门和放线菌门的相对丰度,酸杆菌门、绿弯菌门和厚壁菌门的相对丰度降低;T3处理增加了酸杆菌门、绿弯菌门和变形菌门的相对丰度,厚壁菌门和放线菌门的相对丰度降低。
与CK相比,T0处理下拟杆菌门(Bacteroidota)的丰度显著升高,Methylomirabilota、浮霉菌门(Planctomycetota)、匿 杆 菌 门 (Latescibacterota)、Entotheonellaeota和Armatimonadota的丰度显著降低。与T0处理相比,T1处理下Entotheonellaeota和异常球菌-栖热菌门(Deinococcota)的丰度显著升高,匿杆菌门和Sumerlaeota的丰度显著降低;T2处理下蓝细菌(Cyanobacteria)的丰度显著降低;T3处理下MBNT15的丰度显著升高。
不同处理下出现了一些特异物种,异常球菌-栖热菌门在T0、T1、T2和T3中发现,CK中并未检测出;Deferrisomatota在CK、T1、T2和T3中发现,T0中并未检测出;Calditrichota、WS2、螺旋体门(Spirochaetota)和DTB120在CK、T0、T2和T3中发现,T1中并未检测出;Abditibacteriota在T1和T3中发现,CK、T0和T2中并未检测出;FCPU426在T0和T3中发现,CK、T1和T2并未检测出。
3 结论
在门水平上,不同处理土壤微生物群落组成较为相似,优势物种相同,丰度较大的门类为酸杆菌门、变形菌门、放线菌门、绿弯菌门和厚壁菌门。
在OTU水平上,不同处理土壤微生物组成具有显著差异,对微生物群落影响排序为:铜胁迫>螯合剂>有机物覆盖;不同处理出现了特异物种,空白对照和其他处理差异性最大,铜胁迫和有机物覆盖处理微生物群落组成最为相近。
铜胁迫均增加了土壤微生物群落的丰富度;添加螯合剂处理土壤微生物群落的多样性和丰富度均最大,且群落多样性和有机物覆盖处理的差异达到了显著水平。
4 讨论
在门水平上,不同处理土壤微生物群落组成较为相似,优势物种相同。在OTU水平上,不同处理土壤微生物群落组成具有显著差异,但仍有部分微生物对环境改变表现出稳定性以及高抗铜污染能力。寇书萌等[14]通过研究铜、铅、锌以及3种复合污染土壤微生物群落结构发现,各处理组之间的扩增群落存在差异,但微生物群落大部分种类表现出对重金属污染的耐受性,说明修复后的土壤微生物群落可以恢复或保持与未处理对照组相似的结构。
通过对比两组间共有OTU发现,占比从大到小分别为:T0和T1,T0和T2,CK和T0,由此可以得出,不同强化处理措施对微生物群落影响排序为:铜胁迫>螯合剂>有机物覆盖。
Alpha多样性是评价土壤微生物群落多样性和物种丰富度的重要指标。本研究发现,与空白对照相比,铜胁迫处理均增加了土壤微生物群落的丰富度,这与葛艺等[15]研究小麦非根际以及根际微生物群落丰富度的结果一致。另外,添加螯合剂处理土壤微生物的多样性和丰富度均最大。赵金博等[16]通过梯度试验探究EDTA处理土壤残留液对微生物群落的影响发现,在0-10 mmol/L浓度的EDTA处理下,微生物群落没有明显变化,在5 mmol/L浓度的EDTA处理下土壤微生物总量略有上升。罗春玲等[17]研究表明不同浓度EDDS处理对土壤微生物群落结构没有显著影响。
针对微生物群落的优势物种(相对丰度>5%),铜处理增加了酸杆菌门、变形菌门和厚壁菌门的相对丰度,放线菌门和绿弯菌门的相对丰度降低;有机物覆盖处理增加了厚壁菌门、酸杆菌门和变形菌门的相对丰度,放线菌门和绿弯菌门的相对丰度降低;螯合剂处理增加了变形菌门和放线菌门的相对丰度,酸杆菌门、绿弯菌门和厚壁菌门的相对丰度降低;有机覆盖+螯合剂处理增加了酸杆菌门、绿弯菌门和变形菌门的相对丰度,厚壁菌门和放线菌门的相对丰度降低。靳晓拓等[18]研究报道有机质与放线菌门和变形菌门相对丰度成正相关,与厚壁菌门的相对丰度呈负相关;程存刚等[19]研究表明有机物料的种类对于微生物种群结构的影响差异显著,因此可能由于土壤性质、有机质类型以及施用量差异导致与本研究结果不完全一致。Berg等[20]研究表明绿弯菌门对高金属含量具有普遍不耐受性,比如铜。安梦洁等[21]通过FTIR分析和高通量测序表明,碳氢键的形成为放线菌门和绿弯菌门提供了适宜的环境,有利于提高微生物丰度。而施用修复剂使土壤中Pb和Cd的有效性降低,破坏了碳氢键,因而使得放线菌门和绿弯菌门的丰度减少。Bonanomi等[22]研究表明酸杆菌门能够降解纤维素和木质素,进而为土壤提供养分。本研究中,铜处理下酸杆菌门的丰度增加,表明土壤可能通过增加酸杆菌门细菌的丰度进而促进木质素和纤维素的分解,以增强柳树对养分的吸收。寇书萌等[14]研究表明铜胁迫会增加土壤中酸杆菌门和变形菌门的相对丰度,与本研究结果一致。有研究指出,外源增加土壤中酸杆菌门和厚壁菌门的丰度,可以改变微生物种群的相互作用和平衡,从而促进作物生长[23-24]。有研究表明,水稻田中变形菌门微生物具有耐重金属性,具有固氮功能,利用光合作用储存能量[25]。
不同处理下出现了特异物种,空白对照中未检出异常球菌-栖热菌门,有研究表明该军门包括对严酷环境有抗性的球状细菌[26],可能是铜胁迫下产生了具有特殊选择性优势的耐金属极端微生物。单一铜胁迫下,Deferrisomatota未检出,可能是高浓度铜胁迫造成该物种被消除。有机物覆盖处理下,Calditrichota、WS2、螺旋体门和DTB120未检出,可能是树枝落叶类覆盖单独处理下产生某种胁迫导致这些物种被消除。有机物覆盖和有机物覆盖+螯合剂联合处理中检出Abditibacteriota,可能是树枝落叶类覆盖处理下产生的具有特殊选择性优势的微生物。单一铜胁迫和有机物覆盖+螯合剂联合处理中检出FCPU426,原因待进一步分析。
