藻蓝色素蛋白诱导非小细胞肺癌H1299细胞凋亡的机制
2021-01-15李前程刘媛璞王成涛
郝 帅,李前程,李 爽,刘媛璞,王 静,王成涛
(北京市食品营养与人类健康高精尖创新中心 北京市食品添加剂工程技术研究中心北京工商大学食品与健康学院 北京100048)
肺癌是世界上最常见的恶性肿瘤之一[1],具有很高的发病率和致死率[2]。其中,作为肺癌的一种亚型,非小细胞肺癌(non-small cell lung cancer,NSCLC)的发病率高达85%[3],严重危害人类健康。不仅如此,非小细胞肺癌还具有较高的浸润能力和术后复发率。对于非小细胞肺癌的治疗仍然面临许多挑战。
藻蓝色素蛋白(C-Phycocyanin,C-PC)是一种源于螺旋藻、蓝藻细胞中的捕光蛋白,在藻体细胞内以六聚体的结构存在[4],吸收光谱为615~640 nm[5]。在GB 2760-2014《食品安全国家标准 食品添加剂使用标准》中,藻蓝被列为我国允许使用的天然食品着色剂,可用于饮料、糕点、糖果等食品生产中。除了能作为食用色素广泛用于食品行业,藻蓝色素蛋白同时具有抗氧化、抗炎、抗肿瘤等多种生理功能[6]。目前,有报道证实藻蓝蛋白对包含肺癌在内的多种肿瘤细胞系具有促进凋亡,抑制增殖迁移的作用[7-11]。例如,Pardhasaradhi 等[8]发现藻蓝蛋白对组织细胞瘤AK-5 细胞具有较强的抑制作用;Subhashini 等[9]发现藻蓝蛋白能够促进慢性白血病细胞K562 的凋亡;Liao 等[10]则通过研究证实了藻蓝蛋白对胰腺癌细胞的体内外抑制效应。纵观目前的研究现状,大量的研究表明藻蓝蛋白具有非常优良的肿瘤抑制作用,而对于其中调控机制的报道还非常少。鉴于藻蓝蛋白所具有的天然、安全、抗肿瘤等优良特性,深度研究其抗癌调控机制具有重要意义,可为非小细胞肺癌的治疗提供新思路。
本实验室前期研究证实藻蓝蛋白对非小细胞肺癌H1299 细胞具有促凋亡、抑增殖的作用[7],具体的调控机制尚不明确。为了探究藻蓝蛋白在非小细胞肺癌中的调控机理,本文以高通量检测技术为手段,对藻蓝蛋白处理过的H1299 细胞进行转录组分析,筛选潜在的调控靶点,检测细胞凋亡和增殖能力。本研究结果为深入揭示藻蓝蛋白在非小细胞肺癌中的作用机制,以及为功能性食用色素的抗肿瘤治疗提供了新的理论基础。
1 材料与方法
1.1 材料与试剂
人类非小细胞肺癌NCI-H1299 细胞系(以下简称H1299 细胞系)由本实验室(北京市食品添加剂工程技术研究中心)保存;藻蓝蛋白标准品由内蒙古农业大学惠赠。
转染试剂Lipofectamine3000,美国Invitrogen公司;TIRAP 多克隆抗体,美国Immunoway 公司;NF-κB 信号通路抗体试剂盒、Bax/Bcl-xL 多克隆抗体,美国Cell Signaling Technology 公司;TIRAP siRNA、Negative control siRNA (Neg.siRNA),上海吉玛制药有限公司,其中siRNA 序列设计如表1。

表1 siRNA 序列Table 1 Sequences of siRNA segments
1.2 仪器与设备
CFX96 Touch 荧光定量PCR 仪、SDS 聚丙烯酰胺凝胶电泳仪,美国Bio-Rad 公司;SpectraMax i3 多功能酶标仪,美国MD 公司;Phantom9900XL扫描仪,MICROTEK 公司;恒温CO2细胞培养箱,Heraeus Eppendorf 公司;流式细胞仪,美国BD 公司;X-Ray 洗片机,上海德沐泰钶科贸有限公司;NANODROP2000 浓度测定仪、高速冷冻离心机,美国Thermo 公司;恒温水浴振荡器、超净台,上海博讯医疗生物仪器股份有限公司。
1.3 方法
1.3.1 细胞培养 H1299 细胞采用含10%胎牛血清、1%双抗的DMEM 培养基,置于37 ℃,5% CO2恒湿培养箱中培养。定期传代,将用于试验的细胞状态调整至最佳。
1.3.2 细胞的siRNA 转染 将适量细胞铺于六孔板、60 mm 培养皿过夜培养,当细胞汇合度达到30%~50%时进行细胞转染。准备适量无RNA 酶的进口EP 管,按照转染试剂Lipofectamine 3000说明书操作,取适量Lipofectamine 3000(使用前轻轻摇匀),用Opti-MEM 培养基稀释,轻轻混和。在另一EP 管中取适量TIRAP siRNA,用Opti-MEM 培养基稀释,轻轻吹打混合,随后将两管混合物混匀。室温孵育10 min,最后将转染复合物均匀滴加到细胞中,培养48~72 h 用于后续相关试验。在转染时,同时设置Negative siRNA 转染组为阴性对照组。
1.3.3 细胞生长曲线的测定 采用MTT 法测定H1299 细胞的生长曲线。将转染的细胞铺于96 孔板中,待细胞贴壁后加入含有10% MTT 的完全培养基100 μL,放置CO2培养箱培养4~6 h,再加入同体积的SDS-HCL 裂解液,12 h 后测定570,630 nm 处吸光值。以630 nm 吸光值作为参考,每组4 个副孔作为平行,连续检测6 d 吸光值,记录数据绘制细胞生长曲线。
1.3.4 倒置显微镜观察H1299 细胞形态学变化配制含4.8 μmol/L 浓度的藻蓝蛋白的培养基,处理H1299 细胞,培养箱培养72 h,弃去培养基并用PBS 洗涤2 次,倒置显微镜观察细胞形态变化,拍照保存。同样,沉默TIRAP 的H1299 细胞转染后放置培养箱中培养72 h,当出现形态变化时,拍照保存。
1.3.5 定量PCR(qRT-PCR)检测TIRAP 基因转录水平表达 TRIZOL 法提取转染TIRAP siRNA,Neg.siRNA 的H1299 细胞的总RNA,在超净台中吹干RNA,加入适量DEPC 水溶解,反复吹打混匀,使RNA 充分溶解。根据浓度计算2 μg 质量的RNA 体积,作为反转录cDNA 的模板,反转录体系为20 μL,加入5×gDNA Buffer 2 μL,再用DEPC 水补齐到10 μL,简短离心,放置42 ℃,孵育3 min,加入下一步的Mix。Mix 体系为10×FastRT Buffer 2 μL,RT EnzymeMix 1 μL,FQ-RT Primer Mix 2 μL,RNase-Free ddH2O 5 μL,42 ℃孵育15 min,95 ℃孵育3 min,4 ℃保存。剩余RNA可放于-80 ℃冰箱保存。qRT-PCR 反应体系为20 μL,程序设置采用3 步法,设计引物序列如表2(GAPDH 为内参基因)。
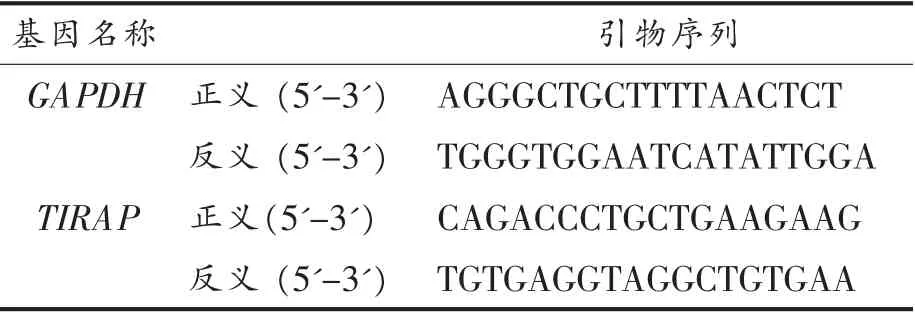
表2 用于定量PCR 的引物序列Table 2 Primer sequences of qRT-PCR
1.3.6 蛋白质免疫印迹试验 (Western Blot)利用RIPA 裂解液提取细胞总蛋白,首先收集试验细胞,加入适量体积的RIPA 裂解液,冰上裂解1 h,期间每隔10~15 min 混匀一次,使细胞裂解充分。4 ℃离心45 min,小心吸出上层蛋白清液,取适量蛋白进行浓度测定,利用Bradford 法测定其浓度。取出适量蛋白用于免疫印迹试验,其余蛋白分装好放入-80 ℃冰箱保存。配置体积分数12%的SDS 胶,将Marker、对照组、试验组蛋白依次进行上样,设定80 V 电压开始电泳,当蛋白全部从浓缩胶跑到分离胶时,设定120 V 电压继续蛋白电泳,电泳结束后进行转膜,350 mA 转膜1.5 h,随后根据目的条带大小剪膜,随后用5%脱脂奶粉封闭目的条带1.5 h、孵育一抗过夜。第2 天TBST 溶液清洗3 次,每次15 min,37 ℃恒温静置孵育二抗1 h,再经TBST 溶液清洗3 次,孵发光液显色,洗片机曝光目的条带蛋白,扫描仪扫描胶片并保存图片。
1.3.7 H1299 细胞的转录组分析 分别采用藻蓝蛋白(试验组)和PBS 溶液(对照组)处理正常培养的H1299 细胞,48 h 后收集细胞并提取总RNA进行转录组测序。基因表达量基于FRKM 的方法进行计算,获得基因表达量FRKM 值。基因的差异比对采用DESeq 软件进行分析,对DESeq 检测结果按照差异显著性标准(差异基因的表达量变化高于2 倍且FDR 值小于0.05)进行筛选,统计基因显著性差异表达上下调的情况。
1.3.8 数据分析 柱状图和折线图中的试验数据均以“平均数±标准差”的形式表示,标准差采用Excel 进行方差分析计算得到。显著性分析采用Excel 进行Student t-test 检验计算P 值,其中当P<0.05 则认定为显著性差异(*),当P<0.01 则认定为极显著差异(**)。
2 结果与分析
2.1 藻蓝蛋白促进非小细胞肺癌H1299 细胞凋亡
首先对藻蓝蛋白处理后H1299 细胞的凋亡情况进行了验证。图1显示,H1299 细胞经藻蓝蛋白作用48 h 后,细胞形态发生显著变化,对照组细胞轮廓清晰,藻蓝蛋白处理组细胞尾部伸长成不规则梭状,细胞活力降低,肉眼可见有少量漂浮细胞。此外,对细胞凋亡经典蛋白Bax,Bcl-xL 进行了蛋白水平检测,结果显示藻蓝蛋白处理后引起细胞内促凋亡蛋白Bax 上调,抑凋亡蛋白BclxL 下调。综上所述,此结果验证了藻蓝蛋白对H1299 细胞的促凋亡诱导作用,为后续试验奠定了基础。

图1 藻蓝蛋白对非小细胞肺癌H1299 细胞凋亡的影响Fig.1 Effect of C-Phycocyanin on apoptosis of NSCLC H1299 cells
2.2 藻蓝蛋白处理H1299 细胞后的转录组分析结果
为了探究藻蓝蛋白在H1299 细胞中的调控机制,本研究对藻蓝蛋白处理后的H1299 细胞进行了转录组差异基因分析。如图2所示,转录组共筛选出了1 521 个差异基因,其中710 个表达上调的基因 (红色点表示),811 个表达下调的基因(绿色点表示)。这些差异基因中,TIRAP 是本试验筛选得到的一个感兴趣的基因,在藻蓝蛋白处理后出现显著下调,下调比例约为60%。研究表明,TIRAP 是一个含有TIR 结构域的适配蛋白,可与MyD88 蛋白结合,进而激活、调控NF-κB 并参与对细胞炎症和细胞凋亡的调控。作为一个细胞活性调控因子,我们推测TIRAP 可能在藻蓝蛋白介导的诱导H1299 细胞凋亡过程中参与重要的作用,因此,为了验证这一假说,本研究对藻蓝蛋白的调控机制进行了更深入的研究。
2.3 差异基因TIRAP 的转录和蛋白水平验证
转录组结果显示TIRAP 为藻蓝蛋白处理后的一个差异基因,随后采用定量PCR 和免疫印迹的方法对差异基因TIRAP 进行了生物学验证。结果如图3所示,藻蓝蛋白处理后,H1299 细胞中TIRAP 的转录水平出现了显著下调,与对照组相比,下调比例约为40%;同时,免疫印迹结果显示,藻蓝蛋白处理后,H1299 细胞中TIRAP 的蛋白表达水平也出现了显著降低。以上结果表明,藻蓝蛋白能够抑制非小细胞肺癌H1299 细胞中TIRAP的表达,这也进一步对转录组的筛选结果进行了验证。
2.4 siRNA-TIRAP 转染H1299 细胞对TIRAP表达的影响
为了探究TIRAP 是否与非小细胞肺癌H1299 的凋亡相关,本研究采用RNA 干扰技术,对H1299 细胞进行了siRNA-TIRAP 小片段的转染试验,以期干预TIRAP 的表达,图4显示了转染siRNA 后细胞中TIRAP 表达水平的变化结果。由图中可以看出,H1299 细胞转染siRNA 后,TIRAP 的转录水平出现了极显著下调,与对照组相比,下降比例达到90%左右;同时,免疫印迹结果也显示转染siRNA 后,细胞内TIRAP 的表达量明显降低。以上结果充分表明,siRNA-TIRAP 小干扰片段在H1299 细胞中作用明显,显著干预了TIRAP 的表达,为后续的试验奠定了基础。
2.5 H1299 细胞沉默TIRAP 后对细胞形态学的影响
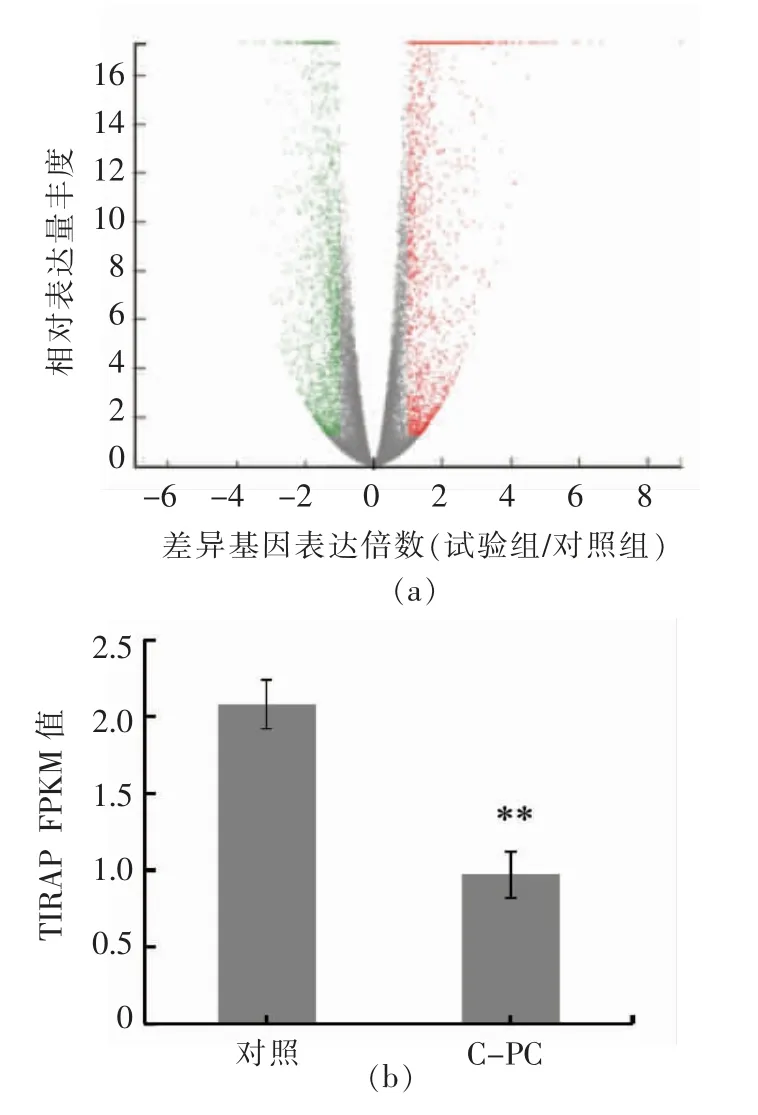
图2 藻蓝蛋白处理H1299 细胞后的转录组分析Fig.2 Transcriptome analysis of H1299 cells after treatment with C-Phycocyanin
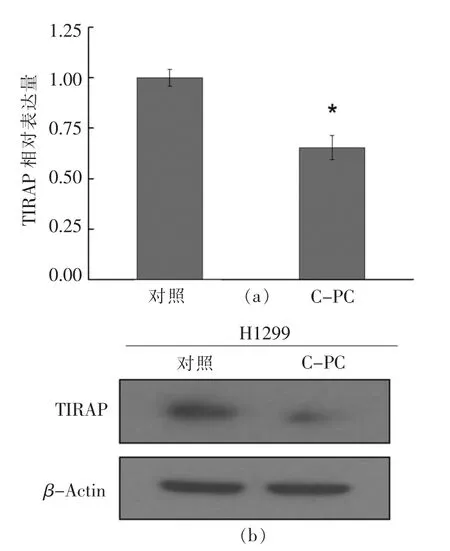
图3 差异基因TIRAP 的转录和蛋白水平验证Fig.3 Validation of TIRAP expression by qRT-PCR and Western blotting analysis
首先对转染siRNA 后的H1299 细胞进行了形态学观察,结果如图5所示。由图可知,H1299细胞沉默TIRAP 后,与对照组相比,细胞形态出现非正常改变,细胞轮廓不清晰,两端伸长成不规则形状,并且伴随着大量漂浮的细胞,此结果与藻蓝蛋白处理H1299 细胞形态学变化基本一致(图1)。由此初步证实TIRAP 参与了藻蓝蛋白介导的促进H1299 细胞凋亡的过程。
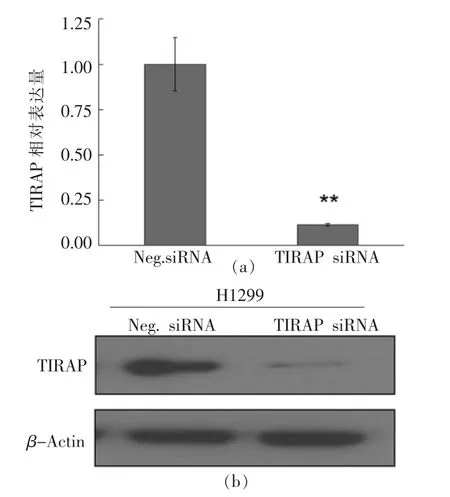
图4 siRNA-TIRAP 转染H1299 细胞对TIRAP表达的影响Fig.4 Effect of siRNA-TIRAP transfection on the expression of TIRAP in H1299 cells

图5 沉默TIRAP 对H1299 细胞形态的影响Fig.5 Effects of siRNA-TIRAP transfection on the morphology of H1299 cells

图6 沉默TIRAP 对H1299 细胞体外增殖能力的影响Fig.6 Effect of siRNA-TIRAP on the in vitro proliferation of H1299 cells
2.6 H1299 细胞沉默TIRAP 后对细胞增殖能力的影响
采用MTT 法对H1299 细胞的体外增殖能力进行了考察。由图6可知,与对照组相比,转染siRNA-TIRAP 后,H1299 细胞从第2 天起生长开始受到显著抑制,在随后的检测中,细胞增殖抑制效果更加明显。此结果表明,干预TIRAP的表达对H1299 细胞的生长具有抑制效果,间接证明了TIRAP 在H1299 细胞凋亡过程中发挥作用。
2.7 免疫印迹试验检测沉默TIRAP 后H1299细胞中凋亡相关蛋白表达
为了进一步验证沉默TIRAP 能引起H1299细胞的凋亡,本研究对转染细胞的凋亡相关蛋白进行了检测。结果如图7所示,与对照组比较,沉默TIRAP 组细胞中促凋亡蛋白Bax 的表达量显著上调,而抑凋亡蛋白Bcl-xL 出现显著下调,以上结果与藻蓝蛋白处理H1299 细胞后凋亡蛋白的表达情况基本一致,充分证实了藻蓝蛋白能够通过下调TIRAP 的表达而促进非小细胞肺癌H1299 细胞的凋亡。
2.8 H1299 细胞沉默TIRAP 对NF-κB 信号通路的影响
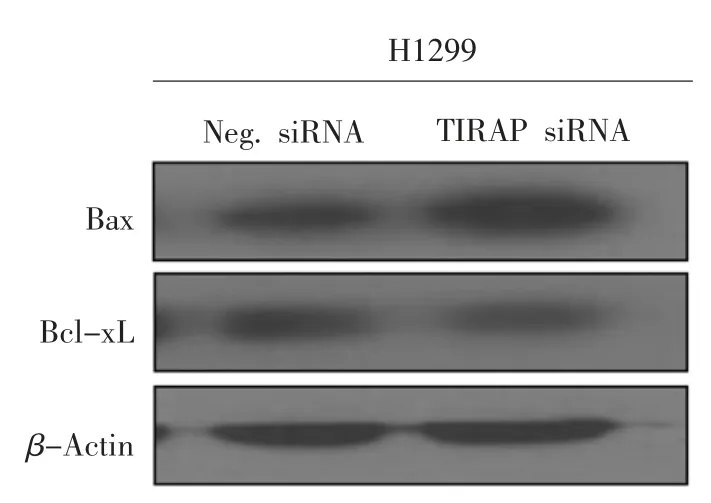
图7 H1299 细胞沉默TIRAP 后凋亡相关蛋白的检测Fig.7 Analysis of apoptosis-related protein expressions in H1299 cells after transfected with siRNA-TIRAP
前期结果证实了藻蓝蛋白能够通过下调TIRAP 表达进而诱导H1299 细胞凋亡,但具体的调控途径仍不太明确。NF-κB 是一类多功能的核转录因子[14-15],包括控制抗凋亡基因和促凋亡基因表达[16],研究表明,抑制NF-κB 通路的活化能抑制肿瘤发展[17]。IKKα 和IKKβ 蛋白被磷酸化后,可以催化通路抑制蛋白IκBα 发生磷酸化,磷酸化的IκBα 参与蛋白酶体依赖性的降解过程,进而与p65 蛋白发生解离,p65 蛋白随后被磷酸化激活,进入细胞核参与转录调控作用,激活NF-κB 信号通路[18]。本文对沉默TIRAP 后H1299 细胞的NFκB 信号通路进行了蛋白水平检测。如图8为NFκB 通路相关蛋白表达情况,结果显示,与对照组相比,沉默TIRAP 后,IKKα、IKKβ 以及p65 蛋白的总量变化不大,但它们的磷酸化水平(p-IKKα/β、p-IκBα 和p-p65)都有明显下调,说明NF-κB通路的活性受到了抑制。以上研究结果表明,藻蓝蛋白能够抑制TIRAP 蛋白的表达,通过降低NFκB 信号通路的活性而诱导H1299 细胞的凋亡。本研究能够为非小细胞肺癌的治疗和藻蓝类功能性食用色素的开发提供新的理论基础。
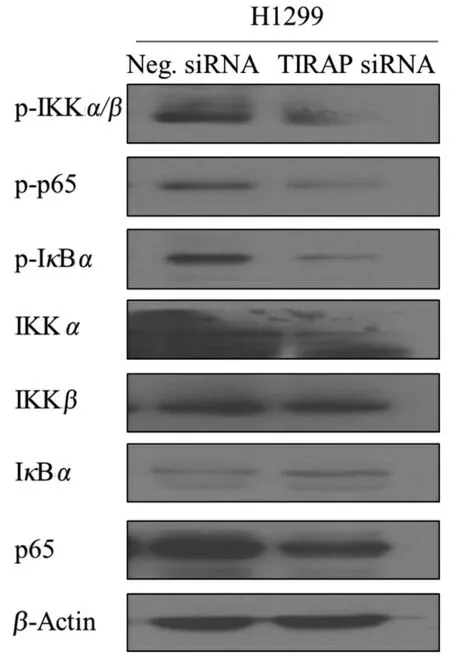
图8 H1299 细胞沉默TIRAP 对NF-κB信号通路的影响Fig.8 Effect of siRNA-TIRAP transfection on the activity of NF-κB pathway in H1299 cells
3 结论与讨论
食用色素是食品添加剂的一个重要门类,运用于各类食品行业中。藻蓝色素蛋白作为一种公认的食用蓝色素,与目前被人们所熟知的醇溶性靛蓝色素相比,颜色更加鲜亮,且具有良好的水溶性,因此有着更加广泛的应用前景。此外,考虑到化学合成色素的安全性问题,天然食用色素具有“绿色、环保”等优点,迎合了广大消费者的需求。
藻蓝色素蛋白的功能特性是近年来国内外研究的热点之一,目前已有相关研究报道了藻蓝蛋白对肺癌细胞的抑制作用。例如,Madamwar 等[19]证实了藻蓝蛋白具有促进肺癌A549 细胞凋亡的能力;Baudelet 等[20]通过研究发现藻蓝蛋白能够抑制肺癌、黑色素瘤以及乳腺癌细胞的增殖。此外,一些研究者也对藻蓝蛋白与其它抗肿瘤物质的联合作用进行了研究,例如,Li 等[21-22]发现藻蓝蛋白与全反式维甲酸具有协同作用,能够诱导肺癌A549 细胞的凋亡;Bingula 等[23]通过研究发现藻蓝蛋白和甜菜碱的联合作用也能够抑制A549 细胞的增殖能力。本团队前期的研究结果也表明,除A549 细胞外,藻蓝蛋白也对非小细胞肺癌H1299,H460 以及LTEP-a-2 细胞具有促凋亡作用[7]。但是,目前的研究几乎没有对藻蓝蛋白诱导肺癌细胞凋亡的调控机制进行报道,仅仅从表型层面了解其抗肺癌效应极大地约束了藻蓝蛋白的深度应用,搜寻藻蓝蛋白的特异性调控靶点能够为肺癌的靶向治疗提供重要的思路。
本研究以H1299 细胞为模型,探究藻蓝蛋白诱导其凋亡的作用机制,通过转录组筛选出了一个潜在的调控靶点TIRAP。TIRAP 蛋白在细胞中主要是参与MyD88 依赖的信号转导途径,当特异性激活TLR2 或TLR4 时,TIRAP 首先移位至细胞膜并通过其氨基端的磷脂酰肌醇二磷酸(phosphatidylinositol 4,5-biphosphate,PIP2)结构域与PIP2 结合,然后再通过保守的TIR(Toll/interleukin 1 receptor domain-containing)结构域与MyD88 蛋白结合并将其募集至TLR 受体,继而激活下游的转录因子NF-κB,诱导细胞炎症因子表达,从而促进细胞凋亡[24-25]。通过体外转染小干扰RNA 将TIRAP 沉默,发现H1299 细胞同样出现了凋亡情况。本研究发现藻蓝蛋白能够通过抑制TIRAP 的表达促进肺癌H1299 细胞的凋亡。研究结果能够为肺癌的潜在治疗和抗癌类功能性食品的开发奠定理论基础。
