人卵巢壁层颗粒细胞和卵丘细胞体外分离及原代培养的比较*
2021-01-06朱洁茹欧建平朱伟杰
朱洁茹,欧建平△,李 涛,朱伟杰
(1中山大学附属第三医院生殖医学中心,广东广州 510630;2暨南大学生命科学技术学院,广东广州 510632)
当卵泡的窦腔形成后,颗粒细胞分化成两种细胞亚群,分别为围绕卵泡壁的壁层颗粒细胞(mural granulosa cells,MGCs)和附着于卵母细胞的卵丘细胞(cumuluscells,CCs)[1]。MGCs 含有多种激素受体,以自分泌和旁分泌的形式调控卵泡发育、成熟与甾体激素合成[2],常用作研究卵巢功能的细胞体外模型。目前人MGCs 主要从取卵术废弃的卵泡液中获取[3],来源易得,但从卵泡液中分离MGCs 需要多次离心等处理,且卵泡液中的MGCs混杂较多红细胞和其它杂质,干扰因素多。因此,应充分阐明MGCs的细胞体外状态,建立合适卵巢功能研究的细胞模型。
CCs是围绕着卵母细胞生长的颗粒细胞层,与卵母细胞形成一个相辅相成的“合胞体”,为卵母细胞提供营养,调节减数分裂的恢复,影响精卵结合和早期胚胎发育[4]。在取卵术中,卵丘卵母细胞复合物被抽吸出来,随后按体外受精(in vitro fertilization,IVF)或单精子卵胞浆内注射(intracytoplasmic sperm injection,ICSI)的需要,一部分CCs 被切割而丢弃。这部分CCs 的获取过程简单,且没有过多的其它杂质,红细胞污染少,从理论上而言,CCs是研究卵巢功能的合适细胞体外模型。但对CCs 细胞模型的实验方法学,以及与MGCs 细胞模型的比较仍需充分评价。
自噬和凋亡是细胞在应对环境变化时的两种方式[5-6],可以反映细胞的活性状态。本项工作比较人MGCs 与CCs 体外分离及原代培养的效果,并检测自噬和凋亡相关基因的表达来分析分离后的细胞特性,以期为深入认识MGCs 与CCs 的细胞体外状态、建立卵巢功能研究的细胞模型提供参考资料。
材料和方法
1 颗粒细胞来源
选取16 例于中山大学附属第三医院生殖医学中心行IVF/ICSI患者取卵日的卵泡液及其卵丘-卵母细胞复合物(223 个),所收集标本均为医疗废物,由常规治疗过程产生,标本获取不影响患者的治疗。所有患者均签署知情同意书,本研究经中山大学附属第三医院伦理委员会批准。患者年龄24~43 岁,无合并全身重大脏器疾病或慢性内科疾病。
2 主要试剂
0.25 %胰酶、DMEM/F12 培养液和胎牛血清(fe⁃tal bovine serum,FBS)购自Gibco;淋巴细胞分离液(Ficoll-Paque PREMIUM)购自Pharmacia;台盼蓝和磷酸盐缓冲液(phosphate buffer solution,PBS)购自北京索莱宝公司;卵泡刺激素受体(follicle-stimulat⁃ing hormone receptor,FSHR)流式抗体购自R&D Sys⁃tems;红细胞裂解液购自BD;高纯总RNA 快速提取试剂盒(离心柱型)、逆转录试剂盒和PCR 试剂购自TaKaRa;RIPA 裂解缓冲液购自上海碧云天生物技术研究所;脱脂奶粉购自Difco;GAPDH 抗体、微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)抗体、P62 抗体、Bax 抗体、Ⅱ抗羊抗兔IgG购自Proteintech。
3 方法
3.1 MGCs和CCs的分离
3.1.1 MGCs 的分离 收集拾卵后弃去的卵泡液,200×g离心10 min 后弃上清,PBS 重悬,并加入等体积的0.25%胰酶,室温消化15 min 后用含10% FBS的DMEM/F12培养液终止消化,200×g离心10 min后弃上清,PBS 重悬,然后缓慢地小心地将悬液转移到等量的Ficoll分离液液面上,400×g离心20 min,若此时液体未出现明显分层,可适当加大离心力或延长离心时间。至分层明显后,将中间颗粒细胞层小心吸出,用含10% FBS 的培养液洗涤1 次后重悬待计数。
3.1.2 CCs 的分离 拾卵时吸出卵丘-卵母细胞复合物后,在MOPS 缓冲液中用1 mL 注射器机械切割挑出卵子周边的卵丘颗粒细胞团,并用IVF 液冲洗,随后转移至无菌离心管中,加入1~2 mL 0.25%胰酶,室温下消化并反复吹打,3~5 min 后用含10%FBS 的DMEM/F12 培养液终止消化,PBS 洗涤1 次,离心后重悬待计数。
3.2 细胞计数与存活率检测 称量4 g 台盼蓝粉末,加入100 mL纯水溶解,过滤后取滤液,即配成4%台盼蓝母液;使用时将台盼蓝母液与PBS 缓冲液以1∶9 的比例配成0.4%工作液。将MGCs 和CCs 细胞悬液稀释成(1~10)×105/L 的密度,吸取100 μL 至EP管中,以1∶1 的比例与0.4%台盼蓝工作液混合,静置3 min 后吸取10 μL 至血球计数板中,进行细胞计数和存活率检测。
3.3 细胞原代培养、细胞爬片与HE染色 将MGCs和CCs 细胞悬液接种至6 孔板中,置于37℃、5%CO2的培养箱中培养,(24~48)h 换液1 次,第1 次为半量换液,以后为全量换液。培养后48 h 于显微镜下观察细胞贴壁和生长状态并拍照。继续培养至对数生长期,留作后续qPCR和Western blot实验。
另将部分MGCs 和CCs 分别接种至预先放有防脱载玻片的24孔板中,置于37℃、5%CO2的培养箱中培养,(24~48)h 换液1 次,第1 次为半量换液,以后为全量换液。当细胞爬满载玻片的70%时取出载玻片进行HE染色。
3.4 细胞纯度鉴定 采用流式细胞术检测FSHR的表达以进行细胞纯度鉴定。两种细胞每106个细胞孵育10 μL FSHR 流式抗体,涡旋震荡,室温避光孵育30 min,随后300×g离心5 min,弃上清后加入2 mL PBS 重悬,洗涤1 次。再加入2 mL 红细胞裂解液,室温避光孵育10 min,洗涤2 次。然后加入200~400 μL PBS,重悬于FACS 流式管中,置于流式细胞仪上检测。实验重复3次。
3.5 LC3、P62 和Bax mRNA 的qPCR 检测 收集对数生长期的MGCs和CCs,根据高纯总RNA快速提取试剂盒(离心柱型)使用说明抽提总RNA,根据逆转录试剂盒步骤进行逆转录反应,依次在PCR 反应管中加入20 反应体系,包括ddH20 7.4 μL,SYBR 10 μL,逆转录产物1 μL,引物1.6 μL,于PCR 仪上反应,反应条件为:94℃10 s,60℃15 s,72℃12 s,总共40个循环。所有样本均按3个复孔加样。引物序列见表1。
3.6 LC3、P62 和Bax 蛋白的Western blot 检测 每个样品根据细胞数量分别加入20~50 μL 含苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的RI⁃PA 裂解缓冲液,用BCA 法检测蛋白浓度。每孔上样量20 μg,在15%(LC3)或12%(P62、Bax)SDSPAGE 中分离,随后转移到聚偏二氟乙烯(polyvinyli⁃dene fluoride,PVDF)膜上(LC3 采用0.22 μm PVDF膜,P62、Bax采用0.45 μm PVDF膜)。将PVDF膜在5%脱脂奶粉溶液中室温浸泡1 h,置于含有内参抗体、目的抗体的盒子中4℃孵育过夜(抗体稀释比例如 下:LC3 为1∶500,P62 为1∶1 000,Bax 为1∶1 000,GAPDH 为1∶1 000)。用1×TBST 洗涤后,将膜与Ⅱ抗(稀释1∶50 000)室温下放置1 h,1×TBST洗膜3次,超敏发光液曝光显色及拍照。
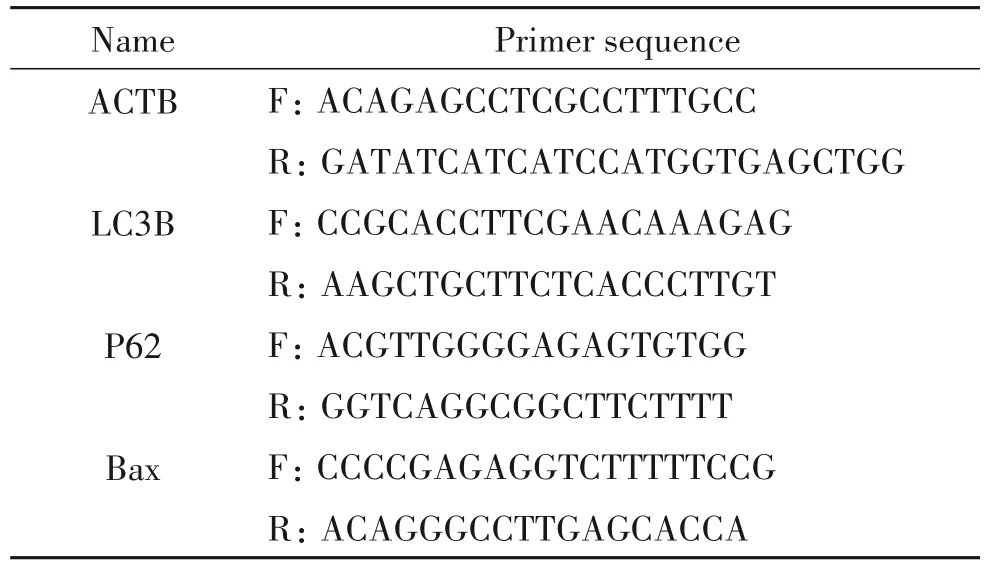
表1 qPCR引物序列Table 1.Sequences of the primers for qPCR
4 统计学处理
细胞分离与培养实验重复3 次。qPCR 数据用LightCycler 480 软件进行分析,采用相对定量法比较2−ΔΔCt的值;Western blot应用ImageJ 1.48图像处理软件进行灰度分析。使用SPSS 20.0进行统计学分析,结果用均数±标准差(mean±SD)表示,采用两独立样本t检验进行均数间比较。以P<0.05 为差异有统计学意义。
结 果
1 MGCs和CCs的分离耗时、细胞总数及存活率
CCs 的分离耗时少于MGCs,分离结束时的存活率高于MGCs,但细胞总数少于MGCs(P<0.05)。见表2。

表2 MGCs和CCs的分离情况比较Table 2.The comparison of isolation parameters between MGCs and CCs(Mean±SD.n=16)
2 MGCs和CCs的细胞纯度
使用流式细胞术检测FSHR 的表达进行细胞纯度鉴定,分离后CCs 与MGCs 的FSHR 表达量分别为(92.23±2.66)%和(81.33±6.57)%,差异具有显著性(P<0.05)。流式细胞术分析图见图1。
3 MGCs和CCs体外原代培养的生长状态
HE 染色可见MGCs 和CCs 生长状态良好,细胞形态呈类成纤维细胞状,细胞伪足延展,相互连接;细胞核蓝染,圆形,核仁明显;胞质透亮呈淡红色,可见丰富的黑色颗粒分布,见图2。培养48 h 后,光镜下可见细胞单层贴壁生长,呈梭形或星形,伪足呈丝状突起,CCs 比MGCs 的细胞外观更纯净,细胞体积更大,伸展状态更佳,见图2。
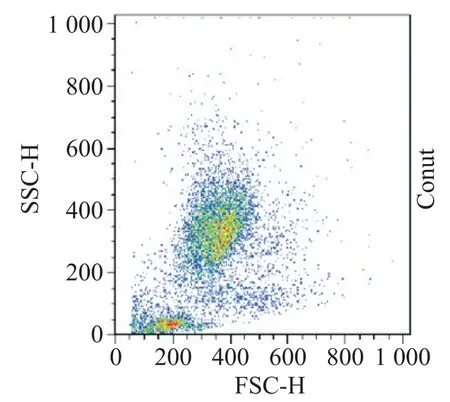
Figure 1.FSHR expression of MGCs and CCs after isolation.图1 分离后MGCs和CCs的FSHR表达量
4 LC3、P62、Bax在MGCs与CCs中的mRNA表达水平
CCs 的LC3 mRNA 表达水平显著低于MGCs(P<0.01),Bax 的mRNA 表达水平显著高于MGCs(P<0.05),CCs 与MGCs 的P62 mRNA 表达水平比较,没有显著差异(P>0.05)。见图3。
5 LC3、P62 和Bax 蛋白在MGCs 与CCs 中的表达水平
CCs 的LC3-Ⅱ/Ⅰ水平显著低于MGCs(P<0.01),Bax 蛋白表达水平显著高于MGCs(P<0.05),CCs 与MGCs 的P62 蛋白表达水平比较,没有显著差异(P>0.05)。见图4。
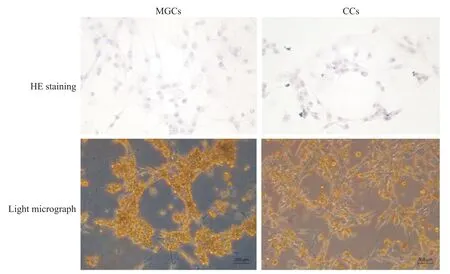
Figure 2.The growth status of MGCs and CCs primary cultured in vitro.HE diagrams of cells climbing 70% of glass slide and light micrograph of cells after primary culture for 48 h were showed(scale bar=200 μm).图2 MGCs和CCs体外原代培养的生长状态
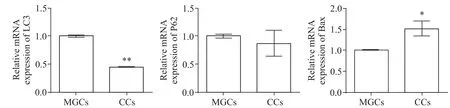
Figure 3.The relative mRNA expression of LC3,P62 and Bax in MGCs and CCs.Mean±SD.n=16. *P<0.05,**P<0.01 vs MGCs.图3 MGCs和CCs的LC3,P62,Bax mRNA表达水平
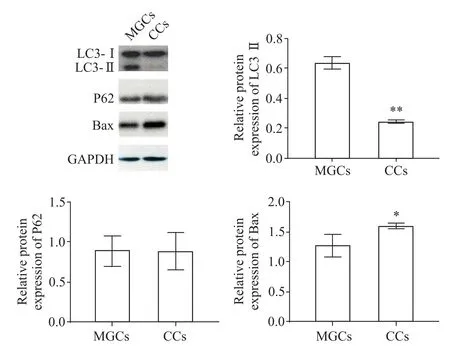
Figure 4.The protein expressions of LC3,P62 and Bax in MGCs and CCs.Mean±SD. n=3. *P<0.05,**P<0.01 vs MGCs group.图4 MGCs和CCs的LC3、P62和Bax蛋白表达水平
讨 论
颗粒细胞是卵泡中最大的功能细胞群,它以自分泌和旁分泌参与卵母细胞发育、成熟[7],与卵母细胞生殖生理有着密切联系。MGCs 和CCs 是颗粒细胞的两个亚群,借助于MGCs和CCs的研究可以增进卵巢功能内分泌调控的认识。故此,有必要对MGCs和CCs的细胞模型进行充分评价。
以往实验评价了多种人卵巢MGCs 的分离和提纯方法,包括密度梯度离心法、裂解法和沉淀法等,但都不可避免出现分离耗时长、细胞纯度低等问题[8],直接影响了细胞体外状态及模型的效果。在本实验,我们采用机械切割法+酶解法分离CCs,分离耗时显著少于密度梯度离心法分离MGCs。成熟卵子周围的卵丘细胞团主要成分是CCs 和透明质酸等细胞外基质,故此,分离CCs 只需要把卵丘细胞团从卵丘-卵母复合物中切割出来,用胰酶或透明质酸酶把透明质酸消化即可,操作简单,因而耗时少。而密度梯度离心法利用淋巴细胞分离液离心后形成不同的密度梯度,卵泡液中的各种细胞成分根据密度不同分布在离心管内不同层面,从而实现细胞的分离纯化[9-10]。由于分离MGCs 需收集卵泡液,卵泡液量多,要作多个离心管分装进行分离,且加在分离液层上的卵泡液一般约3 mL,否则会影响细胞的沉降速度[11];加上该分离方法需要多次离心,整个操作过程较为繁琐,故分离MGCs耗时较长。
FSHR 特异性表达于颗粒细胞,可用于鉴定颗粒细胞的纯度[12]。在本研究中,应用流式细胞术比较分离后CCs 与MGCs 的FSHR 的表达,结果显示CCs细胞纯度高于MGCs。由于卵泡液成分复杂,含有大量红细胞、少量白细胞和其他成分[13],难以通过离心完全弃去杂质,导致分离后MGCs仍混有其他细胞成分,使细胞纯度降低。此外,密度梯度离心法分离MGCs 需要时间长于CCs 分离法,且MGCs 须经历多次离心洗涤程序,离心力会对细胞造成损伤[14],上述因素可能导致MGCs存活率显著低于机械切割法+酶解法分离CCs,这是应用MGCs 模型须注意的问题;另一方面,相对于从卵泡液可收集到MGCs,CCs 是显微镜下对卵丘-卵母细胞复合物作切割获得,切割出来的CCs 包裹着大量的黏液团,其为细胞外基质成分。为避免黏液团的黏性限制CCs 在体外生长[11],本实验采用胰酶消化。由图2 可见,消化了黏液团后的CCs比MGCs生长的体积更为饱满,伪足伸展性更佳,贴壁更好。MGCs在分离时难分散成单个细胞,培养时细胞容易成团块状生长,限制了其延展,且分离的MGCs 不可避免混有红细胞,红细胞沉降在培养皿底部,影响了细胞的贴壁。因此,在体外培养,CCs比MGCs显示出更好的细胞延展性。
CCs 和MGCs 需经历分离、纯化等一系列人为操作才作为细胞模型用于实验。为了解体外处理后的细胞状态,除了细胞存活率,本研究采用了自噬和凋亡基因的表达变化来进一步了解细胞特性。LC3 是自噬延伸阶段的重要泛素化蛋白,其数量和自噬体的数量呈正相关,是分析自噬强弱的指标[15];选择性接头蛋白P62可用于评估自噬流的通畅程度[16];Bax是B 细胞淋巴瘤/白血病2(B cell lymphoma/leukemia-2,Bcl-2)家族中的促凋亡蛋白,通常认为它的激活是导致凋亡发生的重要事件[17]。结果表明,CCs 与MGCs 的P62 mRNA 和蛋白表达水平没有显著差异,提示两种细胞的自噬流通畅程度相似;CCs 中LC3 mRNA 和LC3-II/I 的水平显著低于MGCs,而Bax mRNA 和蛋白的表达水平显著高于MGCs,提示在体外培养下,CCs 可能比MGCs 有较低的自噬活性和较高的凋亡活性,这种情况或许与CCs 脱离了卵母细胞有关。在体内,CCs围绕卵母细胞生长,卵丘-卵母复合物形成独特的微环境,CCs的生理功能受卵母细胞分泌因子的调控,卵母细胞分泌因子可保护CCs免于凋亡[18],而CCs 脱离了卵母细胞,失去了卵母细胞分泌因子的调控,有可能使细胞的凋亡活性升高。
综上所述,CCs 比MGCs 分离提纯更高效。机械切割法+酶解法分离CCs 方法简便,收集细胞的纯度高,细胞状态良好,可用于原代培养实验。如需长期体外培养,单独的CCs 可能容易发生凋亡,或需加入卵母细胞分泌因子等模拟CCs 在体内的微环境,以提高CCs体外培养的稳定性。
