FBW7通过促进NOX1降解抑制ox-LDL诱导的颗粒细胞凋亡*
2021-01-06廖凤儿
郭 琴,骆 婕,廖凤儿,陶 莹
(广东药科大学附属第一医院/临床医学院妇产科,广东广州 510080)
据统计,每7 对夫妇中就有1 对发生不孕,且这些不孕病例中有很大一部分病因直接或间接与女性肥胖有关[1]。育龄期肥胖的女性经常会出现月经周期紊乱、排卵障碍、流产风险增加和妊娠时间延迟等生殖功能障碍类疾病[1-2]。另外,育龄期肥胖还是多囊卵巢综合征(polycystic ovary syndrome,PCOS)发病的重要因素之一[3]。约30%~50%的育龄期肥胖女性是PCOS患者,而PCOS患者中肥胖女性占据50%~70%[4]。因此,不管是否PCOS,育龄期肥胖均可导致女性生殖功能障碍,但其中涉及的具体机制尚不完全清楚。
排卵障碍是女性生殖功能障碍的直接原因之一,卵泡发育异常是引起排卵障碍的病理基础,而卵泡发育异常与卵巢颗粒细胞(granulosa cells,GCs)的凋亡调控失常有关[5]。肥胖女性的外周血和卵泡液中存在高水平循环的氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL),高水平的ox-LDL 能导致过量活性氧簇(reactive oxygen species,ROS)生成[6-7]。ROS 生成过多又是GCs损伤的主要危险因素之一[6-8]。体内有多种酶参与了ROS 生成,其中烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinu⁃cleotide phosphate,NADPH)氧化酶(NADPH oxi⁃dase,NOX)是细胞内生成ROS 的主要酶体[9]。在肥胖育龄期女性中,体内的代谢产物是否通过影响NOX 活性来影响卵泡发育和排卵尚不清楚。Shen等[10]的研究发现,含F 框及WD 重复结构域蛋白7(F-box and WD repeat domain containing protein 7,FBW7)能通过抑制高脂饮食诱导的大鼠血管平滑肌细胞中的NOX 活性来降低ROS 的生成。近来研究发现,FBW7 可在肿瘤、动脉硬化和肥胖症等疾病模型中参与调节氧化代谢、葡萄糖代谢和脂质代谢等多种重要的生理学功能[11-13]。而在GCs 中,FBW7 是否通过调节NOX 活性参与肥胖导致的细胞损伤以及涉及的具体机制尚不清楚。因此,本研究旨在探讨FBW7 在ox-LDL 引起的GCs 损伤中的作用及其潜在机制。
材料和方法
1 材料与试剂
胎牛血清和DMEM 培养基购于Gibco;ox-LDL和CCK-8 细胞活力检测试剂盒购于广州奕元生物科技有限公司;Annexin V-FITC/PI 凋亡检测试剂盒购于江苏凯基生物技术股份有限公司;大鼠NOX 活性检测试剂盒和人NOX 活性检测试剂盒购于上海江莱生物科技有限公司;蛋白质合成抑制剂环己酰亚胺(cycloheximide,CHX)和蛋白酶体抑制剂MG132购于Sigma;编码FBW7 的腺病毒载体(Ad-FBW7)、LacZ 载体、pcDNA3.1-NOX1 和pcDNA3.1 购于广州锐博生物科技有限公司;抗FBW7和NOX1抗体购于Abcam;p47phox、p-p47phox、p67phox和p-p67phox抗体购于Cell Signaling Technology;GAPDH 抗体购于Santa Cruz。
2 受试者GCs的收集
收集同意参与本研究的育龄期(22~35岁)女性,并根据PCOS 诊断标准和体质指数(body mass index,BMI),将受试者分为正常体重(18.5 kg/m2<BMI≤25 kg/m2)非PCOS 组、超重(25 kg/m2<BMI<30 kg/m2)非PCOS 组、肥胖(BMI≥30 kg/m2)非PCOS 组、正常体重(18.5 kg/m2<BMI≤25 kg/m2)PCOS 组、超重(25 kg/m2<BMI<30 kg/m2)PCOS 组和肥胖(BMI≥30 kg/m2)PCOS组。本次研究纳入的受试者排除:(1)既往3个月有酒精和药物滥用或依赖;(2)合并严重的心血管、肝肾功能障碍、内分泌、免疫或血液系统疾病;(3)卵巢癌、库欣综合征、甲状腺功能异常、原发性卵巢早衰和药物性高雄激素血症患者。按照文献[14]描述的方法收集受试者的GCs。收集的GCs 直接用于检测FBW7表达、细胞活力和NOX活性。
3 方法
3.1 高脂饮食动物模型的建立与GCs分离 3周龄雌性SPF 级SD 大鼠购自中山大学动物实验动物中心[SCXK(粤)2016-0029],饲养于广东药科大学实验动物中心[SYXK(粤)2017-0125]SPF 级动物房内,大鼠适应性饲养1 周后进行后续造模。大鼠分为标准饮食(standard diet,STD)组和高脂饮食(highfat diet,HFD)组。STD 饲料含15%脂肪、21%蛋白质和64%碳水化合物;HFD 饲料含60% STD 饲料、35%猪油和5%胆固醇。两组大鼠分别饲养4、8、12和16 周后,麻醉,摘取双侧卵巢,去除卵巢表面包膜和周围脂肪组织后,放入DMEM 培养基中,在解剖显微镜下,刺破卵泡,收集GCs并过200目细胞筛,制成3×109/L 密度的细胞悬液接种于细胞培养皿中(含有10%胎牛血清的DMEM 培养基)。HFD 组大鼠GCs直接用于检测FBW7 表达、细胞活力和NOX 活性,STD组大鼠GCs用于后续实验。
3.2 ox-LDL 诱导大鼠GCs 损伤模型 取STD 组大鼠GCs,按照5×107/L 密度接种于96 孔板,然后分别给予终浓度为0、20、40、80 和160 mg/L ox-LDL 处理48 h。处理后的GCs 经CCK-8 细胞活力试剂盒检测细胞的相对活力,筛选ox-LDL最佳作用浓度。
3.3 腺病毒感染大GCs 取STD 组大鼠GCs,按照5×108/L 的密度接种于6 孔板,用Ad-FBW7 或Ad-Lacz 感染(MOI=40)细胞48 h。收集已感染的细胞,再分别用或不用ox-LDL(80 mg/L)刺激细胞48 h。
3.4 pcDNA3.1-NOX1 和pcDNA3.1 转染 取已感染Ad-FBW7 的大鼠GCs,按照5×108/L 密度接种于6孔板,用HiPerFect转染试剂分别辅助转染30 μmol/L的pcDNA3.1-NOX1或pcDNA3.1,48 h后收集细胞。收集已转染的细胞,再分别用或不用ox-LDL(80 mg/L)刺激细胞48 h。
3.5 药物处理 取已感染Ad-Lacz 或Ad-FBW7 的大鼠GCs,用或不用MG132(5 mg/L)处理细胞0.5 h后,再用ox-LDL(80 mg/L)和CHX(10 mg/L)分别刺激细胞0、12、24 和48 h,收集细胞用于Western blot检测NOX1的表达。
3.6 CCK-8 法检测GCs 的活力 取分离的人GCs、大鼠GCs和已处理的大鼠GCs,调整细胞密度为每孔1×104接种于96 孔板,分别培养48 h。待测孔加入10 μL CCK-8 溶液,再孵育2 h。用酶标仪在波长490 nm处测量吸光度(A)值。
3.7 NOX 活性的检测 按照NOX 活性检测试剂盒说明书进行操作,取分离的人GCs、大鼠GCs 和已处理的大鼠GCs,分别以5×107个/mL 的密度接种于96孔板,用NADPH 裂解液冰上超声裂解20 s,然后以12 000×g离心5 min,收集上清。上清孵育光泽精(lucigenin)试剂(5 mmol/L),37℃避光孵育10 min,用光度计(Promega)测定背景的相对光单位(relative light unit,RLU)。然后加入NADPH(100 μmol/L)并反应5 min,再次用光度计测定反应的RLU。用BCA法定量上清中蛋白浓度。NOX 活性表示为单位时间(s)内单位质量(mg)蛋白的RLU。
3.8 Annexin V-FITC/PI 染色测细胞凋亡 取分离的人GCs、大鼠GCs 和已处理的大鼠GCs,跟据An⁃nexin V-FITC/PI 细胞凋亡试剂盒说明书步骤,加入500 μL 结合缓冲液并重悬细胞,然后分别加入5 μL Annexin V-FITC 和PI 染液并避光孵育10 min,流式细胞仪读取激发波长488 nm 和发射波长530 nm 处的荧光强度,并根据流式细胞仪自带软件分析其凋亡率。
3.9 Western blot 检测蛋白的表达 取分离的人GCs、大鼠GCs 和已处理的大鼠GCs,用RIPA 细胞裂解液提取蛋白。蛋白用BCA 法定量为相同浓度后,取等量的蛋白进行SDS-PAGE 分离,并将电泳分离的蛋白电转移到PVDF 膜。随后用含5%脱脂奶粉的TBST 溶液将PVDF 膜在室温中封闭1 h。室温孵育1∶1 000 稀释的I 抗(NOX1、p47phox、p67phox、pp47phox、p-p67phox和GAPDH)2 h 后,用TBST 洗PVDF膜3 次。室温孵育对应的II 抗1 h,用TBST 洗PVDF膜3 次。使用避光ECL 发光液显影。用ImageJ 软件分析条带灰度值。
4 统计学处理
采用SPSS 21.0 软件包对实验数据进行分析。实验数据以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析(one-way ANOVA),再采用SNK-q检验进行两两比较。以P<0.05 为差异有统计学意义。
结 果
1 肥胖抑制GCs的FBW7表达和细胞活力
Western blot 结果显示,在非PCOS 组中,与正常体重非PCOS 组比较,超重或肥胖非PCOS 组GCs 的FBW7 表达均显著降低(P<0.05);在PCOS 组中,与正常体重PCOS 组比较,超重或肥胖PCOS 组GCs 的FBW7 表达也显著降低(P<0.05),提示肥胖能抑制GCs 中FBW7 表达,见图1A。进一步通过CCK-8 实验分析各组GCs 的活力,结果显示,不管是否PCOS患者,肥胖均能抑制GCs 的活力(P<0.05),见图1B。
2 HFD 导致大鼠GCs 的FBW7 表达和细胞活力降低
如图2 所示,与STD 组比较,HFD 能抑制大鼠GCs 的FBW7 表达(图2A)和细胞活力(图2B),差异均有统计学意义(P<0.05)。
3 ox-LDL诱导大鼠GCs损伤并降低FBW7表达
如图3所示,与对照组比较,ox-LDL能抑制大鼠GCs 的FBW7 表达(图3A)和细胞活力(图3B),并促进其凋亡(图3C),差异均有统计学意义(P<0.05)。
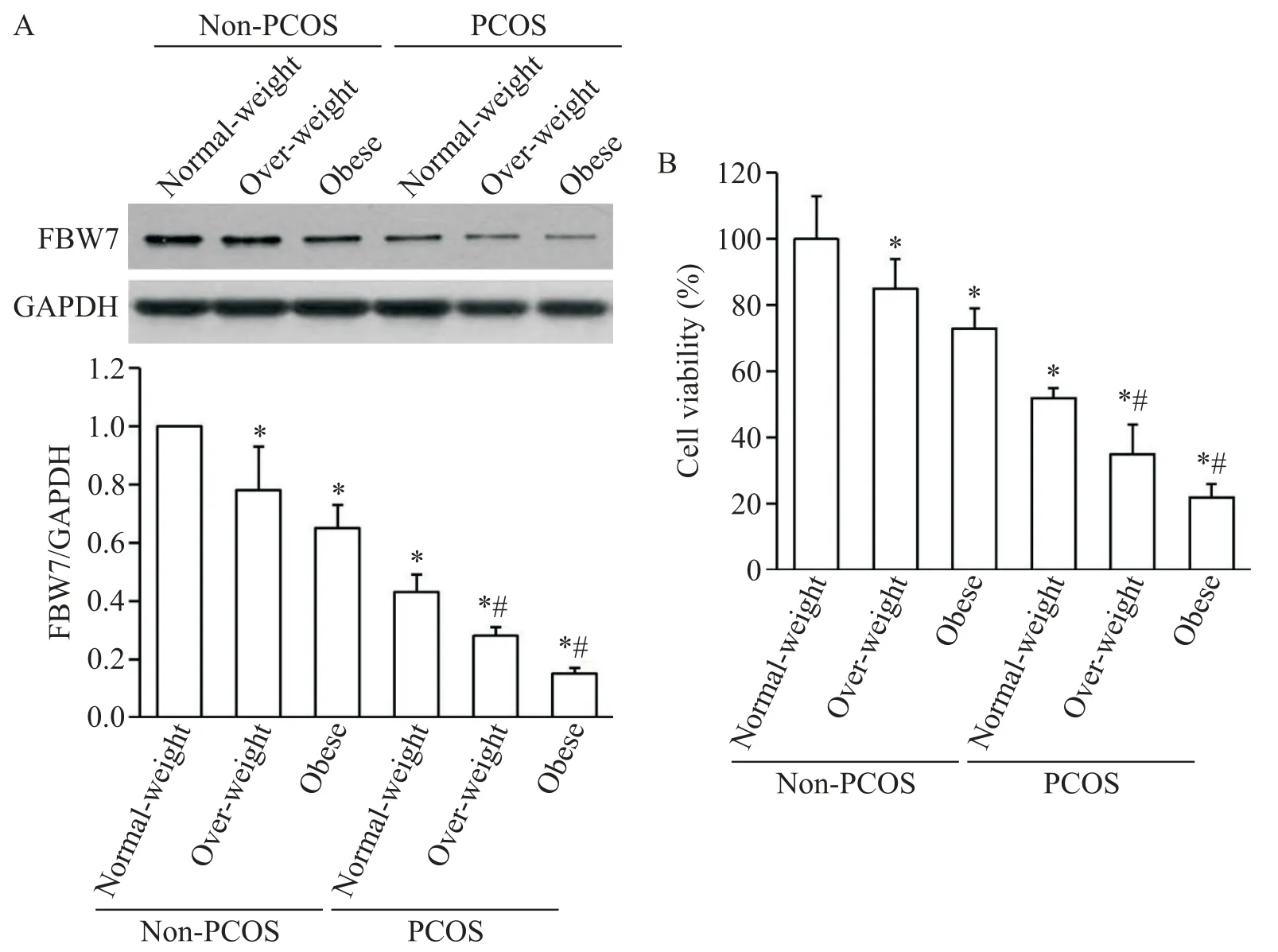
Figure 1.The FBW7 protein expression(A)and the viability(B)of the GCs from women of reproductive age in each group.Mean±SD. n=10.*P<0.05 vs normal-weight non-PCOS group;#P<0.05 vs normal-weight PCOS group.图1 各组育龄期女性GCs中FBW7表达和细胞活力的比较
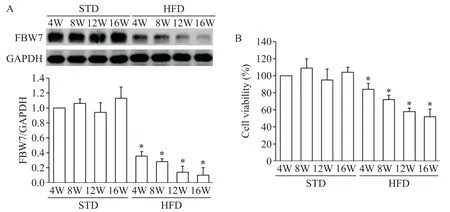
Figure 2.The protein expression of FBW7(A)and the viability(B)of the rat GCs were decreased by high-fat diet(HFD).W:weeks.Mean±SD. n=6.*P<0.05 vs standard diet(STD)group at the same time point.图2 HFD导致大鼠GCs的FBW7表达和细胞活力降低
4 过表达FBW7 减轻ox-LDL 诱导的大鼠GCs损伤
如图4 所示,通过感染Ad-FBW7 方式过表达大鼠GCs 中FBW7 表达(图4A)后,与单纯ox-LDL 刺激组比较,ox-LDL+Ad-FBW7 组GCs 的活力显著增强(图4B),细胞凋亡率显著降低(图4C),差异均有统计学意义(P<0.05)。
5 过表达FBW7 通过促进NOX1 降解来减弱ox-LDL诱导的GCs中NOX活性
首先检测受试者分离的GCs 的NOX 活性,结果显示,不管是否PCOS 患者,肥胖均能显著增强人GCs 中NOX 活性(P<0.05),见图5A。在大鼠模型中,与STD 组比较,HFD 组大鼠GCs 中NOX 活性显著增强(P<0.05),见图5B。在ox-LDL 诱导的大鼠GCs 模型中,与对照组比较,ox-LDL 诱导的大鼠GCs中NOX活性同样显著增强(P<0.05),见图5C。
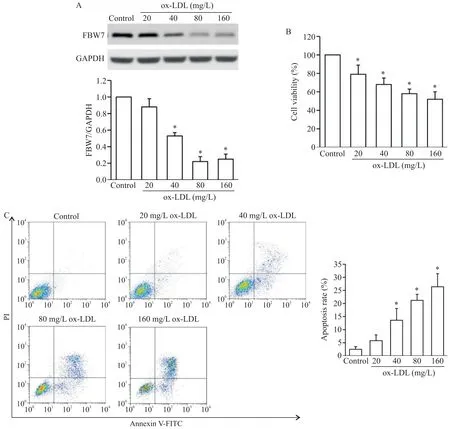
Figure 3.Stimulation with ox-LDL induced the injury of rat GCs and decreased FBW7 protein expression.The GCs isolated from nor⁃mal rats were treated with ox-LDL at concentration range of 20~160 mg/L for 48 h,and then FBW7 expression(A),cell vi⁃ability(B)and apoptosis(C)were detected by Western blot,CCK-8 assay and flow cytometry with Annexin V/PI staining,respectively.Mean±SD. n=4.*P<0.05 vs control group.图3 ox-LDL诱导大鼠GCs损伤并降低FBW7表达
进一步检测过表达FBW7 对ox-LDL 诱导的GCs中NOX 活性的影响,结果显示,与单纯ox-LDL 刺激组比较,ox-LDL+Ad-FBW7 组GCs 中NOX 活性显著降低(P<0.05),见图6A。通过Western blot 检测NOX 关键亚基蛋白表达结果显示,与对照组比较,单纯ox-LDL刺激组GCs的p-p47phox、p-p67phox和NOX1表达均显著增加(P<0.05);而与单纯ox-LDL 刺激组比较,ox-LDL+Ad-FBW7 组仅NOX1 表达显著降低(P<0.05),见图6B~E。CHX 追踪法结果显示,与ox-LDL+LacZ 组比较,ox-LDL+Ad-FBW7 组NOX1 降解显著加快(P<0.05),见图7A。MG132 刺激GCs 结果显示,与ox-LDL+Ad-FBW7 组比较,ox-LDL+Ad-FBW7+MG132 组NOX1 表达明显增加(P<0.05),见图7B。
6 过表达NOX1能逆转过表达FBW7对ox-LDL 诱导的GCs损伤的抑制效应
与ox-LDL+Ad-FBW7+pcDNA3.1 组比较,ox-LDL+Ad-FBW7+pcDNA3.1-NOX1 组大鼠GCs 中NOX1 表达水平显著增高(P<0.05),见图8A,说明FBW7 与NOX1 共过表达构建成功。与ox-LDL+Ad-FBW7 组比较,ox-LDL+Ad-FBW7+pcDNA3.1-NOX1组大鼠GCs 中NOX 活性显著增强(图8B),细胞活力显著降低(图8C),细胞凋亡率显著提高(图8D),差异均有统计学意义(P<0.05)。
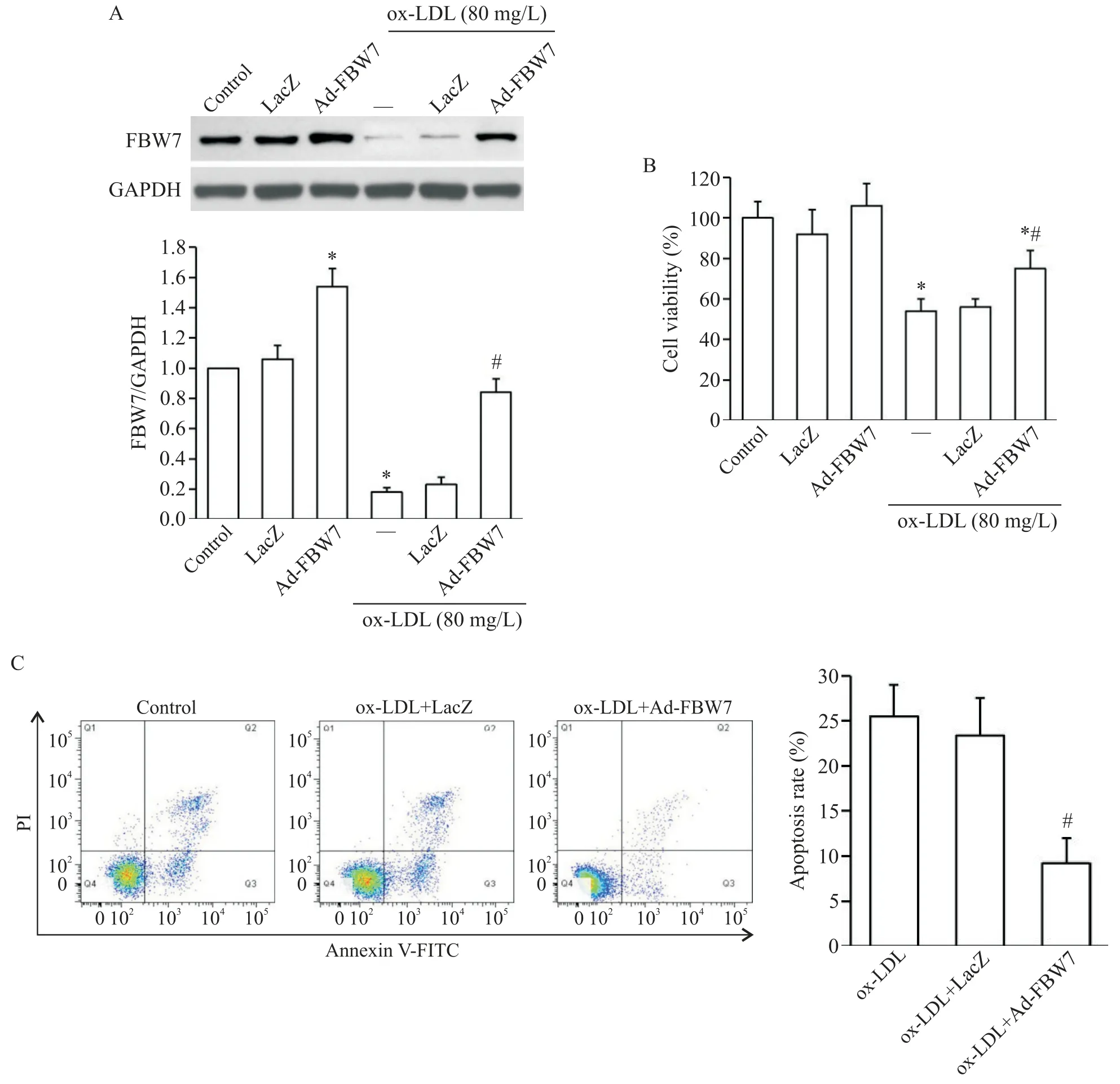
Figure 4.Over-expression of FBW7 attenuated ox-LDL-induced injury of rat GCs.Over-expression of FBW7 in rat GCs was con⁃ducted by infection with Ad-FBW7(MOI=40)prior to ox-LDL stimulation,and the FBW7 expression(A),cell viability(B)and apoptosis(C)were evaluated by Western blot,CCK-8 assay and flow cytometry with Annexin V/PI staining,re⁃spectively.Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs ox-LDL stimulation alone group.图4 过表达FBW7减轻ox-LDL诱导的大鼠GCs损伤
讨 论
肥胖症是一种与血脂异常、胰岛素抵抗和氧化应激等机体代谢因素密切相关的代谢综合征。育龄期女性肥胖不仅能导致机体代谢紊乱,还会导致排卵障碍[1-2]。而肥胖引起育龄期女性排卵障碍的具体机制并不完全清楚。
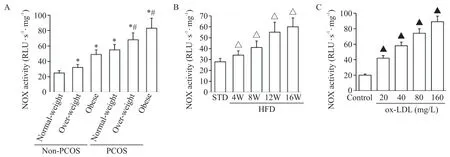
Figure 5.NADPH oxidase(NOX)activity in the GCs isolated from obese women of reproductive age(A),the GCs isolated from high-fat diet(HFD)-fed rats(B),and the ox-LDL-stimulated GCs(C).W:weeks.Mean±SD. n=10 in A;n=6 in B;n=4 in C.*P<0.05 vs normal-weight non-PCOS group;#P<0.05 vs normal-weight PCOS group;△P<0.05 vs standard diet(STD)group;▲P<0.05 vs control group.图5 肥胖育龄女性分离的GCs、HFD喂养大鼠分离的GCs和ox-LDL刺激的GCs中NOX活性
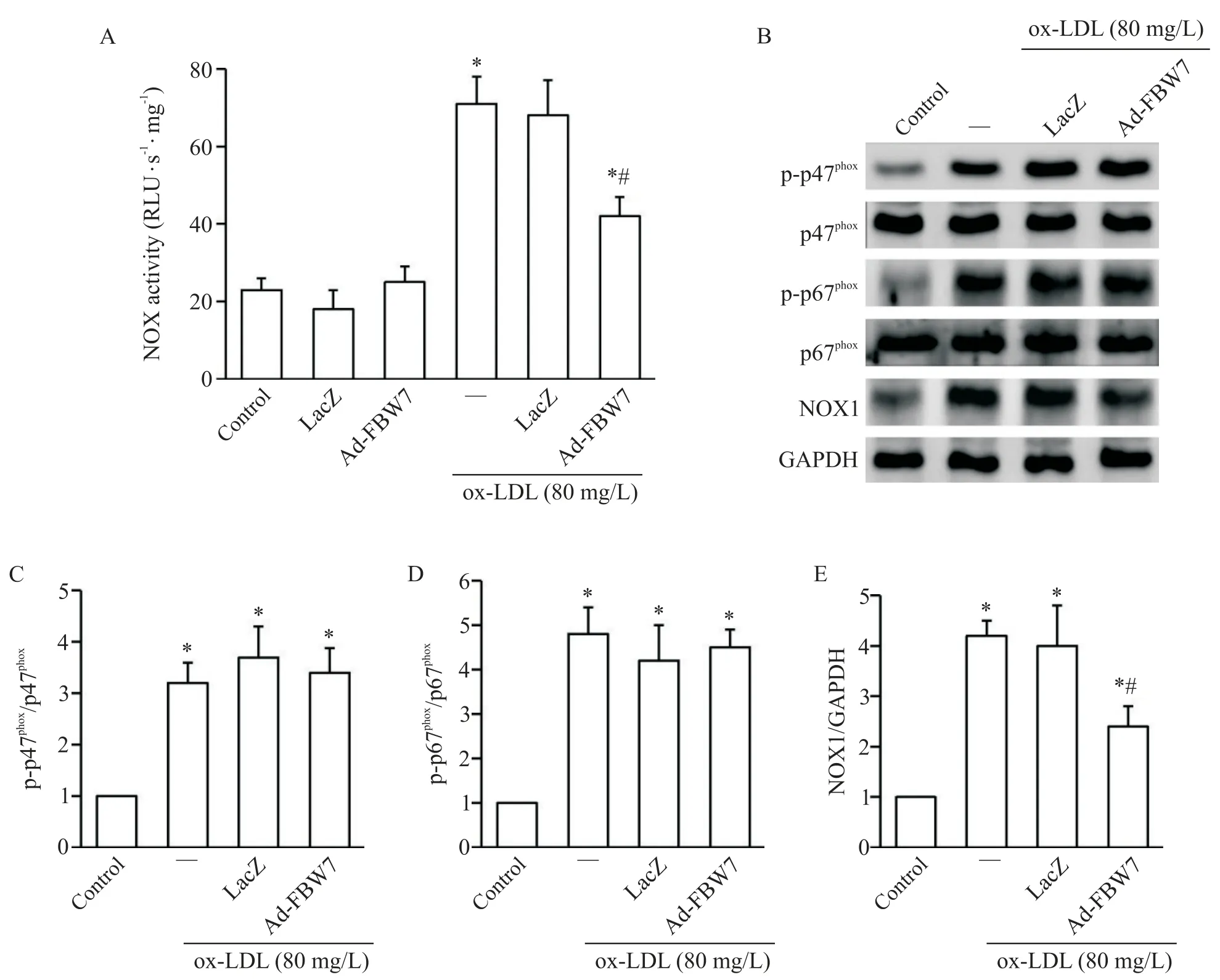
Figure 6.Over-expression of FBW7 attenuated ox-LDL-stimulated NADPH oxidase(NOX)activity through specifically inhibiting NOX1 expression.Over-expression of FBW7 in rat GCs was conducted by infection with Ad-FBW7(MOI=40)prior to ox-LDL stimulation,and the NOX activity(A)and the expression of NOX-related proteins p-p47phox,p-p67phox and NOX1(B~E)in the rat GCs were detected.Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs ox-LDL stimulation alone group.图6 过表达FBW7通过抑制NOX1表达来减弱ox-LDL诱导的NOX活性
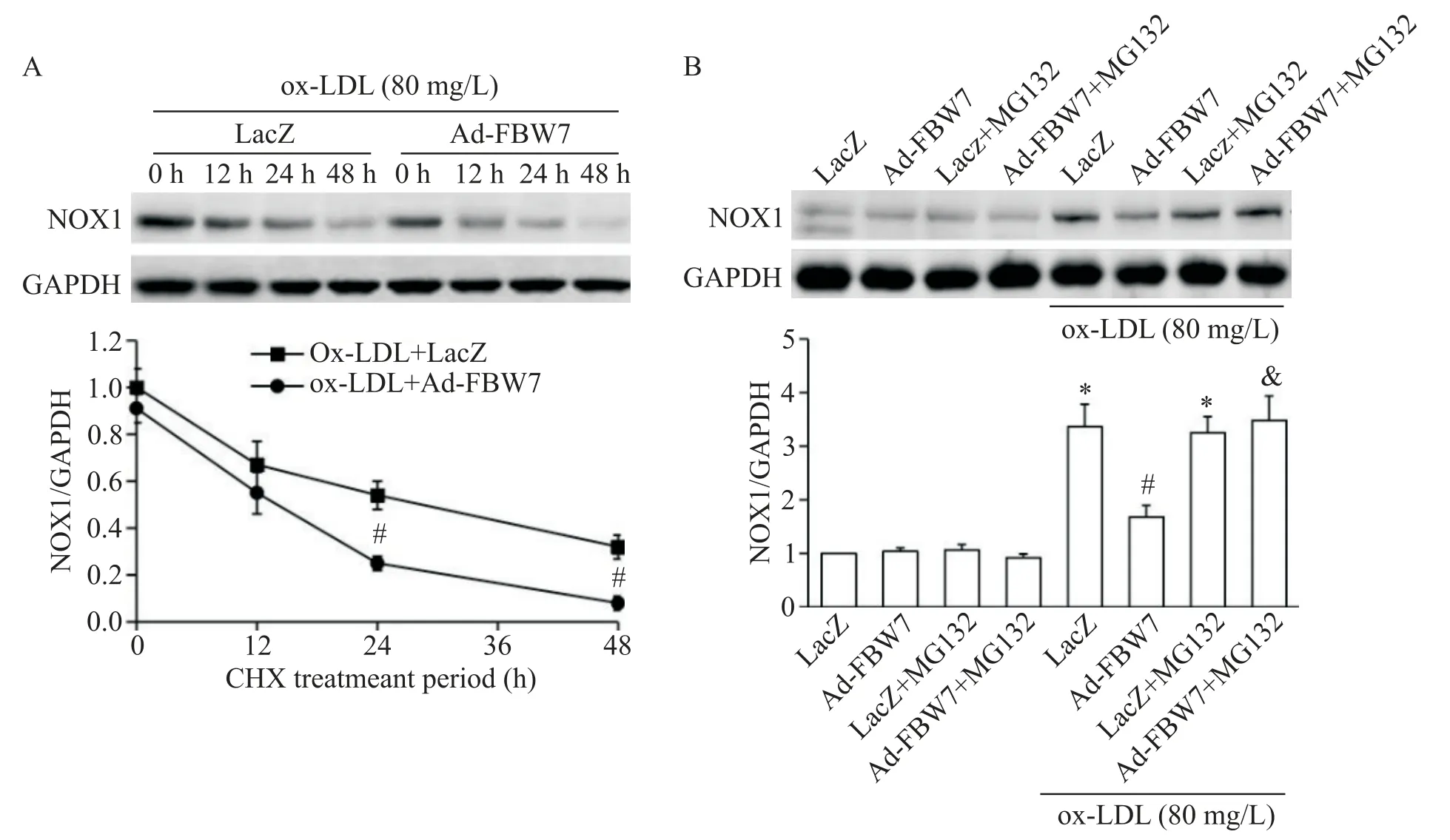
Figure 7.Over-expression of FBW7 accelerated NOX1 degradation in rat GCs under ox-LDL condition.A:the rat GCs were infected with LacZ or Ad-FBW7 prior to ox-LDL stimulation,cycloheximide(CHX)at 10 mg/L was added for the indicated period,and then the NOX1 expression was examined by Western blot;B:the rat GCs were pretreated with MG132 at 5 mg/L for 0.5 h followed by Ad-FBW7 infection in the absence or presence of ox-LDL,and then the NOX1 expression was examined by Western blot.Mean±SD. n=4.#P<0.05 vs ox-LDL+LacZ group;*P<0.05 vs LacZ group;&P<0.05 vs ox-LDL+Ad-FBW7 group.图7 在ox-LDL存在的情况下,过表达FBW7加速大鼠GCs的NOX1降解
卵泡闭锁是排卵障碍的直接原因,而GCs 损伤是引起卵泡发育异常和闭锁主要原因之一[5]。GCs不仅与卵巢中的卵泡膜细胞(theca cells)一起参与卵巢激素的合成和分泌,还能介导卵泡的生长、发育、闭锁和排卵[15]。GCs增殖能促进卵泡发育,而GCs凋亡则会导致卵泡闭锁,尤其是在卵泡发育的后期[15]。已有研究表明,肥胖代谢产物能导致GCs 损伤[7,16]。因此,抑制GCs 损伤可以在一定程度上减轻肥胖导致的排卵障碍。肥胖育龄期女性的体内存在氧化应激和脂代谢异常,氧化应激和脂代谢异常又能加剧不孕症发生风险。此外,氧化应激和血脂异常也与GCs 损伤有关[16-17]。因此,本研究观察不同肥胖程度对育龄期女性GCs 损伤的影响,结果显示,不管是否发生PCOS,肥胖均能导致育龄期女性的GCs 活性降低并伴随降低FBW7 表达。造成肥胖的起源因素众多,但大部分肥胖症病例是由于过度食用高脂肪食物造成的[18]。因此,本研究进一步采用HFD 构建大鼠模型,观察HFD 对GCs 的影响,结果显示HFD 能抑制GCs 活性和FBW7 表达。Liu 等[7]研究提示,肥胖导致卵泡闭锁的可能原因是卵泡液中高水平ox-LDL 导致的GCs 氧化损伤。本研究进一步用ox-LDL在体外模拟了肥胖背景下的GCs 损伤模型,结果同样显示,ox-LDL 能浓度依赖性抑制FBW7 表达。基于以上结果,我们推测FBW7 可能参与肥胖导致的GCs 损伤。为验证我们的猜想,本研究在ox-LDL 诱导的GCs 模型中证明了过表达FBW7 能通过降低细胞凋亡水平来减轻ox-LDL诱导的GCs损伤。这一结果在一定程度上证明FBW7 参与调节肥胖导致的排卵障碍。
本研究进一步探讨FBW7 参与调节ox-LDL 导致GCs 损伤的机制。尽管肥胖症的代谢产物能通过多种途径导致GCs 损伤,但氧化应激在GCs 的凋亡中起关键作用[6-7,16-17]。ox-LDL 能通过诱发GCs 中ROS过量生成进而导致GCs 氧化损伤[7]。NOX 是细胞内ROS 的主要来源[9]。在HFD 诱导的肥胖症和动脉硬化症模型中,FBW7 能通过降低NOX 活性来降低细胞内ROS 的生成[11,13]。在本研究中,我们同样发现过表达FBW7 能降低GCs 中NOX 活性。为解释FBW7 如何调节NOX 活性,我们进一步检测了NOX的关键亚基蛋白表达。本研究结果显示,过表达FBW7 对ox-LDL 诱导的p-p47phox和p-p67phox表达无明显影响,但抑制ox-LDL 诱导的NOX1 表达。这一结果提示FBW7 可能通过抑制NOX1 表达来抑制ox-LDL 诱导的NOX 活性。众所周知,FBW7 能通过介导底物蛋白的降解来广泛参与细胞的多种生物学功能[11-13]。为解释过表达FBW7导致NOX1表达降低的原因,本研究用CHX 追踪法研究了过表达FBW7 对NOX1 稳定性的影响,结果显示,在ox-LDL 刺激条件下,过表达FBW7能加速NOX1的降解。NOX家族的亚型蛋白可通过蛋白酶体降解途径快速降解[19]。本研究结果显示,在ox-LDL 刺激条件下,蛋白酶体抑制剂MG132 能恢复Ad-FBW7 导致的NOX1 表达下调。另外,外源性引入pcDNA3.1-NOX1 能逆转Ad-FBW7 对ox-LDL 诱导的GCs 损伤的抑制效应。以上结果说明,在ox-LDL 刺激条件下,过表达FBW7通过蛋白酶体降解途径促进NOX1 降解,从而降低NOX活性,减轻GCs损伤。
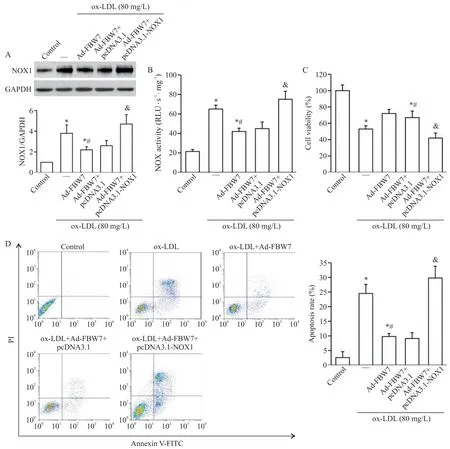
Figure 8.Over-expression of NOX1 reversed the inhibitory effect of over-expression of FBW7 on ox-LDL-induced injury of GCs.After co-transfected with Ad-FBW7 and pcDNA3.1-NOX1 prior to ox-LDL stimulation,the NOX1 expression(A),NOX activity(B),cell viability(C)and apoptosis(D)in rat GCs were examined.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs ox-LDL stimulation alone group;&P<0.05 vs ox-LDL+Ad-FBW7 group.图8 过表达NOX1能逆转过表达FBW7对ox-LDL诱导的GCs损伤的抑制效应
综上所述,本研究表明过表达FBW7 可通过加快NOX1 降解,进而减弱NOX 活性来减轻ox-LDL 导致的GCs 损伤。另外,本研究结果还提示,上调FBW7 表达可能是肥胖症诱发的排卵障碍类疾病的一个潜在治疗策略。
