坏死性小肠结肠炎早产儿肠组织差异性表达nesfatin-1及机制探讨*
2021-01-06李艳红王晓君
邱 红,李艳红,王晓君,吕 勤
(宁波市妇女儿童医院,浙江宁波 315000)
目前,坏死性小肠结肠炎(necrotizing enterocoli⁃tis,NEC)仍然是构成新生儿死亡率及患病率增加的主要原因[1]。NEC 严重影响消化系统功能,甚至引起休克、酸中毒等症状[2]。由于缺乏可靠的和可预测的生物标记物,加上缺乏有效的治疗,NEC 仍是导致早产婴儿疾病的严重问题,阐明NEC 发病相关基因的潜在作用具有重要意义。摄食调节肽nesfa⁃tin-1 是一种来源于核结合蛋白2 的82 个氨基酸多肽,其在胃肠道、胰腺和内分泌腺中表达,在调节食物摄入、能量/葡萄糖稳态和肠道运动中发挥重要作用[3-4]。除了在创伤性脑损伤、蛛网膜下腔出血和睾丸损伤中的抗炎和抗凋亡作用外,还有研究报道了nesfatin-1通过直接抗炎机制在胃和结肠中发挥保护作用[5]。然而nesfatin-1在NEC 胃肠道损伤中的影响尚未见报道。Toll 样受体4(Toll-like receptor 4,TLR4)属于TLR 家族,在免疫炎症反应中起着关键作用[6]。缺氧、手术、感染和其他应激因素触发TLR4级联并激活核因子κB 信号通路,提高趋化因子和炎症因子的表达[7]。阻断TLR4 介导的炎症反应有助于防止胃肠炎发生[8]。尽管nesfatin-1 已被报道抑制结肠炎中TLR4 信号激活[9],但其对NEC 的影响在很大程度上是未知的。在本研究中,我们检测了在NEC 组织和LPS 诱导的肠细胞中nesfatin-1的表达水平,并评估了nesfatin-1 对免疫应答及对免疫应答的影响及其潜在机制。
材料和方法
1 材料
胎牛血清购自Gibco;DMEM/F-12 培养基购自HyClone;Lipofectamine 2000 购自Invitrogen;白细胞介素6(interleukin-6,IL-6)、IL-10 和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的ELISA试剂盒购自Abcam;Trizol试剂、RNA PCR试剂盒和SYBR Green I购自TaKaRa;StepOne Plus 实时荧光定量PCR 系统购自Applied Biosystems;RIPA裂解缓冲液购自Solar⁃bio;BCA 试剂盒购自Pierce;抗nesfatin-1、TLR4、NLRP3、caspase-1、黑色素瘤缺乏因子2(absent in melanoma-2,AIM2)、含CARD 的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和GAPDH 单克隆抗体均购自Abcam;HRP 标记的Ⅱ抗购自Boehringer;ECL 购自Luminata Forte;Protein A/G购自Abcam。
2 方法
2.1 组织样本采集 2017~2019年间,从在本院接受NEC 肠道手术的20 例早产儿中获得了小肠组织。早产儿(男孩12 例和女孩8 例)的平均胎龄为30.3±1.9 周,出生体重为1202±119 g。NEC 的诊断标准参照《实用新生儿学》[2],即:常以腹胀、便血为首发表现,可伴有呕吐、腹泻及全身症状,X 线肠壁囊样积气或门脉积气征为特征性表现。手术切除后立即采集组织样本,并将其保存在−80℃下。
2.2 细胞培养 人胎正常结肠上皮细胞HCoEpiC和人结肠癌细胞Caco-2 购自中国科学院细胞中心,接种在含有10%胎牛血清的DMEM/F-12 培养基中。HCoEpiC 细胞和Caco-2 细胞以5×107/L 接种于96 孔板中,加入100 μg/L 的LPS 处理30 min,建立肠细胞的NEC模型。
2.3 转染实验 当肠上皮细胞培养至70%~80%汇合后,使用Lipofectamine 2000 将nesfatin-1 过表达载体及其阴性对照载体,以及pcDNA-TLR4(均由上海吉玛制药技术有限公司合成)转染细胞。将所有转染的细胞培养48 h,然后进行不同的测定。Western blot检测nesfatin-1的表达确定转染效率。
2.4 ELISA检测炎症因子的浓度 使用ELISA试剂盒检测细胞中IL-6、IL-10和TNF-α的相对表达水平。通过分光光度法测定450 nm 处吸光度(A)。根据标准曲线计算炎症因子浓度。
2.5 RT-qPCR 分析 使用Trizol试剂从小肠组织或细胞中提取总RNA。使用RNA PCR试剂盒将总RNA反转录为cDNA,然后使用StepOnePlus实时荧光定量PCR 系统进行实时定量PCR。PCR 反应混合物使用SYBR Green I、cDNA 和引物。使用常规2−ΔΔCt法计算目的基因的表达变化。TNF-α的上游引物序列为5′-CGCCTCACCTGACCTACC-3′,下游引物序列为5′-TTGCCTCGTTCTGGACTATAC-3′;IL-6 的上游引物序列为5′-CACCTATGCCACCCTTATCC-3′,下游引物序列为5′-CGAACATGCGAGTAAACCAA-3′;IL-10 的上游引物序列为5′-ATGCTGCCTGCTCTTACT⁃GACTG-3′,下游引物序列为5′-CCCAAGTAACCCT⁃TAAAGTCCTGC-3′;nesfatin-1的上游引物序列为5′-CCTATGCCCTAAGAAACCCC-3′,下游引物序列为5′-GAAGCAGTTTGGGACCCCTT-3′;TLR4的上游引物序列为5′-ACCTGTCACTGTCTTGTACCCTTGT-3′,下游引物序列为5′-CGGCGTTTGGAGTGG⁃TAGAA-3′;GAPDH的上游引物序列为5′-AGCAAT⁃GCCTCCTGCACCACCAAC-3′,下游引物序列为5′-CCGGAGGGGCCATCCACAGTCT-3′。
2.6 Western blot 分析 用RIPA裂解缓冲液裂解肠细胞。通过BCA 法测定蛋白浓度。在100℃下用加载缓冲液将裂解物变性5 min,然后在SDS-PAGE(12%)上加载相同的蛋白质并转移到PVDF 膜上,用阻断剂消除非特异性染色。这些膜用Ⅰ抗[nesfatin-1(1∶1 000)、TLR4(1∶1 000)、NLRP3(1∶1 000)、cas⁃pase-1(1∶1 000)、AIM2(1∶1 500)、ASC(1∶1 000)和GAPDH(1∶1 000)]在4℃封闭过夜。然后用PBS 洗涤,并用HRP标记的II抗和ECL孵育观察目标条带。
2.7 免疫共沉淀实验 用RIPA 裂解缓冲液对HCoEpiC 细胞进行裂解。用PBS 稀释Protein A/G-琼脂糖至50%的工作浓度。然后将溶液加入样品(100 mL/L)中,在4℃下摇匀10 min。14 000×g离心10 min 后,收集上清液转移至新离心管中。用BCA法测定蛋白质浓度。加入兔抗nesfatin-1 IgG 抗体或对照兔IgG 室温孵育2 h,分别加入Protein A/G(1∶50)10 μL 孵育1 h。离心收集沉淀进行电泳并对TLR4蛋白进行Western blot分析。
3 统计学处理
数据用平均值±标准差(mean±SD)表示。用t检验法比较组织标本和肠上皮细胞中nesfatin-1 的表达。采用双向方差分析法分析nesfatin-1对炎症的影响。P<0.05为差异具有统计学意义。
结 果
1 在NEC 组织和LPS 诱导的肠细胞中nesfatin-1的mRNA表达下调
如图1A 所示,NEC 早产儿组织中nesfatin-1的表达明显低于健康组(P<0.01)。此外,与对照组相比,LPS 诱导的肠上皮HCoEpiC 细胞和HT-29 细胞中的nesfatin-1表达降低(P<0.01),见图1B。
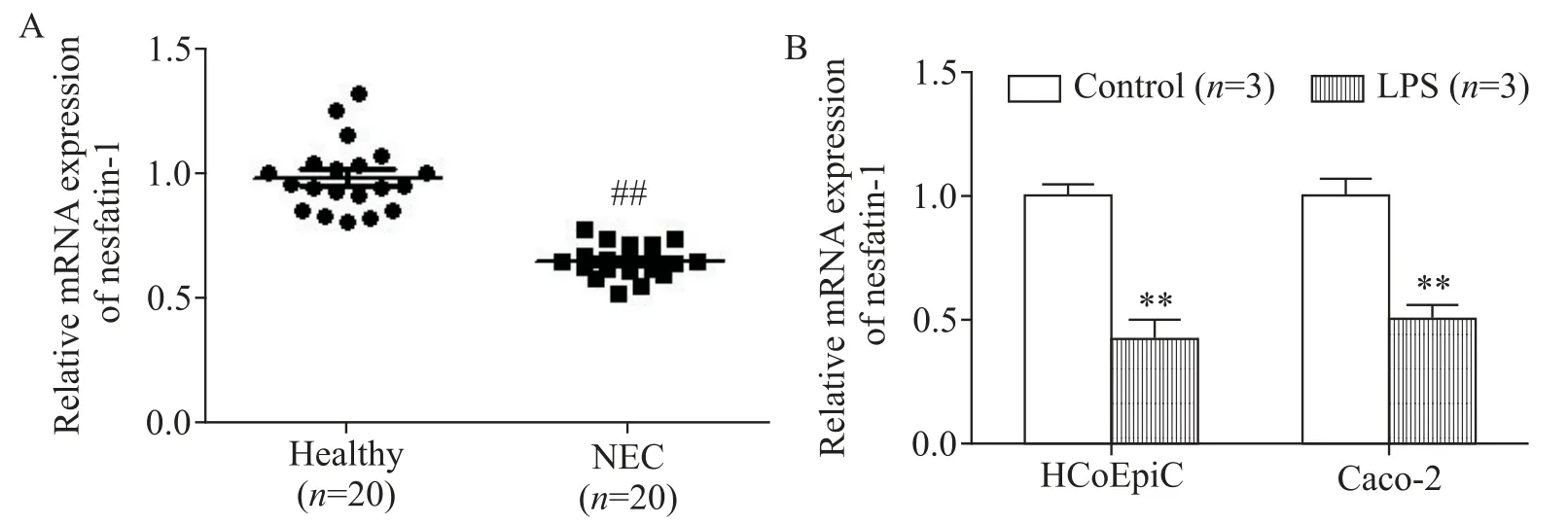
Figure 1.The mRNA expression of nesfatin-1 was detected in NEC tissues(A)and LPS-induced intestinal epithelial cells(B).The mRNA expression of nesfatin-1 was detected by RT-qPCR.Mean±SD.##P<0.01 vs healthy group;**P<0.01 vs control group.图1 在NEC患儿组织和LPS诱导的肠上皮细胞中检测nesfatin-1的mRNA表达水平比较
2 nesfatin-1 减弱LPS 刺激肠细胞中炎症因子和相关蛋白的表达
为了确定nesfatin-1 对炎症因子的影响,研究检测了LPS 刺激肠细胞中TNF-α、IL-10、IL-6 和NLRP3的表达。分别用阴性对照(NC)和pcDNA-nesfatin-1(nesfatin-1)转染细胞,然后用100 μg/L 的LPS 刺激,通过Western blot 分析显示,与NC 转染组相比,nes⁃fatin-1 转染组中nesfatin-1 蛋白表达显著提高(P<0.05),并且LPS 刺激显著降低nesfatin-1 蛋白的表达(P<0.05),而nesfatin-1 转染逆转了LPS 的刺激作用(图2A、B)。ELISA 结果表明,nesfatin-1 的过表达降低了TNF-α 和IL-6 的水平(P<0.05),并增加了IL-10的水平(P<0.05),见图2C~E。此外,在HCoEpiC 细胞和HT-29 细胞中,nesfatin-1 转染抑制了NLRP3、AIM2、caspase-1和ASC的表达(图2F)。
3 nesfatin-1与TLR4的交互作用
本研究中,TLR4 在NEC 组织样本中的表达明显高于健康婴儿(P<0.05),见图3A。Pearson相关分析表明,nesfatin-1 和TLR4 之间存在显著负相关(r=−0.816,P<0.01),见图3B。nesfatin-1 转染逆转了LPS 诱导的HCoEpiC 细胞和Caco-2 细胞中TLR4 蛋白的表达增加(P<0.05),见图3C。此外,通过免疫沉淀发现TLR4与nesfatin-1能够在细胞内共沉淀,见图3D。
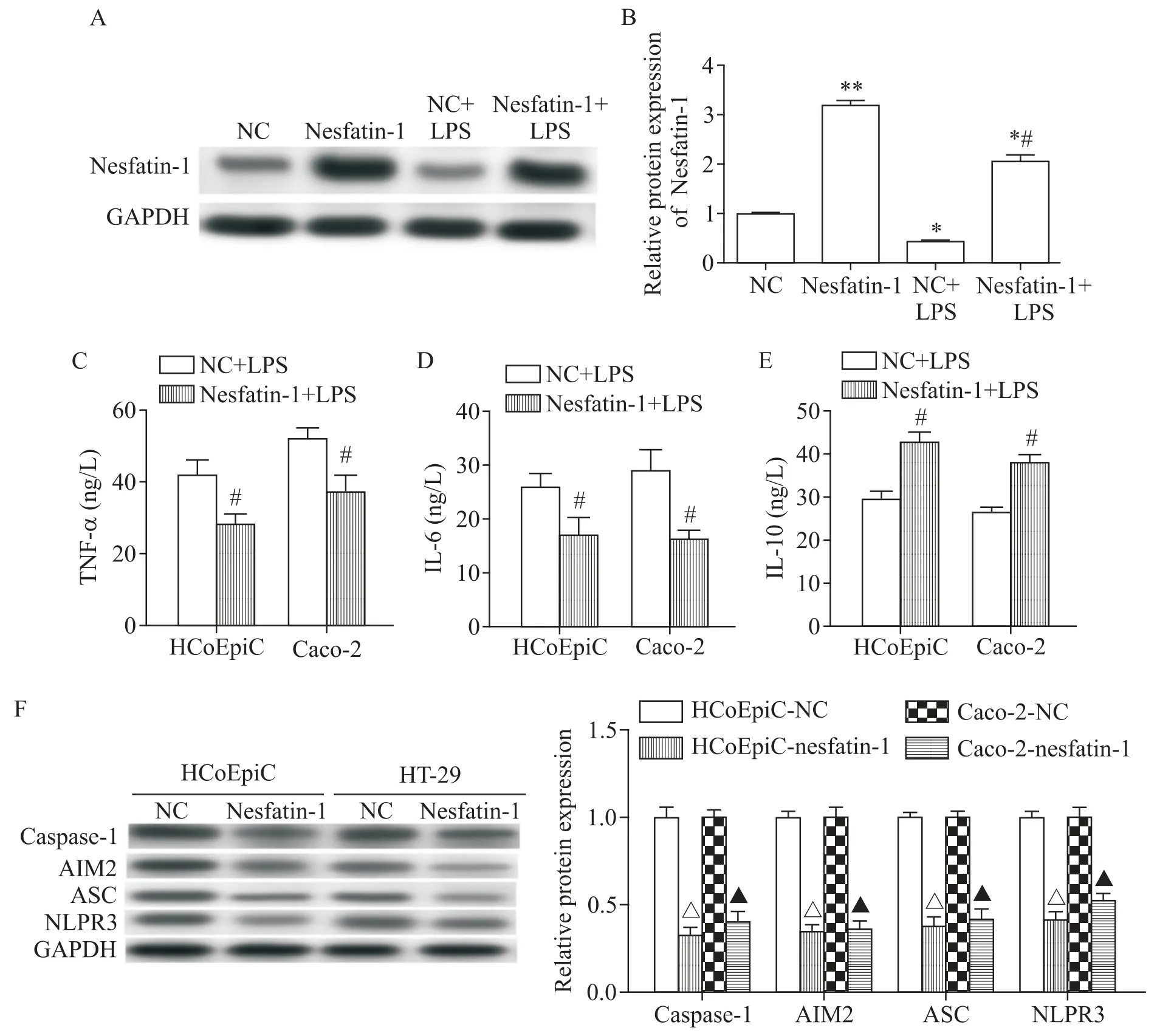
Figure 2.Nesfatin-1 inhibited the expression of inflammatory factors and related proteins in the HCoEpiC cells and Caco-2 cells with LPS stimulation.A and B:over-expression efficiency of nesfatin-1 was investigated by Western blot;C~E:ELISA was used to measure the contents of TNF-α,IL-6 and IL-10 in the HCoEpiC cells and Caco-2 cells;F:the protein expression of NLRP3,AIM2,caspase-1 and ASC was investigated by Western blot.Mean±SD. n=3.*P<0.05 vs NC group;#P<0.05 NC+LPS group;△P<0.05 vs HCoEpiC-NC group;▲P<0.05 vs Caco-2-NC group.图2 nesfatin-1抑制LPS刺激下HCoEpiC细胞和HT-29细胞炎症因子和相关蛋白的表达。
4 TLR4逆转nesfatin-1对炎症反应的影响
进一步分析了TLR4 在HCoEpiC 细胞炎症反应中的作用。用特异性质粒载体转染HCoEpiC 细胞,转染48 h后采集标本,用RT-qPCR法测定IL-6、IL-10和TNF-α 的mRNA 水平,Western blot 检测NLRP3、AIM2、caspase-1 和ASC 的蛋白水平。结果表明,TLR4 转染促进LPS 诱导的HCoEpiC 细胞IL-6 和TNF-α 的表达(P<0.05),并消除了nesfatin-1 对HCo⁃EpiC 细胞IL-10 表达的增强作用(P<0.05),见表1。此外,TLR4 的过表达进一步促进了LPS 诱发的NL⁃RP3 升高,并逆转了nesfatin-1 对NLRP3、AIM2、cas⁃pase-1和ASC蛋白水平的抑制作用,见图4。
讨 论
随着新生儿重症监护技术的发展,早产儿的存活率明显提高,然而这些新生儿的NEC 发病率也相应上升[10]。NEC 的发病机制,包括从轻度炎症到肠坏死并多器官功能衰竭,目前尚不清楚。在重症监护期间,缺血、缺氧和缺乏母乳喂养,破坏了已经不成熟的肠道屏障,氧化应激、感染与炎症反应产生或释放的氧自由基、炎性细胞因子活化与NEC 明显相关[11]。因此,大量关于NEC 预防和治疗的研究集中于增强抗炎防御和限制炎症损伤药物的应用[12]。nesfatin-1 是细胞因子信号转导的关键调节因子,在细胞免疫应答和炎症性疾病中发挥作用[3]。王鼎元等[13]研究表明,nesfatin-1 对巨噬细胞的自身免疫炎症有负调节作用。此外,nesfatin-1 被认为是胃肠道炎症的重要介质[14]。胃上皮细胞nesfatin-1基因敲除促进胃炎的发生[3];而nesfatin-1 的过度表达提高了结肠上皮细胞的伤口愈合能力,并降低了溃疡性结肠炎的病变风险[4]。本研究结果证实Nesfatin-1 在NEC 婴儿组织样本和LPS 诱导的肠细胞中下调,并减轻NEC的作用。
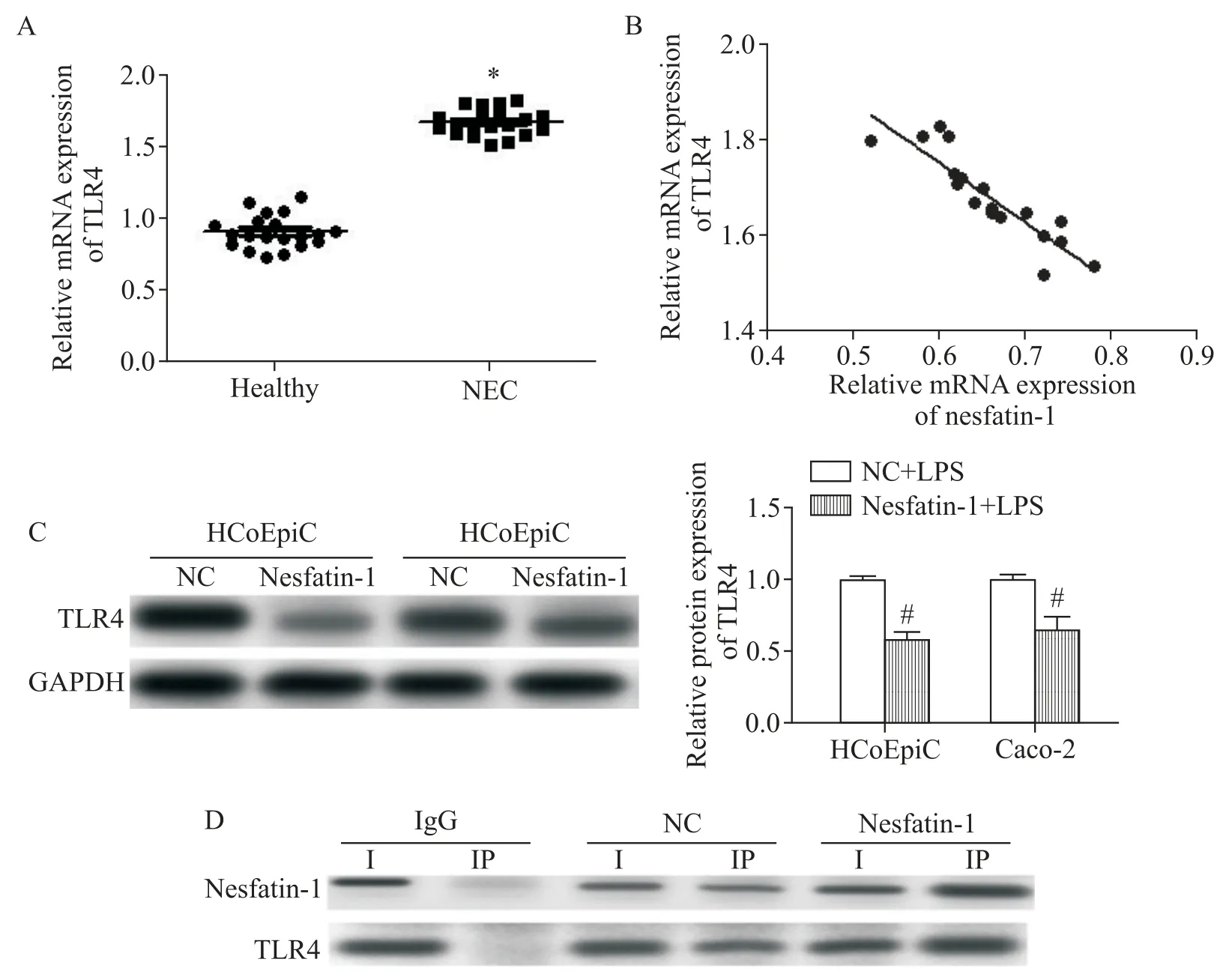
Figure 3.Nesfatin-1 interacted with TLR4.A:the mRNA expression of TLR4 in intestinal epithelial cells was detected by RTqPCR;B:the relation between nesfatin-1 and TLR4 was determined by Pearson analysis in the intestinal epithelial cells;C:the cells were transfected with NC or nesfatin-1,and then the protein expression of TLR4 in HCoEpiC cells and Caco-2 cells was detected by Western blot;D:the images of co-immunoprecipitation assay showed nesfatin-1-TLR4 interaction.Mean±SD. n=3.*P<0.05 vs healthy group;#P<0.05 vs NC+LPS group.图3 nesfatin-1与TLR4交互作用的验证

表1 TLR4逆转了nesfatin-1对肠细胞炎症反应的影响Table 1.TLR4 reversed the effect of nesfatin-1 on intestinal inflammatory responses(Mean±SD. n=3)
nesfatin-1 在各种胃肠道疾病中异常表达,可通过靶向多种转录因子介导免疫应答[4]。Xia 等[15]研究证实血浆nesfatin-1 水平升高与皮质酮、IL-6 和CRP 水平降低有关。nesfatin-1 负性调节CD33 的表达,导致炎症细胞因子的表达减少[16]。本研究发现,在HCoEpiC 细胞和HT-29 细胞中,nesfatin-1 转染抑制了LPS刺激诱导的NLRP3、AIM2、caspase-1和ASC蛋白的表达。NLRP3炎症小体是研究最多的炎症小体,其持续和过度激活导致急性和慢性炎症疾病的爆发。通常当炎症小体被刺激激活时,激活的炎症小体会将caspase-1 前体切割成caspase-1。caspase-1反过来又调节促炎细胞因子如IL-6 和TNF-α 的成熟,过量的IL-6 可导致各种炎症疾病[17]。AIM2 是识别微生物或宿主来源dsDNA 的胞质传感器之一,其过度激活导致自身免疫性疾病的发展[18]。在炎症小体复合物形成过程中,集合适配器ASC 是与NLRP3、AIM2 结构域和caspase-1 前体相互作用的衔接蛋白[19]。
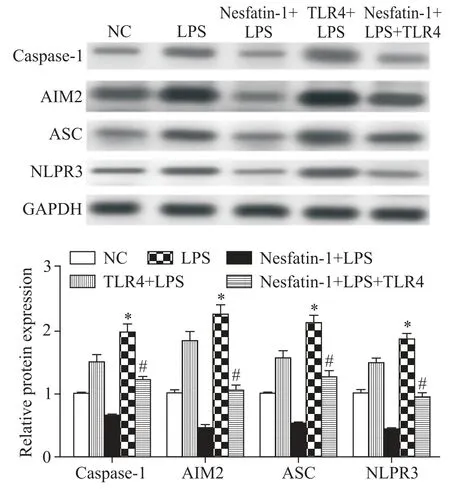
Figure 4.The protein expression of NLRP3,AIM2,caspase-1 and ASC was determined by Western blot.Mean±SD. n=3.*P<0.05 vs LPS group;#P<0.05 vs nesfatin-1+LPS group.图4 Western blot检测NLRP3、AIM2、caspase-1和ASC蛋白的表达
近年来,nesfatin-1在TLR4应答中的作用引起了研究者的关注。Roth 等[20]研究证明,TLR4 应答是由nesfatin-1介导的,nesfatin-1阻断核移位和转录活性。沙格列汀可提高nesfatin-1 的表达,抑制炎症反应,TLR4 抑制剂可减弱沙格列汀对nesfatin-1 的促进作用[21]。在本研究中,我们发现nesfatin-1直接与TLR4结合,抑制LPS 诱导的免疫反应。进一步分析显示,TLR4 的转染促进LPS 诱导的HCoEpiC 细胞IL-6、TNF-α 和NLRP3 的表达升高,并消除了nesfatin-1 对HCoEpiC 细胞IL-10 表达的增强作用以及nesfatin-1对NLRP3、AIM2、caspase-1 和ASC 蛋白表达的抑制作用。结果表明nesfatin-1 通过靶向TLR4 介导LPS诱导的肠细胞炎症反应。
综上所述,本研究表明nesfatin-1 在NEC 和LPS诱导的肠上皮细胞中表达较低。nesfatin-1的过度表达减弱了HCoEpiC 细胞和HT-29 细胞的炎症反应。此外,nesfatin-1 通过靶向TLR4 介导炎症反应保护肠细胞免受LPS 诱导的炎症反应损伤,可能成为抗NEC治疗的潜在靶点。
