甲磺酸加贝酯对脑缺血再灌注大鼠血脑屏障保护作用的研究
2021-01-06乔建新刘熙鹏
乔建新,刘熙鹏,刘 明,曹 兵
(河北北方学院附属第一医院,河北张家口 075000)
缺血性脑卒中约占脑卒中患者的80%,具有较高的致残、致死率和复发率,恢复时间长且预后不理想。血脑屏障(blood-brain barrier,BBB)是一种存在于血液循环和脑组织之间的特殊屏障,通过调控脑内外物质交换对维持脑神经内环境稳定起到重要作用。缺血性脑卒中及实现血流再灌注后,活性氧簇(reactive oxygen species,ROS)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(in⁃terleukin-1β,IL-1β)、IL-6 等炎症因子大量释放,将破坏BBB 结构和通透性,是导致血管源性脑水肿而致残、致死的重要因素[1-3]。因此,研究以保护BBB为靶向的药物对降低脑缺血再灌注(ischemia-reper⁃fusion,I/R)损伤具有重要意义。
甲磺酸加贝酯(gabexate mesilate,GM)是一种非肽类蛋白酶抑制剂。既往有研究显示,GM 能够通过抑制氧化应激和炎症反应对大鼠I/R 损伤的肝脏和小肠具有保护作用[4-5],但GM 对I/R 损伤的脑组织是否具有保护作用的文献报道尚不多见。尼莫地平(nimodipine,NMP)是一种钙拮抗剂,可用于预防与治疗缺血性脑血管病,也是脑I/R 相关动物实验研究常用的阳性对照药物。有研究表明,脑缺血早期给予NMP 对BBB 具有保护作用[6]。本实验通过制备脑I/R 大鼠模型,以NMP 为阳性对照药物,探讨GM 对脑I/R大鼠BBB的保护作用及其可能的机制。
材料和方法
1 实验动物
SPF 级Sprague-Dawley(SD)雄性大鼠180 只,7周龄,体质量(230±10)g,购自承德医学院实验动物中心提供[许可证号:SCXK(冀)2017-001]。适应性饲养1周后开展实验研究,饲养环境:温度(25±1)℃、相对湿度(60±5)%、12 h 光照黑暗交替,自由饮水进食。
2 药物与试剂
注射用GM(成都天台山制药有限公司;规格:0.1 g;批号:201906024);注射用NMP(北京四环科宝制药有限公司;规格:2 mg;批号:190531);伊文思蓝(国药集团化学试剂有限公司);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和丙二醛(malo⁃ndialdehyde,MDA)检测试剂盒(南京建成生物工程研究所);TNF-α、IL-1β 和IL-6 ELISA 试剂盒(北京博奥森生物科技有限公司);基质金属蛋白酶2(ma⁃trix metalloproteinase-2,MMP⁃2)、MMP⁃9、核因子κB(nuclear factor-κB,NF-κB)和β-actin 单克隆抗体(北京中杉金桥生物技术有限公司);RNeasy Mini 试剂盒、反转录试剂盒和OneStep RT-PCR 试剂盒(Qia⁃gen)。
3 实验方法
3.1 动物分组、给药与造模 (1)对180 只SD 大鼠进行数字编码后,按照随机数字表法随机分为6 组:假手术组(sham 组)、模型组(I/R 组)、NMP(2 mg·kg−1·d−1)组和GM(5、10 和20 mg·kg−1·d−1)组[药物剂量选择依据:根据人和大鼠药物剂量换算公式,大鼠剂量(mg/kg)=6.3X(X 为人临床剂量,单位:mg/kg),GM 人临床使用剂量为100 mg/d,按照成人体重65 kg 计算,可得:GM 大鼠剂量为9.69 mg·kg−1·d−1,因此确定10 mg·kg−1·d−1为中剂量,另设5 mg·kg−1·d−1为低剂量,20 mg·kg−1·d−1为高剂量。同理,算得NMP大鼠剂量为1.16~2.33 mg·kg−1·d−1,并参照段晋宁等[7]报道的大鼠实验剂量,确定NMP 组所用NMP剂量为2 mg·kg−1·d−1],每组30 只。(2)精确称取GM和NMP 粉针剂加入适量0.9%氯化钠溶液制备浓度2.5、5和10 g/L的GM 溶液和浓度1 g/L的NMP溶液。造模前10 min,GM(5、10 和20 mg·kg−1·d−1)组腹腔注射浓度2.5、5 和10 g/L 的GM 溶液,NMP(2 mg·kg−1·d−1)组给予浓度1 g/L 的NMP 溶液,假手术组和模型组给予0.9%氯化钠溶液,注射剂量均为2 mL/kg。(3)脑I/R 模型制备[8]:造模手术前12 h 禁食不禁水,实施麻醉后沿颈部正中切口、钝性剥离右侧颈总动脉和颈外、颈内动脉,夹闭颈总动脉并结扎颈外动脉后,由颈外动脉切口插入直径0.235 mm 的线栓进入颈内动脉,遇阻力止(深度距分叉处约18 mm),固定线栓后逐层缝合皮肤并擦拭碘伏进行消毒处理;假手术组除不在颈外动脉切口和插入线栓外,其余同模型组。再灌注6 h后行各指标检测。
3.2 Longa 评分法检测大鼠神经功能 各组随机选取10 只大鼠,参照Longa 评分标准进行评分[9]∶大鼠神态、动作正常计0 分;缺血对侧前爪不能伸展计1分;爬行时向缺血对侧转圈行走计2 分;向缺血对侧倾倒计3 分;不能爬行计4 分。Longa 评分越高则说明大鼠神经功能缺损越严重。
3.3 BBB通透性检测 参照邱珂等[10]报道的伊文思蓝渗透法检测BBB 通透性:评分完成后的各组10 只大鼠,以4 mL/kg 剂量尾静脉注射2%的伊文思蓝溶液;1 h后麻醉,实施心脏灌注300 mL 0.9%氯化钠溶液后断头、取右侧大脑;研磨匀浆后加入3 倍量甲酰胺溶液,60℃孵育24 h 后3 000 r/min 离心10 min(离心半径15 cm),取上清液;然后通过酶标仪测定610 nm 波长处的吸光度(A)。根据标准曲线计算伊文思蓝含量,脑组织伊文思蓝含量可反映BBB通透性。
3.4 脑组织含水量检测 各组随机选取10只大鼠,颈椎脱臼处死后断头取脑,去除小脑和脑干,冲洗干净并用滤纸拭干后称重,即为湿重(W1);置于95℃烘箱24 h 后称重,即为干重(W2)。脑组织含水量(%)=(W1−W2)/W1×100%
3.5 脑组织生化指标检测 各组随机选取10 只大鼠,颈椎脱臼处死后断头取脑,切取右侧大脑组织置冰上,剪碎后加入9 倍量4℃预冷裂解液,研磨得到脑组织匀浆液。经4 500×g离心10 min 后(离心半径15 cm)取上清液,然后按照各试剂盒操作步骤,通过生化分析法检测SOD 和GSH-Px 活性及MDA 含量;通过ELISA 试剂盒检测TNF-α、IL-1β 和IL-6 含量。
3.6 RT-PCR 法检测脑组织MMP-2、MMP-9 和NFκB 的mRNA 表达 取0.1 g 脑组织,采用RNeasy Mini 试剂盒分离纯化总RNA,通过核酸分析仪检测RNA 浓度和纯度后,遵照反转录试剂盒操作说明将RNA 逆转录成cDNA。遵照OneStep RT-PCR 试剂盒操作说明进行PCR 扩增,程序设置为:94℃15 s,55℃30 s,70 ℃30 s,共40 个循环。将PCR 产物经过琼脂糖凝胶电泳并显影、拍照。以β-actin 为内参照,半定量计算目的基因的相对表达量。所用引物序列见表1。
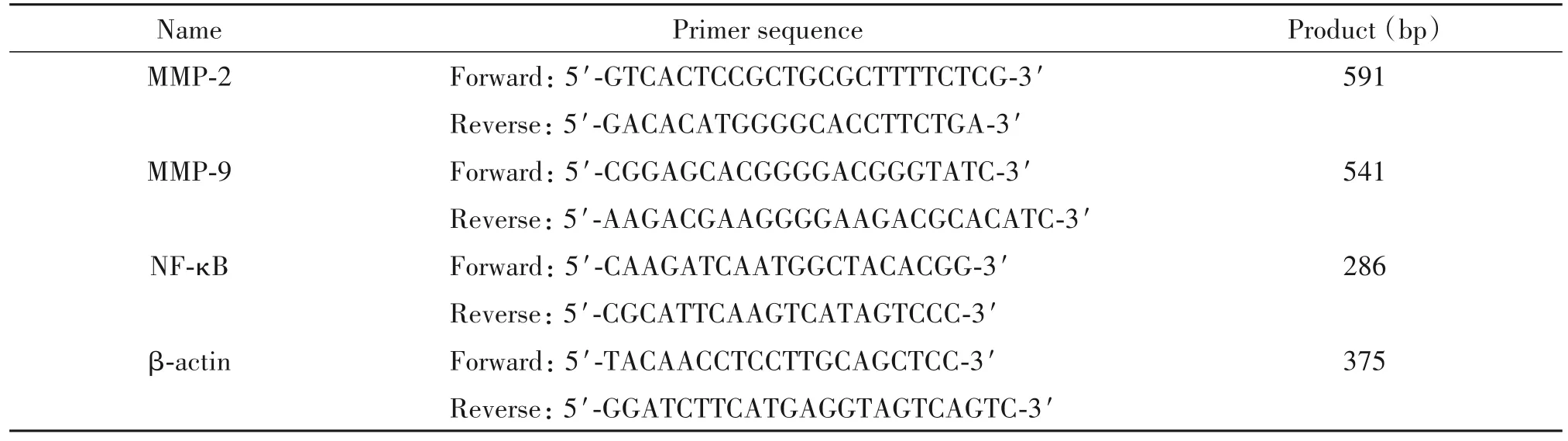
表1 RT-PCR引物序列Table 1.The sequences of the primers used in RT-PCR
3.7 Western blot 法检测脑组织MMP-2、MMP-9 和NF-κB 蛋白表达 取脑组织匀浆液,4℃、16 000×g离心20 min 后取上清液,通过总蛋白提取试剂盒提取总蛋白、BCA 法检测总蛋白含量后,上样(20 μg 总蛋白)、行凝胶电泳(当样品指示剂到达分离胶时电压由80 V 变为120 V)、冰上转膜(电压100 V,时间1 h),5%脱脂牛奶室温封闭1 h 后,滴加兔抗鼠MMP⁃2、MMP⁃9 和NF-κB 单克隆抗体,4℃过夜,TBST 溶液洗膜后滴加II 抗,室温孵育1 h,TBST 洗膜后ECL显色,通过凝胶成像仪获得条带;以β-actin 为内参照,以条带灰度值半定量MMP⁃2、MMP⁃9和NF-κB蛋白表达量。
4 统计学处理
应用SPSS 17.0 软件包进行统计分析。实验数据以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠神经功能测定结果
通过Longa评分检测各组大鼠神经功能,结果显示,与sham 组比较,I/R 组大鼠Longa 评分显著升高(P<0.01);与I/R 组比较,GM(10 和20 mg·kg−1·d−1)组和NMP(2 mg·kg−1·d−1)组Longa 评分显著降低(P<0.01);与NMP(2 mg·kg−1·d−1)组比较,GM(20 mg·kg−1·d−1)组Longa评分显著降低(P<0.05),见图1。
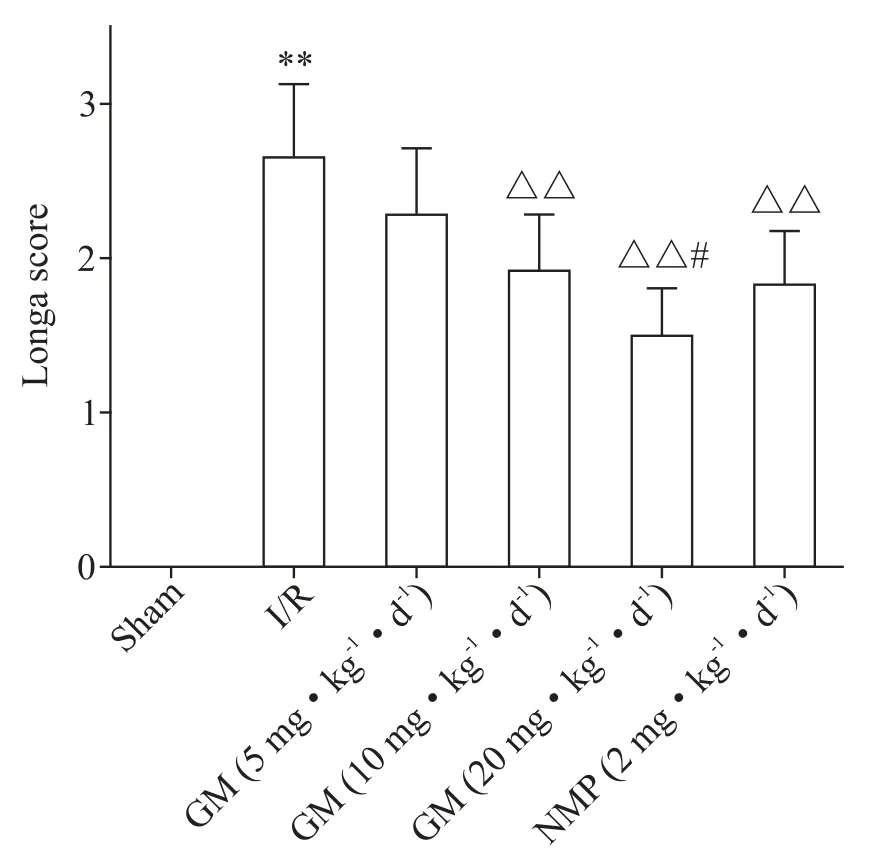
Figure 1.The nerve function of the rats in each group measured by Longa scoring method.Mean±SD. n=10.**P<0.01 vs sham group;△△P<0.01 vs I/R group;#P<0.05 vs NMP(2 mg·kg−1·d−1)group.图1 各组大鼠神经功能测定结果
2 各组大鼠BBB通透性测定结果
伊文思蓝渗透实验结果显示,与sham 组比较,I/R 组大鼠BBB 通透性显著升高(P<0.01);与I/R 组比较,GM(10 和20 mg·kg−1·d−1)组和NMP(2 mg·kg−1·d−1)组BBB 通透性显著降低(P<0.01);与NMP(2 mg·kg−1·d−1)组比较,GM(20 mg·kg−1·d−1)组BBB通透性显著降低(P<0.05),见图2。
3 各组大鼠脑组织含水量测定结果
与sham 组比较,I/R 组大鼠脑组织含水量显著升高(P<0.01);与I/R 组比较,GM(10 和20 mg·kg−1·d−1)组及NMP(2 mg·kg−1·d−1)组脑组织含水量降低(P<0.05 或P<0.01);GM(20 mg·kg−1·d−1)组脑组织含水量与NMP(2 mg·kg−1·d−1)组比较差异无统计学意义(P>0.05),见图3。
4 各组大鼠脑组织氧化应激指标测定结果
与sham 组比较,I/R 组大鼠脑组织SOD 和GSHPx 活性显著降低,MDA 含量显著升高(P<0.01);与I/R 组比较,GM(10 和20 mg·kg−1·d−1)组和NMP(2 mg·kg−1·d−1)组脑组织SOD 和GSH-Px 活性显著升高,MDA 含量显著降低(P<0.05 或P<0.01);与NMP(2 mg·kg−1·d−1)组比较,GM(20 mg·kg−1·d−1)组SOD 活性显著升高,MDA 含量显著降低(P<0.05),但两组间GSH-Px活性差异无统计学意义(P>0.05),见图4。
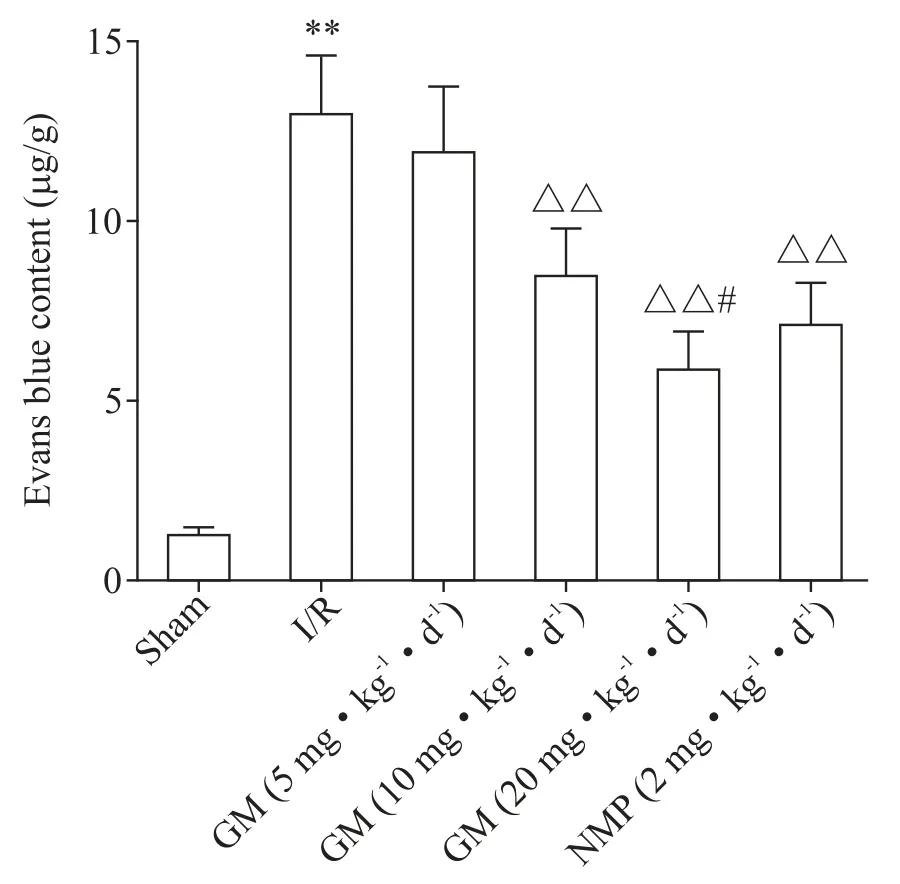
Figure 2.The BBB permeability of the rats in each group mea⁃sured by Evans blue permeation method.Mean±SD.n=10.**P<0.01 vs sham group;△△P<0.01 vs I/R group;#P<0.05 vs NMP(2 mg·kg−1·d−1)group.图2 各组大鼠BBB通透性测定结果
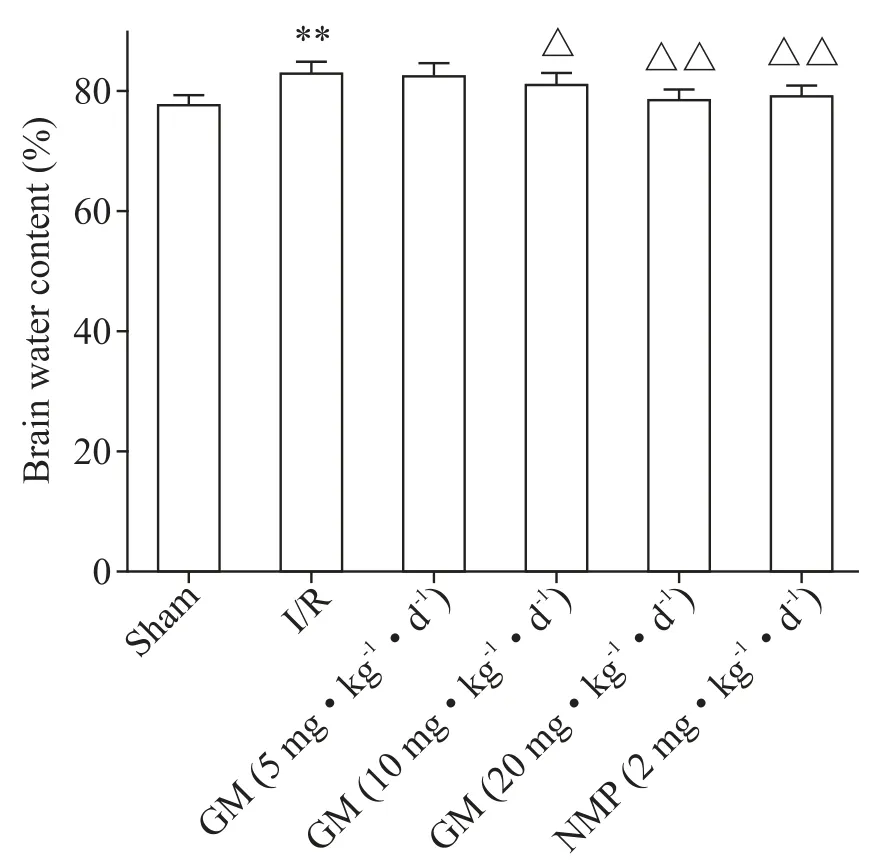
Figure 3.The brain water content of the rats in each group.Mean±SD. n=10.**P<0.01 vs sham group;△P<0.05,△△P<0.01 vs I/R group.图3 各组大鼠脑组织含水量测定结果
5 各组大鼠脑组织炎症反应指标测定结果
与sham 组比较,I/R 组大鼠脑组织TNF-α、IL-1β和IL-6 含量显著升高(P<0.01);与I/R 组比较,GM(10 和20 mg·kg−1·d−1)组和NMP(2 mg·kg−1·d−1)组TNF-α、IL-1β 和IL-6 含量显著降低(P<0.05 或P<0.01);与NMP(2 mg·kg−1·d−1)组比较,GM(20 mg·kg−1·d−1)组TNF-α含量显著降低(P<0.05),但两组间IL-1β 和IL-6 含量差异无统计学意义(P>0.05),见图5。
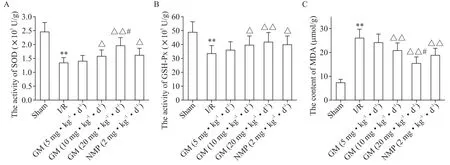
Figure 4.Determination results of oxidative stress indexes in brain tissue of the rats in each group.A:the activity of SOD;B:the ac⁃tivity of GSH-Px;C:the content of MDA.Mean±SD. n=10.**P<0.01vs sham group;△P<0.05,△△P<0.01 vs I/R group;#P<0.05 vs NMP(2 mg·kg−1·d−1)group.图4 各组大鼠脑组织氧化应激指标测定结果
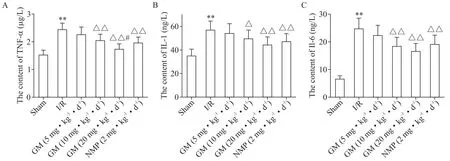
Figure 5.Measurement results of inflammatory response indexes in brain tissue of the rats in each group.A:the content of TNF-α;B:the content of IL-1β;C:the content of IL-6.Mean±SD. n=10.**P<0.01vs sham group;△P<0.05,△△P<0.01 vs I/R group;#P<0.05 vs NMP(2 mg·kg−1·d−1)group.图5 各组大鼠脑组织炎症反应指标测定结果
6 各组大鼠脑组织MMP-2、MMP-9 和NF-κB 的mRNA表达检测结果
与sham 组比较,I/R 组大鼠脑组织MMP⁃2、MMP⁃9和NF-κB 的mRNA 表达上调(P<0.01);与I/R 组比较,GM(10 和20 mg·kg−1·d−1)组和NMP(2 mg·kg−1·d−1)组MMP⁃2、MMP⁃9 和NF-κB mRNA 表达下调(P<0.01);与NMP(2 mg·kg−1·d−1)组比较,GM(20 mg·kg−1·d−1)组MMP⁃2、MMP⁃9和NF-κB 的mRNA 表达下调(P<0.01),见图6。
7 各组大鼠脑组织MMP-2、MMP-9和NF-κB 蛋白表达检测结果
与sham 组比较,I/R 组大鼠脑组织MMP-2、MMP-9和NF-κB蛋白表达上调(P<0.01);与I/R组比较,GM(10 和20 mg·kg−1·d−1)组和NMP(2 mg·kg−1·d−1)组MMP⁃2、MMP⁃9 和NF-κB 蛋白表达下调(P<0.05 或P<0.01);与NMP(2 mg·kg−1·d−1)组比较,GM(20 mg·kg−1·d−1)组MMP⁃2、MMP⁃9和NF-κB蛋白表达下调(P<0.05或P<0.01),见图7。
讨 论
BBB 是以内皮细胞为核心并依靠星形胶质细胞、神经元、周细胞、小胶质细胞等提供结构和功能支持,在细胞间辅以紧密连接蛋白复合体(tight junc⁃tion protein systerm,TJPs)而形成的生理性屏障[11],能够阻止有害物质由血液进入脑组织,从而保证脑组织稳态。其中,TJPs 由跨膜蛋白、胞质附着蛋白、细胞骨架蛋白等相互作用形成,对维持BBB 结构和功能至关重要[12]。
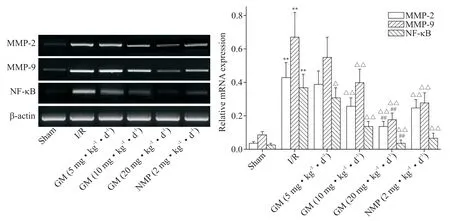
Figure 6.The mRNA expression levels of MMP⁃2,MMP⁃9 and NF-κB in brain tissue of the rats in each group detected by RT-PCR.Mean±SD. n=3.**P<0.01 vs sham group;△P<0.05,△△P<0.01 vs I/R group;##P<0.01 vs NMP(2 mg·kg−1·d−1)group.图6 RT-PCR检测各组大鼠脑组织MMP⁃2、MMP⁃9和NF-κB的mRNA表达水平
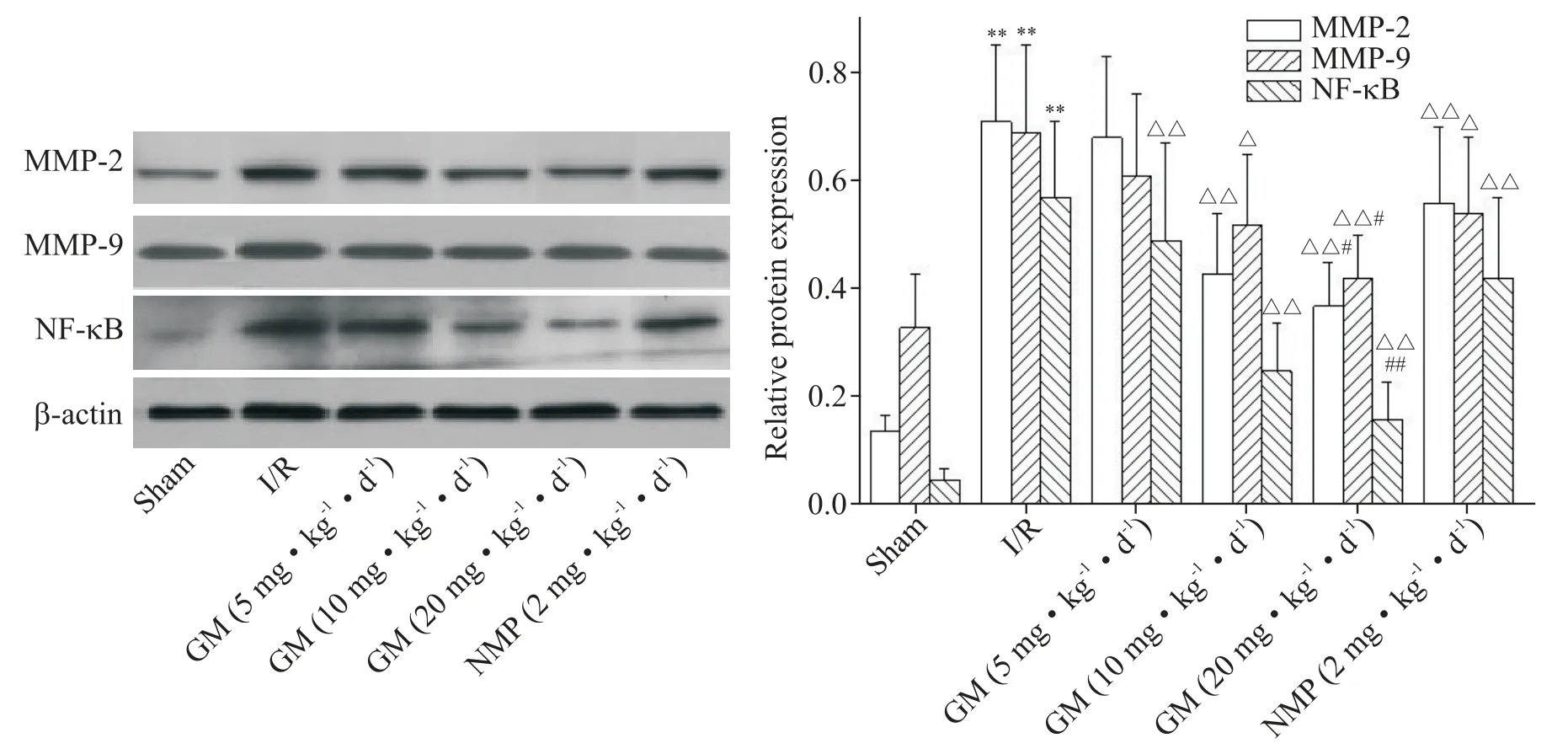
Figure 7.The protein expression levels of MMP⁃2,MMP⁃9 and NF-κB in brain tissue of the rats in each group detected by Western blot.Mean±SD. n=3.**P<0.01 vs sham group;△P<0.05,△△P<0.01 vs I/R group;#P<0.05,##P<0.01 vs NMP(2 mg·kg−1·d−1)group.图7 Western blot检测各组大鼠脑组织MMP⁃2、MMP⁃9和NF-κB蛋白表达水平
缺血性脑卒中及实现再灌注后,缺血区线粒体能量代谢障碍、呼吸链受阻而诱发ROS 大量产生以及炎症因子TNF-α、IL-1β 和IL-6 大量释放[13-14],导致以ROS 为底物的抗氧化酶SOD 和GSH-Px 被过度消耗,使机体ROS 代谢失衡而过剩蓄积,攻击核酸、蛋白等大分子物质生成具有毒性的MDA[15]。此外,Wang等[16]的研究显示,ROS攻击细胞膜而破坏细胞骨架,降解跨膜蛋白和胞质附着蛋白而破坏TJPs,从而破坏BBB 结构;He 等[17]和陆正齐[18]的研究表明,炎症因子TNF-α 和IL-1β 能够刺激中性粒细胞等进一步产生和释放炎症因子,从而诱发炎症级联反应;炎症反应能够导致TJPs 结构损坏,并且TNF-α 和IL-1β 能够活化NF-κB 而诱导内皮细胞黏附分子[细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)、血管细胞粘附分子(vascular cell adhesion molecule,VCAM)等]上调表达,进而增加BBB 通透性;IL-6 则能够刺激ROS 大量释放,从而加重ROS所造成的损伤。闫磊等[19]的研究显示,通过给药抑制脑I/R 大鼠炎症反应和氧化应激损伤,能够降低BBB 通透性并减轻脑缺血再灌注损伤;何平平等[20]的研究表明,通过药物干预保护脑I/R大鼠TJPs结构能够有效降低BBB 通透性并缓解脑水肿,减轻脑缺血再灌注损伤。本实验结果显示,GM 干预能够有效降低脑I/R 大鼠神经功能Longa 评分,抑制氧化应激损伤和炎症反应,下调NF-κB 转录与表达,降低BBB 通透性,减轻脑水肿,并且20 mg·kg−1·d−1剂量的GM 对神经功能和BBB 通透性的保护作用及对氧化应激指标、炎症因子、NF-κB 转录与表达的调控作用均优于NMP,提示GM 可能通过抑制氧化应激损伤和炎症反应对脑I/R 大鼠BBB 和神经功能起到保护作用。
细胞外基质也是BBB 的重要组成部分,MMP 在催化降解细胞外基质以维持其合成-消化降解平衡中起着关键作用,并且MMP⁃2 和MMP⁃9 能够消化降解跨膜蛋白和内皮细胞基底层而破坏BBB 结构[21]。刘菡等[22]和宋俊科等[23]的研究通过药物干预下调MMP⁃2和MMP⁃9表达能够保护脑I/R大鼠BBB,进而减轻脑缺血再灌注损伤。本实验结果显示,GM 干预能够有效抑制脑I/R 大鼠脑组织MMP⁃2 和MMP⁃9的mRNA 及蛋白表达上调,并且20 mg·kg−1·d−1剂量的GM 对MMP⁃2和MMP⁃9 mRNA 及蛋白表达的调控作用优于NMP。这可能是GM 保护脑I/R 大鼠BBB的另一机制。
综上所述,本研究证实了GM 对脑I/R 大鼠BBB和神经功能具有保护作用,其潜在机制可能是抑制氧化应激和炎症反应以及下调MMP⁃2、MMP⁃9 和NF-κB 蛋白表达。本研究为GM 作为脑I/R 损伤防治药物提供了实验依据。
