达沙替尼通过上调p53表达和下调AKT磷酸化抑制肾癌细胞系786-O及769-P体外活力与迁移*
2021-01-06谢开红梁家健蔡大霞安姿旖刘革修胡小毛
谢开红,梁家健,蔡大霞,安姿旖,刘革修,胡小毛△
(1湘南学院附属医院肿瘤科,湖南郴州 423000;2暨南大学医学院血液病研究所,广东广州 510632)
肾癌是泌尿系统常见的恶性肿瘤,以来源于肾小管上皮的透明细胞癌占绝大多数,治疗效果差,是导致患者死亡的主要类型[1]。针对其VHL抑癌基因失活导致的低氧诱导因子(hypoxia-inducible factor,HIF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和血小板衍生生长因子(platelet-de⁃rived growth factor,PDGF)过表达的特性,目前肾细胞癌(renal cell carcinoma,RCC)的治疗采用了靶向VEGF 信号轴的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),包括索拉非尼、舒尼替尼、帕唑帕尼、阿昔替尼、乐伐替尼和卡博替尼[2]。但是在这些药物的临床应用中观察到原发性和获得性耐药情况,所以需要寻找新的替代药物。达沙替尼(dasatinib)是最早被使用的一种TKI,主要用于慢性髓系白血病的治疗。后来在一些实体瘤临床试验中观察到达沙替尼也有一定的效果,包括脑胶质瘤、肺癌、卵巢癌和前列腺癌等[3]。相较于目前临床使用的其他酪氨酸激酶抑制剂,达沙替尼抑制的激酶种类更为多样,包括SRC、SFKs、BCR-ABL、c-KIT、PDGFR、c-FMS 和EPHA2。在上述实体瘤中已经证实,达沙替尼除了抗血管生成外,还可抑制肿瘤细胞增殖、侵袭和转移过程[4]。因此,达沙替尼可能是治疗肾癌的一种新的可替代药物。本项工作探讨达沙替尼体外对人肾透明细胞癌细胞株786-O 及769-P 活力、凋亡及迁移的影响,为达沙替尼治疗肾癌提供参考资料。
材料和方法
1 细胞
人肾癌细胞株786-O 及769-P 购自中国科学院上海细胞库,于含1%青霉素-链霉素双抗及10%胎牛血清的RPMI-1640培养液中培养。
2 主要试剂
以二甲基亚砜(dimethyl sulfoxide,DMSO;购于MP Biomedicals)为溶剂,制成20 mmol/L 的达沙替尼(购于APExBIO)用于体外实验。RPMI-1640 完全培养液(HyClone);胎牛血清(Gibco);MTT 试剂盒(Dojindo);细胞周期试剂盒(南京凯基公司);Hoechst 33258 染色液(Solar);RIPA 细胞裂解液(上海碧云天生物技术有限公司);ECL化学发光试剂盒(Thermo);兔抗人cleaved caspased-3(cl-caspase-3)单抗、兔抗人cleaved caspased-9(cl-caspase-9)单抗、兔抗人p-AKT 单抗、鼠抗人细胞周期蛋白D1(cyclin D1)单抗、鼠抗人p21 单抗、鼠抗人p53 单抗、鼠抗人GAPDH 单抗以及辣根过氧化物酶标记的羊抗鼠IgG和羊抗兔IgG(Cell Signaling Technology)。
3 主要仪器
DNM-9602G自动酶标仪购自北京普朗新技术有限公司;FACSCalibur 流式细胞仪购自BD;Heal⁃ForeNeofuge13台式高速冷冻离心机购自上海力申科学仪器有限公司;PAC1000 型蛋白电泳及转印系统购自Bio-Rad;Meta-Morph 凝胶成像分析系统购自Media Cybernetics。
4 主要方法
4.1 MTT 法检测细胞活力 将对数期的786-O 细胞及769-P 细胞分别接种于96 孔板中(每孔3 000个),每孔100 μL,复孔3 个。在CO2培养箱中于含10%胎牛血清的RPMI-1640 培养液里培养12 h 后加入达沙替尼,依据达沙替尼体外作用肿瘤细胞系的报道[5],以及前期预实验确定实验浓度,使其终浓度分别为0 μmol/L、0.015 6 μmol/L、0.031 3 μmol/L、0.062 5 μmol/L、0.125 μmol/L、0.25 μmol/L、0.5 μmol/L、1 μmol/L 和2 μmol/L,同时设置调零孔(RPMI-1640 培养液+0.1%DMSO)和空白对照孔(细胞、0.1%DMSO和RPMI-1640培养液)。在含5%CO2和饱和湿度的37℃培养箱中继续培养24 h 后,每孔加MTT 溶液(5 g/L,用PBS 配制,pH=7.4)10 μL,继续孵育4 h,终止培养,吸弃孔内培养上清液后每孔加100 μL DMSO,振荡10 min,使结晶物充分融解,选择570 nm波长在酶联免疫监测仪上测定各孔吸光度(A)值。将独立重复3 次的数据导入GraphPad Prism 8.2.1 作折线图[6]。对后面涉及的细胞周期和凋亡相关实验,以生长曲线中达沙替尼最低有效浓度以及IC50为参照设置药物浓度(0.5 和1 μmol/L)。细胞迁移实验中,为降低达沙替尼对细胞活力的抑制作用,采用较低浓度(0~0.031 3 μmol/L)进行实验。
4.2 划痕实验检测达沙替尼对细胞迁移能力的影响 将对数期的786-O及769-P细胞分别接种于6孔板中(每孔50 000 个),待细胞在血清含量为10%的RPMI-1640 培养液中贴壁并长至融合时,使用200 μL 吸头在6 孔板中间均匀地划1 条直线后用PBS 轻洗去漂悬的细胞,加入达沙替尼和含2%胎牛血清的RPMI-1640 培养液,使达沙替尼终浓度分别为0 μmol/L、0.007 8 μmol/L、0.015 6 μmol/L 和0.031 3 μmol/L,分别在加药后0、6、12 和24 h 时在倒置显微镜(Leica)下观察拍照,然后使用Image-Pro Plus 软件分析照片,测量划痕位置的面积和高度,将面积除以高度可以得到平均的划痕宽度,将0 h的划痕宽度减去实验结束时的划痕的宽度,得到的就是细胞迁移的距离,以细胞迁移距离计算细胞迁移能力。将3次独立重复的数据分析后进行统计分析并绘制柱状图[6]。
4.3 PI 单染法检测达沙替尼对细胞周期的影响将对数期的786-O 及的769-P 细胞分别以含10%胎牛血清的RPMI-1640培养液置于25T培养瓶中培养,当细胞长至60%~70%融合时加入达沙替尼,使其终浓度分别为0、0.02、0.1 和0.5 μmol/L;在含5% CO2且饱和湿度的37℃细胞培养箱中培养24 h 后,200×g离心5 min收集所有的细胞,PBS重悬后离心(200×g,5 min)去上清,加入600 μL PBS 重悬细胞后逐滴加入1 400 μL无水乙醇,−20℃固定过夜后离心去上清(200×g,5 min),PBS 重悬后离心(200×g,5 min)、加入RNase(工作浓度20 mg/L),37℃孵育30 min 后离心去上清(200×g,5 min),加入PI(工作浓度50 mg/L),室温避光孵育30 min,最后过300目筛后上流式细胞仪(ACEA)检测[6]。
4.4 Hoechst 33258 染色检测达沙替尼对细胞凋亡的影响 将对数期的786-O 及769-P 细胞分别接种6孔板中(每孔50 000 个),在含10%胎牛血清的RPMI-1640 培养液中培养,当细胞长至60%~70%融合时加入达沙替尼,终浓度分别为0 μmol/L、0.5 μmol/L、1 μmol/L 和2 μmol/L;在含5% CO2且饱和湿度的37℃细胞培养箱中培养24 h 后,离心收集所有细胞,加入0.5 mL 固定液悬起细胞后室温固定10 min,离心去固定液,用PBS 洗2遍,每次3 min。离心后吸去大部分液体保留50 μL液体,轻轻混匀细胞后滴加至载玻片上。均匀滴上0.5 mL Hoechst 33258染色液,染色5 min。用PBS 洗2 遍,每次3 min,滴一滴抗荧光淬灭封片液于载玻片上,盖上盖玻片。接着于荧光显微镜中的DAPI 通道中观察拍照,正常细胞,胞核呈光滑圆形,胞核染色较均一;凋亡细胞,胞核碎片化,因DNA 浓缩致密而深染(蓝色发白);坏死细胞,胞核边缘不清晰,DNA 不浓缩;正在分裂的细胞,因DNA 浓缩致密而深染,但显著可见两组DNA 分列两排。计数总细胞数和凋亡细胞数,计算两者比例,将3 次独立重复的数据都分析完后进行统计分析并绘制柱状图[6]。
4.5 Western blot 检测细胞周期及细胞凋亡相关蛋白水平 对数期786-O 及769-P 细胞以含10%胎牛血清的RPMI-1640培养液置于25T培养瓶中培养,当细胞长至60%~70%融合时加入达沙替尼,终浓度为0 μmol/L、0.5 μmol/L 和1 μmol/L。在5%CO2且饱和湿度的37℃、细胞培养箱中培养24 h 后收集所有的细胞,冰上RIPA 裂解液裂解细胞提取总蛋白后,BCA 法测定蛋白浓度,接着以每孔上样40 μg蛋白量进行蛋白电泳(恒压,先70 mV 持续30 min,后110 mV 持续90 min),待蛋白跑至分离胶底层后以湿转法(恒流220 mA,持续2 h)转到PVDF 膜上,室温下5%脱脂牛奶封闭1 h,TBS 洗膜5 min,4℃孵Ⅰ抗12 h,TBS 洗膜(3 次,每次10 min)室温下振荡孵Ⅱ抗1 h,TBS 洗膜(3 次,每次10 min),最后条带ECL 化学发光后在全自动化学发光和荧光凝胶成像系统(UVITEC)中显影拍照,并用Gel-Pro Analyzer 6.0 软件对照片进行分析,将目的蛋白的灰度值除以内参蛋白的灰度值,进行归一化处理[6]。
5 统计学处理
实验数据应用GraphPad Prism 8.2.1 进行统计分析和作图,结果以均数±标准差(mean±SD)表示。两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,在各组间差异有统计学意义的基础上再进行两两比较的t检验。以P<0.05 为差异有统计学意义。
结 果
1 达沙替尼抑制786-O及769-P细胞活力
用梯度浓度的达沙替尼处理24 h 后,786-O 及769-P的细胞活力出现不同程度的抑制(图1)。随着达沙替尼浓度的增大(0.015 6~2 μmol/L),786-O 及769-P 细胞活力逐渐降低,其中达沙替尼对786-O 及769-P 细胞株的IC50分别为(0.9587±0.0288)μmol/L和(0.7843±0.0660)μmol/L。
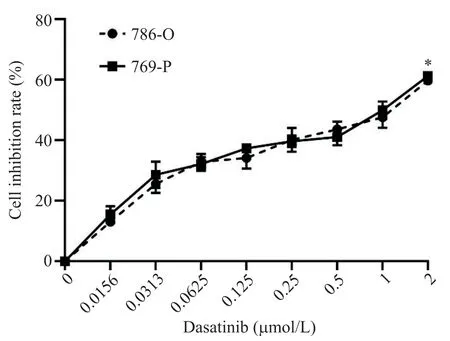
Figure 1.Dasatinib inhibited the viability of 786-O and 769-P cells.Mean±SD. n=3.*P<0.05 vs 0 μmol/L group.图1 达沙替尼对786-O及769-P细胞活力的抑制作用
2 达沙替尼抑制786-O及769-P细胞迁移
786-O 及769-P 细胞进行划痕实验,观察达沙替尼对细胞迁移能力的影响。0 μmol/L 的dasatinib 组24 h 时细胞已基本融合,实验组细胞则有不同程度的空白区,表明达沙替尼对786-O 及769-P 细胞的迁移有抑制作用(P<0.05),并随着达沙替尼浓度的增加,抑制迁移的作用越显著,呈浓度依赖性(P<0.05或P<0.01),见图2、3。
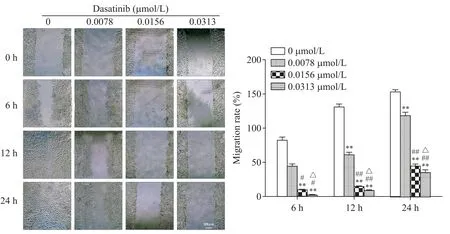
Figure 2.Dasatinib blocked the migration ability of 786-O cells.The migration ability of 786-O cells was detected by wound healing method(scale bar=300 μm).The distance of migratory cells was normalized to the value of 0 h group.Mean±SD. n=3.**P<0.01 vs 0 μmol/L group;#P<0.05,##P<0.01 vs 0.0078 μmol/L group;△P<0.05 vs 0.0156 μmol/L group.图2 达沙替尼阻滞786-O细胞迁移
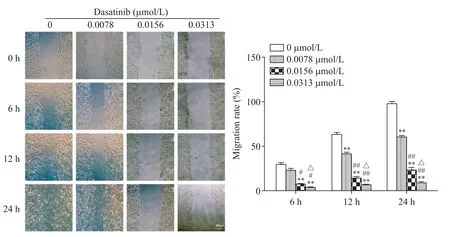
Figure 3.Dasatinib blocked the migration ability of 769-P cells.The migration ability of 769-P cells was detected by wound healing method(scale bar=300 μm).The distance of migratory cells was normalized to the value of 0 h group.Mean±SD. n=3.**P<0.01 vs 0 μmol/L group;#P<0.05,##P<0.01 vs 0.0078 μmol/L group;△P<0.05 vs 0.0156 μmol/L group.图3 达沙替尼阻滞769-P细胞迁移
3 达沙替尼阻滞786-O及769-P细胞周期
达沙替尼处理24 h 后,与0 μmol/L dasatinib 组相比,各实验组处于G1期的细胞比例均有增加(P<0.05),且随着达沙替尼浓度的增加,G1期的细胞比例也增加(P<0.05),相应的S期的细胞比例减小(P<0.05);两细胞系的G2期细胞变化略有差异,处于G2期的786-O 细胞比例无显著变化(P>0.05),而处于G2期的769-P 细胞比例总体减小(P<0.05),见图4、5。
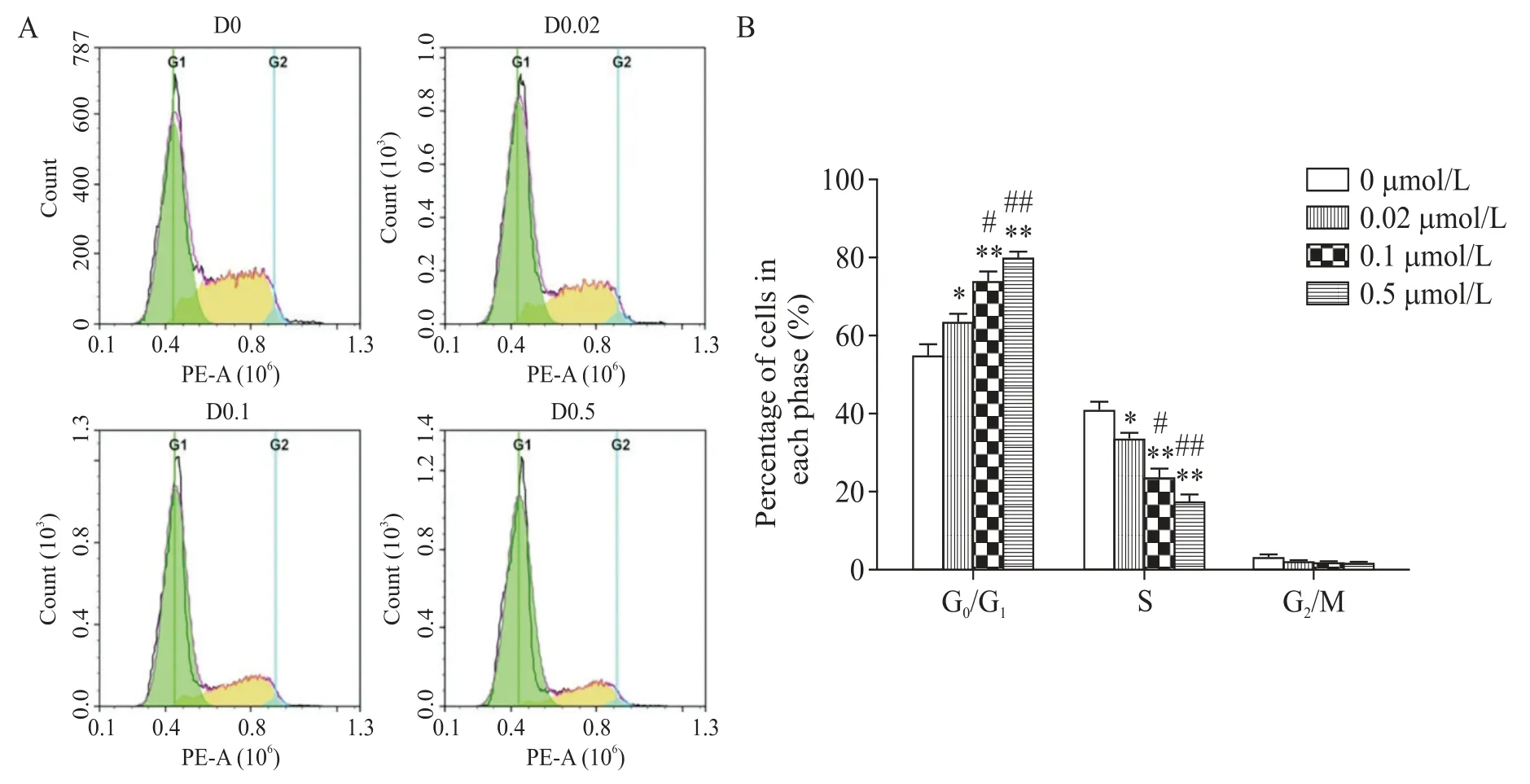
Figure 4.Dasatinib induced cell cycle arrest of 786-O cells.Propidium iodide(PI)staining method was used to detected the cell cy⁃cle(A)and the data was showed with a statistical histogram(B).D0:0 μmol/L dasatinib;D0.02:0.02 μmol/L da⁃satinib;D0.1:0.1 μmol/L dasatinib;D0.5:0.5 μmol/L dasatinib.Mean±SD. n=3.*P<0.05,**P<0.01 vs 0 μmol/L group;#P<0.05,##P<0.01 vs 0.02 μmol/L group.图4 达沙替尼诱导786-O细胞周期阻滞
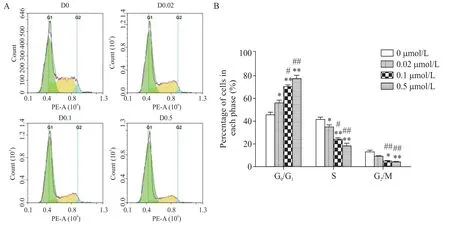
Figure 5.Dasatinib induced cell cycle arrest of 769-P cells.Propidium iodide(PI)staining method was used to detected the cell cy⁃cle(A)and the data was showed with a statistical histogram(B).D0:0 μmol/L dasatinib;D0.02:0.02 μmol/L da⁃satinib;D0.1:0.1 μmol/L dasatinib;D0.5:0.5 μmol/L dasatinib.Mean±SD. n=3.*P<0.05,**P<0.01 vs 0 μmol/L group;#P<0.05,##P<0.01 vs 0.02 μmol/L group.图5 达沙替尼诱导769-P细胞周期阻滞
4 达沙替尼促进786-O及769-P凋亡
达沙替尼处理24 h后,进行Hoechst 33258染色,从图6A 可以看出对照组绝大部分细胞胞核呈光滑圆形,胞核染色较均一,为正常细胞;各实验组可见不同比例的凋亡细胞,即胞核碎片化,因DNA 浓缩致密而深染(蓝色发白),并随着达沙替尼浓度的增大,凋亡细胞的比例逐渐增大(P<0.01),见图6B。
5 达沙替尼对786-O 及769-P 细胞周期和凋亡相关蛋白的影响
达沙替尼处理24 h 后,各实验组凋亡相关蛋白cleaved caspase-3 和cleaved caspase-9 的蛋白表达量相对于对照组显著增加(P<0.01);同时,cyclin D1的表达量均较对照组下降(P<0.01),周期相关通路蛋白p53和p21表达量均较对照组增加(P<0.01),p-AKT水平则较对照组减少(P<0.01),见图7、8。
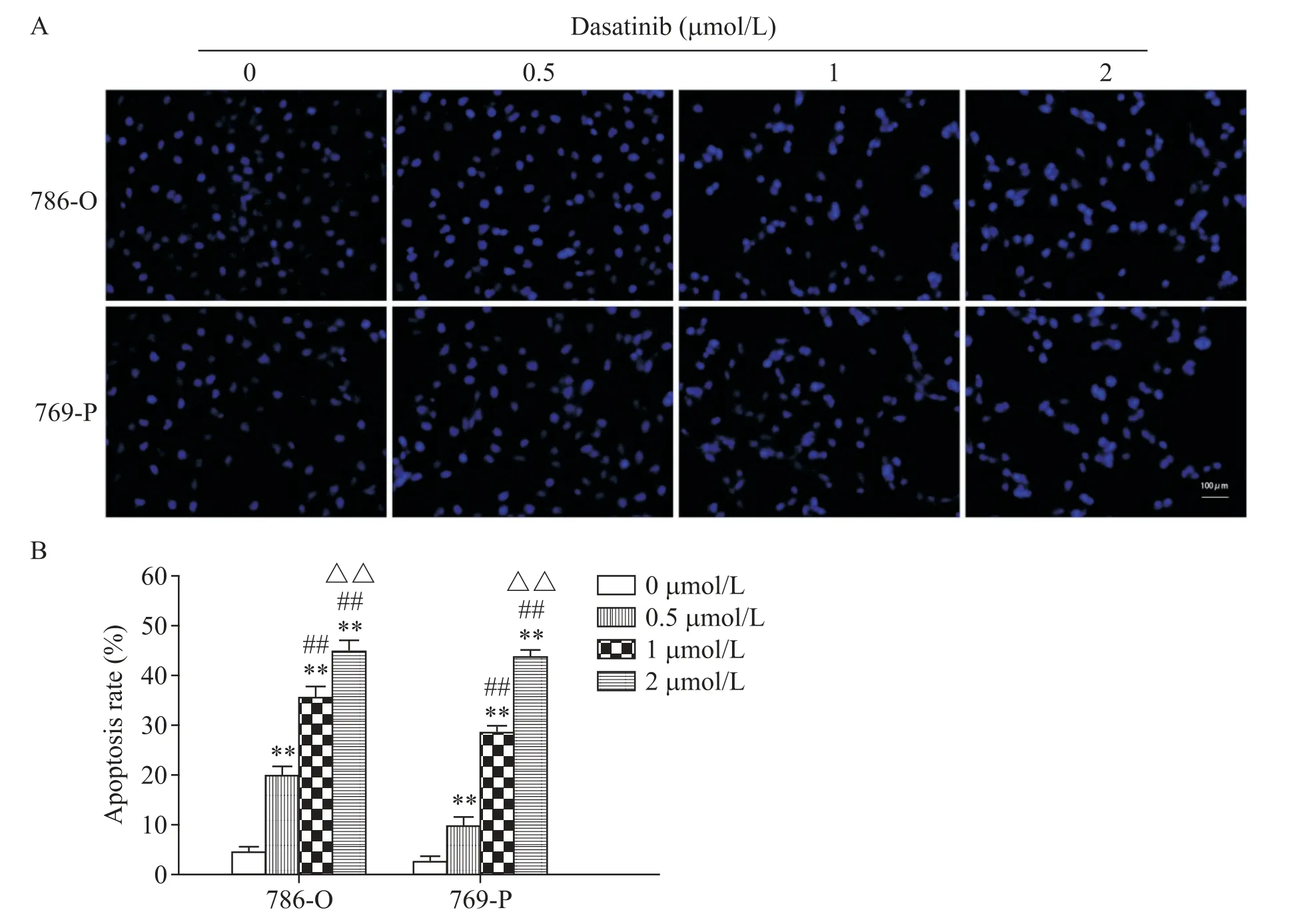
Figure 6.Dasatinib promoted the apoptosis of 786-O cells and 769-P cells in vitro.Hoechst 33258 staining was used to detected the apoptosis(A,scale bar=100 μm)and the data was showed with a statistical histogram(B).Mean±SD. n=3.**P<0.01 vs 0 μmol/L group;##P<0.01 vs 0.5 μmol/L group;△△P<0.01 vs 1 μmol/L group.图6 达沙替尼在体外促进786-O和769-P细胞凋亡
讨 论
本研究结果显示达沙替尼在一定范围内呈浓度依赖性地抑制肾癌细胞株786-O 和769-P 的活力与迁移,并诱导凋亡,该结果提示了达沙替尼在治疗肾癌方面存在深入研究意义。本研究进一步分析显示,达沙替尼作用于肾癌细胞株786-O 和769-P 的机制与降低AKT 的磷酸化水平、上调cleaved caspase-3和cleaved caspase-9 蛋白水平有关。已有研究资料显示,在肾细胞癌中存在突变的VHL以及异常活化的VEGF 和PDGF 等,它们则导致细胞生长与存活关联蛋白AKT 活性异常增加,促进瘤细胞发生发展[7]。而且RCC 中VHL-HIF 和PI3K-AKT 信号通路紧密相连:VHL缺失而引起的HIF上调促进了多种生长因子的表达,包括EGF,PDGF 和VEGF[8],这些因子则通过受体酪氨酸激酶途径激活PI3K/AKT 信号,再激活mTORC1 和mTORC2 会促进HIF 表达[9],形成正反馈回路,促进RCC 的发生发展。本研究结果不仅与上述研究资料相呼应,而且也进一步印证了达沙替尼的药理作用,如研究报道其通过抑制SRC 影响PI3KAKT 和Ras-MAPK 途径,诱导鼻咽癌细胞凋亡[10]。已有资料报道,PI3K 信号通路抑制剂对于PI3K-AKT通路被高度激活的RCC 显示出有益的临床效果[11]。所以,本研究结果提示达沙替尼可通过抑制PI3KAKT信号通路发挥抗肾癌细胞潜力。
由于达沙替尼是多种激酶的TKI 药物,本研究也探讨了其它作用途径。p53 功能的丧失是肾细胞癌发展的关键事件,与细胞周期和肿瘤细胞转移相关[12]。本研究结果检测到达沙替尼可使肾癌细胞胞内p53 和p21 表达量增加,进而下调cyclin D1 的表达,使肾癌细胞周期阻滞于G1期,抑制肾癌细胞增殖,该结果证实了其可以通过p53 途径影响细胞周期、抑制细胞生长,说明其药理作用的多样性,同时提示其某些特殊情况的应用前景。已有临床研究表明,达沙替尼在体内可降低肾癌患者血清VEGF 的水平,说明其具有抑制癌内血管生长作用[13]。此外,在犬模型的研究中显示,达沙替尼通过抑制c-SRC并增强Wnt 和HER 信号转导,从而阻滞乳癌细胞的迁移和转移[14]。本研究体外实验结果也证实达沙替尼可阻滞786-O 和769-P 细胞的迁移,提示达沙替尼抑制肾癌细胞转移的可能性。
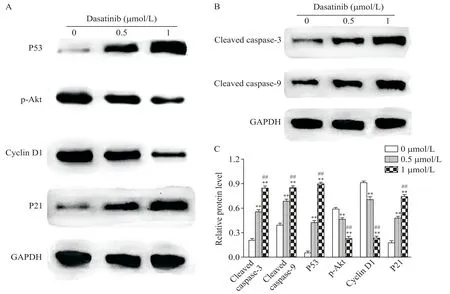
Figure 7.The effect of dasatinib on the levels of cell cycle-related(A)and apoptosis-related(B)proteins in 786-O cells.The electro⁃phoresis strips´ gray scale values were showed with a histogram(C).Mean±SD. n=3.**P<0.01 vs 0 μmol/L group;##P<0.01 vs 0.5 μmol/L group.图7 达沙替尼对786-O细胞周期和凋亡相关蛋白表达的影响
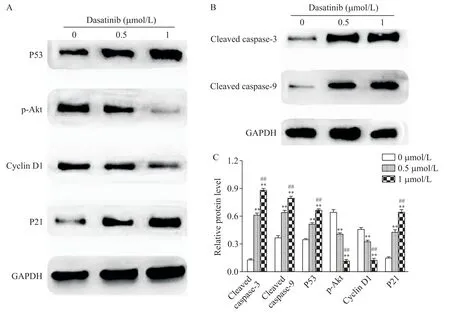
Figure 8.The effect of dasatinib on the levels of cell cycle-related(A)and apoptosis-related(B)proteins in 769-P cells.The electro⁃phoresis strips´ gray scale values were showed with a histogram(C).Mean±SD. n=3.**P<0.01 vs 0 μmol/L group;##P<0.01 vs 0.5 μmol/L group.图8 达沙替尼对769-P细胞周期和凋亡相关蛋白表达的影响
达沙替尼最初用于血液髓系肿瘤的治疗,目前逐步用于部分实体瘤的治疗[15]。本研究则在体外细胞水平观察了达沙替尼抑制肾癌细胞活力与迁移,提示了其治疗肾癌应用的可能性。但是需要进一步的体内实验和临床试验才能验证其治疗肾癌的有效性和可行性。
