lncRNA LINC01206调控银屑病角质形成细胞的功能研究
2021-11-27林静霞张芳菲张泽乔钟远秋陈永锋
林静霞, 张芳菲, 张泽乔, 钟远秋, 陈永锋
南方医科大学皮肤病医院,广东 广州 510091
银屑病(psoriasis)是一种有遗传背景的由免疫异常介导的慢性红斑鳞屑性皮肤病[1],主要表现为免疫系统激活引起的细胞炎症反应以及角质形成细胞的异常增殖和分化[2],目前其发病机制研究仍不完善。全基因组关联研究表明,大量的易感基因座位于人类基因组的非编码区[3],表明非编码区在银屑病的进程中发挥着重要作用。长链非编码RNA(long non-coding RNA, lncRNA)是一类新的具有调控功能的RNA,可参与包括细胞增殖、分化、凋亡、发育和免疫反应在内的多种生物学过程[4],在基因水平、转录水平和蛋白质水平等多方面影响疾病的发生发展[5]。目前基于转录组测序数据的差异表达研究,利用加权基因共表达网络分析(weighted gene co-expression network analysis,WGCNA),可发现大量lncRNA在银屑病患者皮损组织中异常表达,并可能作为银屑病的新易感位点[6]。lncRNA在调控银屑病发病的关键通路中发挥着重要作用,具有潜在的研究意义[7]。因此,本研究通过分析银屑病转录组数据集,探讨细胞周期的lncRNA异常与银屑病发病的关系,为进一步揭示lncRNA在银屑病细胞周期中的作用机制提供理论基础和依据。
1 材料与方法
1.1 材料
1.1.1 数据来源 本研究分析数据均来源于GEO数据库,包括两个数据集GSE54456和GSE63979,其中正常对照组90个,银屑病皮损组99个,共189个样本。
1.1.2 试剂和仪器 DMEM基础培养基(Thermo Fisher),PBS缓冲液(Thermo Fisher),胰酶(Thermo Fisher),siRNA(锐博生物),转染试剂盒(锐博生物),细胞周期试剂盒(联科生物)。生物安全柜(新加坡ESCO公司),细胞培养箱(新加坡ESCO公司),离心机(Thermo),流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 信号通路富集分析 通过DEseq2分析来自GEO数据库的银屑病皮损组织转录组数据集,筛选银屑病组与健康对照组差异表达的基因。筛选条件为log2FC绝对值>2、P<0.05,并构建基因表达矩阵[8]。采用DAVID功能注释对在银屑病中差异表达上调的基因进行基因功能富集分析,KEGG信号通路设定P<0.05,并采用GSEA 软件包进行分析[9]。
1.2.2 加权基因共表达网络分析 利用WGCNA构建基因共表达网络[10],去除弱共表达基因对,邻接阈值高于0.02,并与至少一个lncRNA分子相互作用,形成lncRNA-蛋白编码基因共表达网络[11]。
1.2.3 siRNA干扰 将HaCaT细胞培养至30%~50%的浓度,然后用50 nM siRNA转染48 h。操作按试剂盒说明书进行。
1.2.4 流式细胞术分析细胞周期 将HaCaT细胞接种到6孔板中,培养至30%~50%的浓度,然后转染siRNA 48 h。收集细胞,用PBS缓冲液洗涤,在4 ℃的70%乙醇中固定过夜。在37 ℃下用RNase A去除RNA 30 min。最后,在室温下用碘化丙啶(PI)染色30 min,并在流式细胞仪上进行分析。
1.2.5 统计学处理 采用SPSS 22.0软件进行统计分析,数据以三个独立实验的均数±标准差表示。siRNA干扰LINC01206的HaCaT细胞与对照组HaCaT细胞的细胞周期中G0/G1期、G2/M期和S期等的细胞数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 银屑病差异表达基因富集于细胞周期通路
通过整合分析银屑病转录组数据集与健康对照组的差异表达基因,筛选出1 319个在银屑病中差异表达上调的基因(图1A)。对银屑病皮损中表达上调的基因进行KEGG信号通路富集分析,表明其主要富集在趋化因子信号通路以及细胞周期通路等(图1B)。基因集合富集分析结果显示,银屑病皮损中细胞周期通路表达升高,且P<0.01(图1C),说明银屑病中存在细胞周期的失调。

图1 细胞周期的失调与银屑病有关 1A:银屑病差异表达基因火山图;1B:银屑病中表达上调基因KEGG信号通路富集分析;1C: 在GSEA基因集合富集分析中,细胞周期通路信号升高
2.2 lncRNA与细胞周期相关基因共表达
筛选与银屑病细胞周期通路相关的差异表达的lncRNA(图2A),利用WGCNA构建lncRNA与蛋白编码基因共表达网络,结果显示在细胞周期通路中,有9个 lncRNA与14个蛋白编码基因有关联(图2B)。通过提取细胞周期相关lncRNA在对照组及银屑病皮损组的表达量,分析结果显示LINC01206在银屑病皮损组织中表达倍数最高,且有统计学差异(表1)。结合共表达网络分析结果表明,LINC01206可通过与细胞周期通路中的关键基因CCNB1和CCNE1等的相互作用参与银屑病进程。

表1 细胞周期通路相关的差异表达的lncRNA
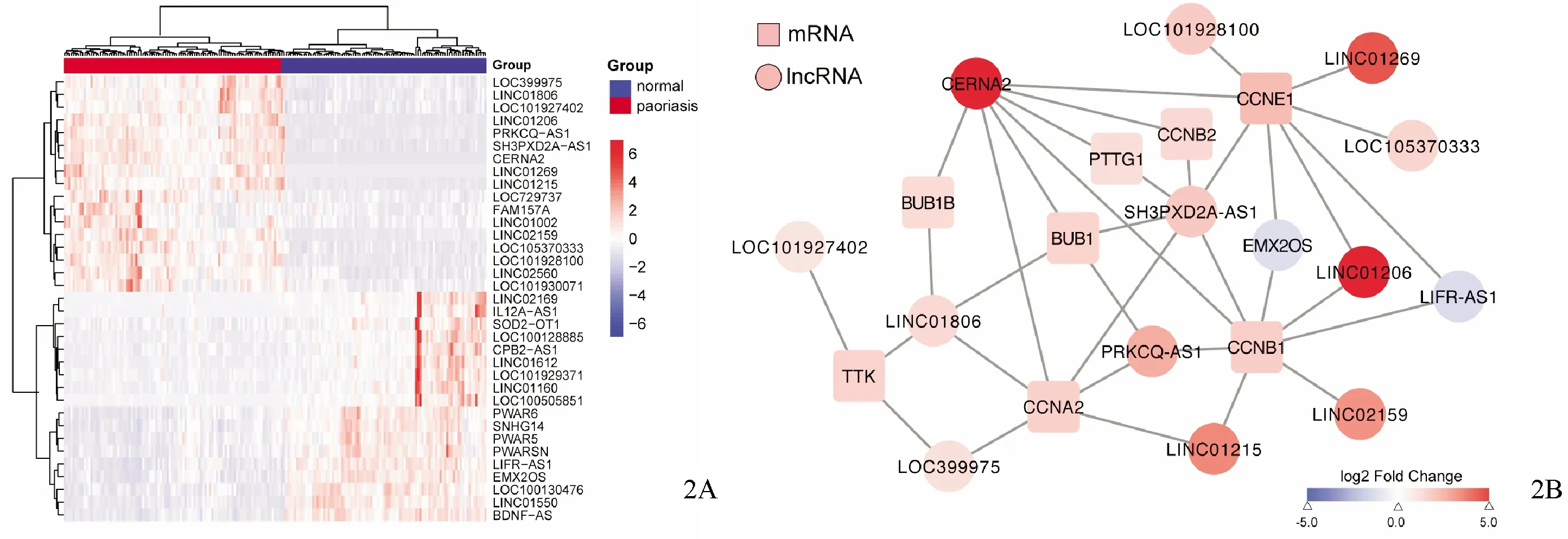
图2 lncRNA参与银屑病细胞周期进程 2A:热图显示对照组与银屑病皮损中与细胞周期通路有关联的lncRNA的差异表达情况;2B:加权基因共表达网络分析构建细胞周期通路中lncRNA与蛋白编码基因的共表达网络
2.3 siRNA敲低LINC01206的表达引起细胞周期G2/M期的阻滞
通过在HaCaT细胞中转染50 nM siRNA干扰LINC01206的表达,并使用流式细胞术检测培养48 h后HaCaT细胞的细胞周期分布,结果显示siRNA敲低HaCaT细胞中LINC01206的表达,会引起细胞周期G2/M期的阻滞(图3A~3C),提示lncRNA可以调控HaCaT细胞的细胞周期过程。

图3 siRNA敲低LINC01206的表达引起细胞周期G2/M期的阻滞 3A、3B: 流式细胞术检测对照组(3A)及siRNA干扰LINC01206组(3B)的HaCaT细胞周期;3C: 细胞周期各时期细胞数统计
3 讨论
lncRNA参与了从基因表达到蛋白质翻译和保持蛋白质稳定等细胞生命过程,在发育、机体内平衡和维持细胞命运中发挥重要作用[4]。本研究结果证实了lncRNA失调与多种细胞信号通路相关,并在银屑病的发病机制中发挥重要作用[12]。银屑病角质形成细胞转录组分析研究表明,银屑病病变与免疫反应、细胞角质化及细胞周期等多种途径有关[13]。细胞周期对于细胞生命过程至关重要,其参与分裂细胞中的增殖、分化和凋亡[14]。细胞的正常分裂依赖于调节细胞周期阶段时间顺序的检查点,包括 G1/S、G2/M和中期/后期转变[15]。目前已有多项研究表明,lncRNA通过多种途径参与细胞周期进程的调控[16]。如lncRNA DLEU2通过抑制p53表达来促进细胞周期进程并抑制Notch信号通路的活性,从而促进宫颈癌细胞的增殖[17];而lncRNA PLAC2可通过抑制STAT1核转移降低RP36表达,从而阻断神经胶质瘤中的细胞周期进程[18]。同时也有研究显示,通过敲低lncRNA MIR31HG可导致HaCaT细胞G2/M期的细胞周期停滞,影响细胞增殖[19]。这提示lncRNA可通过调控银屑病细胞周期来发挥功能。
本研究通过KEGG信号通路富集分析发现,银屑病上调的基因富集在细胞周期通路中;lncRNA与细胞周期蛋白编码基因共表达网络分析显示,LINC01206、LINC01269、LINC01215和LINC02159等通过与细胞周期信号通路关键基因CCNA2、CCNB1和CCNE1的相互作用调控银屑病进程。表明lncRNA可能通过与RNA结合蛋白相互作用来参与银屑病细胞周期的调控[20]。同时,lncRNA与蛋白编码基因共表达网络分析结果提示,LINC01206通过作用于细胞周期检查点相关基因CCNB1和CCNE1来调控银屑病进程。为深入了解lncRNA在银屑病细胞周期中的功能,本研究通过小干扰RNA在HaCaT细胞中敲低细胞周期通路中差异表达最明显的LINC01206,并采用流式细胞术检测HaCaT细胞的细胞周期进程,结果显示,LINC01206表达的降低将引起HaCaT细胞周期G2/M期的阻滞,表明lncRNA可能通过介导HaCaT细胞周期、调控细胞生命过程参与银屑病发病。
综上所述,银屑病病变引起lncRNA的差异表达,而lncRNA的表达变化能够作用于细胞周期,并导致细胞周期检查点的失调,从而影响银屑病的进程。因此,对银屑病细胞周期中差异表达lncRNA的研究,将有助于解释银屑病发病过程中角质形成细胞异常增殖的机制,为进一步阐明lncRNA在银屑病中的生物学功能以及在银屑病发病机制中的调控作用提供新的理论依据,提示细胞周期中的lncRNA将有望成为银屑病治疗的新药物靶点。
