大蒜素对白色念珠菌毒力因子作用机制的研究
2020-12-13熊延靖吴艳红
熊延靖,吴艳红,陈 京
(皖南医学院,医学微生物学与医学免疫学教研室,安徽芜湖 241002)
白色念珠菌Candida albicans是常驻于人体内的一种条件致病性真菌。目前随着抗癌药物、HIV感染、免疫抑制剂的大量使用等引起的免疫功能下降,以及侵入性治疗如血透、插管技术等广泛应用,均可能造成全身或局部真菌感染。据相关统计,侵袭性念珠菌病在全球范围内已达25万人/年,死亡案例超过5万[1],并且已成为重症监护室重症感染的首要病因[2]。由于抗真菌药物本身的不良反应,同时药物的不合理应用导致的耐药问题亦日趋严重[3],给抗感染治疗带来巨大挑战。因此,寻找新型高效、广谱、低毒的抗真菌药物具有重要意义。
大蒜素是从百合科植物大蒜Allium sativumL.的鳞茎中提取的含硫有机化合物的主要有效成分[4]。研究显示大蒜素对多种细菌、真菌、病毒和寄生虫等均具有良好的抑制作用,被誉为天然广谱抗生素药物[5]。本研究旨在探讨大蒜素对白色念珠菌毒力因子的作用机制,以期阐明大蒜素的抗真菌作用机制,为丰富大蒜素的临床应用奠定科学基础;同时拓宽大蒜素的应用价值,加快传统中医药的发展。
1 材料
1.1 供试菌株 白色念珠菌标准菌株:AX2-2086,购自广州市微生物研究所。临床分离念珠菌4株,CA1、CA2、CA3、CA4。经科玛嘉念珠菌显色培养基和酵母样真菌鉴定卡鉴定为白色念珠菌。所有菌株均连续在改良沙氏固体培养基中接种2次,保持菌株活力,4 ℃保存备用。
1.2 试剂与药物 二甲基亚砜 (DMSO,美国Sigma公司,批号D2650);RPMI-1640培养基(批号 BL303A)、PBS磷酸盐缓冲液 (批号BL302A)(北京Biosharp公司);葡萄糖 (批号F20190509)、甘露醇(批号20190321)(国药集团化学试剂有限公司);蛋白胨(北京Solarbio公司,批号P8450);营养肉汤(北京Solarbio公司,批号N8300);琼脂粉(北京奥博星生物技术有限责任公司,批号01-023);卵黄乳液(青岛海博生物技术有限公司,批号HB8295);科玛嘉念珠菌显色培养基(批号CA220)、酵母样真菌鉴定卡(批号21343)(法国-生物梅里埃公司)。RNA提取试剂盒(美国Omega公司,批号R6870-01);逆转录试剂盒(日本TaKaRa公司,批号RR047A);qRTPCR试剂盒 (瑞士 Roche公司,批号6402712001);引物(上海生工生物工程有限公司合成)。大蒜素(江苏正大清江制药有限公司,国药准字H32025683,批号190307)。
1.3 仪器 BECKMAN Allegra 64R高速冷冻离心机(美国贝克曼公司);THERMOFISHER IMH100隔水式电热恒温培养箱(美国Thermofisher公司);微量培养板 (96孔、6孔;美国Coring公司);ESCO CLASSⅡBSC生物安全柜(新加坡艾斯克公司);ZQZY-VS2恒温振荡培养箱(上海知楚仪器有限公司);ELGA Purelabflex 2纯水机(英国埃尔格公司);FA2004型电子分析天平(上海良平仪器仪表有限公司);双目显微镜、倒置显微镜(日本Olympus公司);BioDrop核酸蛋白分析仪(英国柏点公司);Biotek Eon全波长酶标仪(美国伯腾仪器有限公司);Roche lighelycler 96荧光定量PCR仪(瑞士罗氏公司)。
1.4 培养基制备
1.4.1 改良沙氏培养基 葡萄糖40 g、蛋白胨10 g,加入双蒸水定容至1 L,112 ℃高压灭菌15 min,待培养基冷却至50 ℃左右时加入青霉素20 U/mL、链霉素40 U/mL,即为改良沙氏液体培养基。若制备改良沙氏固体培养基,则在上述改良沙氏液体培养基中加入琼脂20 g再高压灭菌。4 ℃保存备用。
1.4.2 Spider培养基 营养肉汤10 g、甘露醇10 g、K2HPO42 g,加入双蒸水定容至1 L,调整培养基pH 7.2 (25 ℃),121 ℃高压灭菌20 min,4 ℃保存备用。
1.4.3 卵黄乳液琼脂培养基 NaCl 5.73 g、蛋白胨1 g、葡萄糖3 g、CaCl20.055 g、琼脂粉2 g,加入双蒸水定容至100 mL。121 ℃高压灭菌20 min,待高压锅温度降至70 ℃时,立即取出并加入10%卵黄乳液混匀。在培养基中分别加入不同浓度大蒜素(终浓度为1/4 MIC、1/2 MIC、1 MIC、2 MIC、4 MIC),混匀后分装至无菌培养皿,4 ℃保存备用。
2 方法
2.1 菌液制备 将白色念珠菌标准菌株和临床菌株分别接种于改良沙氏固体培养基中,37 ℃培养48 h后,挑取培养基中单克隆菌落,转种至5 mL改良沙氏液体培养基,于37 ℃、200 r/min振荡培养16 h,使白色念珠菌处于对数生长期。经麦氏比浊管及血细胞计数板计数,以RPMI-1640培养液将菌液调整至浓度为2×106CFU/mL,4 ℃保存备用。
2.2 药液制备 将大蒜素溶解于DMSO中,再用RPMI-1640培养液作倍比稀释,使其质量浓度依次为800、400、200、100、50、25、12.5、6.25 μg/mL。4 ℃保存备用。
2.3 大蒜素对白色念珠菌的最低抑菌浓度(MIC)测定 按照美国临床和实验室标准化研究所(CLSI)推荐的真菌敏感性检测方法CLSI-M27-A3[6],采用微量液基稀释法中的操作步骤进行并略作改良。
用RPMI-1640培养液将白色念珠菌菌液浓度稀释至2×103CFU/mL。将上述浓度的大蒜素依次加入96孔微量培养板中,每孔100 μL,并设生长对照孔(RPMI-1640培养液100 μL+菌液100 μL,无大蒜素)和空白对照孔 (RPMI-1640培养液200 μL,无菌液,无大蒜素),每个浓度均设3复孔。将配制好的菌液加入相应孔中,每孔100 μL,使得每一梯度药液和菌液分别被1 ∶1稀释至终浓度。将96孔微量培养板置37 ℃温箱静置培养48 h后观察结果。以上实验在不同时间重复3次。
结果判断采用视觉法,肉眼观察孔内菌株生长情况,与不含药物的空白对照孔比较,观察到生长完全抑制、培养基清亮所对应的最低药物浓度为MIC。
2.4 白色念珠菌时间-杀菌曲线 采用不同时间点取样点板计数的方法绘制大蒜素对白色念珠菌的时间-杀菌曲线。选取白色念珠菌标准菌株AX2-2086和临床菌株CA2为试验菌株(下同)。具体实验操作步骤为:取对数生长期的白色念珠菌,用沙氏改良液体培养基稀释菌液浓度为2×106CFU/mL。以各试验菌株的MIC值为依据,设置大蒜素终浓度依次为 1/4 MIC、1/2 MIC、1 MIC、2 MIC、4 MIC。将白色念珠菌菌液2 mL加入无菌试管中,再依次加入不同浓度大蒜素。同时设立不加药物的空白对照组。混匀后置37 ℃,200 r/min恒温振荡培养。分别于培养0、2、4、8、12、24 h时取10 μL菌液按10倍倍比稀释,取100 μL稀释液均匀涂布于改良沙氏固体培养基上。37 ℃培养48 h后计算菌落数目。以时间点为横轴,以不同时间点生长的菌落数的对数为纵轴,绘制时间-杀菌曲线。
2.5 大蒜素对白色念珠菌形态转化的影响 检测大蒜素对白色念珠菌标准菌株AX2-2086和临床菌株CA2在Spider液体培养基中形态转化能力的影响。用Spider液体培养基将白色念珠菌稀释至2×106CFU/mL。将菌液和不同浓度大蒜素分别加入6孔板中,大蒜素终浓度分别为1/4 MIC、1/2 MIC、1 MIC、2 MIC、4 MIC。同时设立不加药物的空白对照孔。37 ℃静置孵育6 h。取出孔板,在倒置显微镜明场下观察白色念珠菌菌丝形成情况并拍照。
2.6 qRT-PCR检测大蒜素对菌丝相关基因表达的影响
2.6.1 总RNA提取 将大蒜素与菌液混匀,置37 ℃静置培养24 h后,收集菌体,用无菌PBS缓冲液清洗3次后提取总RNA,按照试剂盒说明书进行。
2.6.2 引物设计与合成 所用引物序列见表1,由上海生工生物工程有限公司合成。

表1 qRT-PCR引物序列Tab.1 Primer sequence for qRT-PCR
2.6.3 cDNA制备 根据TaKaRa PrimeScriptTMRT reagent Kit说明书操作。第一步,RNA 1 μg,5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,加RNase Free dH2O至10 μL,反应条件为42 ℃2 min;第二步,取第一步反应液10 μL,Master Mix 10 μL,反应条件为37 ℃15 min,85 ℃5 sec。
2.6.4 实时荧光定量PCR反应 按照试剂盒说明,制备反应体系见表2。将所有试剂加好后,置于荧光定量PCR仪中进行反应,反应条件为预变性95 ℃600 s;扩增定量程序为95 ℃10 s,60 ℃15 s,72 ℃20 s,扩增程序为45个循环;熔解曲线65~95 ℃。每个样品平行3次。

表2 RT-PCR反应体系Tab.2 Reaction system of RT-PCR
2.6.5 定量分析 qRT-PCR分别测定的目的基因和内参基因的CT值,将实验结果取平均值,计算并统计。最后基因表达水平用2-△△CT法进行分析。
2.7 大蒜素对白色念珠菌细胞外磷脂酶活性的影响 分别取白色念珠菌标准菌株AX2-2086和临床菌株CA2的菌液(1×107CFU/mL)1 μL,滴加在含有不同浓度大蒜素(终浓度为1/4 MIC、1/2 MIC、1 MIC、2 MIC、4 MIC)的卵黄乳液琼脂培养基中,同时设置不加药物的空白对照组。将培养基置37 ℃培养4 d后,白色念珠菌在平板上形成菌落,并在菌落周围形成乳黄色不透明的沉淀圈。实验重复3次。用游标卡尺测定菌落直径和沉淀圈(含菌落)直径。细胞外磷脂酶活性用Pz表示,Pz=d1/d2,其中,d1为菌落直径,d2为沉淀圈直径。 Pz值越小,表明磷脂酶活性越强,反之则活性越弱。
2.8 统计学分析 所有数据应用SPSS 21.0统计软件进行分析处理,计量资料以()表示,组间差异比较采用单因素方差分析检验,P<0.05为差异具有统计学意义。
3 结果
3.1 大蒜素对白色念珠菌的MIC值 采用CLSIM27-A3推荐的微量稀释法,经过3次重复体外药物敏感性试验,大蒜素对白色念珠菌标准菌株AX2-2086的MIC为25 μg/mL。对于临床分离菌株,大蒜素的MIC为12.5~25 μg/mL。结果见表3,表明,大蒜素对白色念珠菌具有良好的抑菌作用。后续选用白色念珠菌标准菌株AX2-2086和临床菌株CA2作为试验菌株。

表3 大蒜素对白色念珠菌的MIC值(μg/mL)Tab.3 MIC values of allicin to C.albicans(μg/mL)
3.2 大蒜素对白色念珠菌的时间-杀菌曲线 时间-杀菌曲线可以反映各时间点药物的抑菌或杀菌作用。本实验通过计数平板上白色念珠菌单克隆菌落的数量,并根据稀释倍数计算出原始CFU。结果表明,2 MIC和4 MIC浓度的大蒜素对白色念珠菌保持有效的抑制作用,1 MIC浓度组也具有一定的抑制作用。但是1/4 MIC浓度组未显示明显抑制作用,这与大蒜素对白色念珠菌的MIC值结果基本相符,见图1。

图1 大蒜素对白色念珠菌的时间-杀菌曲线Fig.1 Time-kill curve of allicin against C.albicns
3.3 大蒜素抑制白色念珠菌的形态转化 菌丝是白色念珠菌最主要的致病因子之一,酵母相-菌丝相形态转化也是其生物被膜形成的重要一步[7]。通过倒置显微镜观察大蒜素对白色念珠菌菌丝形成的影响,结果见图2。在Spider液体培养基中,未经药物处理的白色念珠菌能在6 h内形成较长且密的菌丝,错综复杂,相互缠绕重叠。当加入1 MIC浓度大蒜素时,视野内可观察到菌丝长度明显变短,且与对照组比较数量明显减少。而4 MIC浓度则能够基本抑制菌丝的生长,镜下观察以酵母相细胞为主。这一现象表明,大蒜素可以抑制白色念珠菌由酵母相向菌丝相的转化,且这种抑制作用具有剂量依赖性,即随着药物浓度的升高,抑制作用更加明显。
3.4 大蒜素对白色念珠菌菌丝相关基因表达的影响 与空白对照组比较,经1 MIC、2 MIC和4 MIC浓度的大蒜素干预后,参与正向调控白色念珠菌菌丝生长的基因RAS1、 CDC35、 EFG1的表达均明显下降,而负向调控菌丝生长的基因PDE2的表达量增加,差异有统计学意义(P<0.05)。见图3,结果显示,大蒜素对白色念珠菌菌丝生长的作用机制可能是通过调节菌丝形成相关基因的表达,从而抑制菌丝的形成。
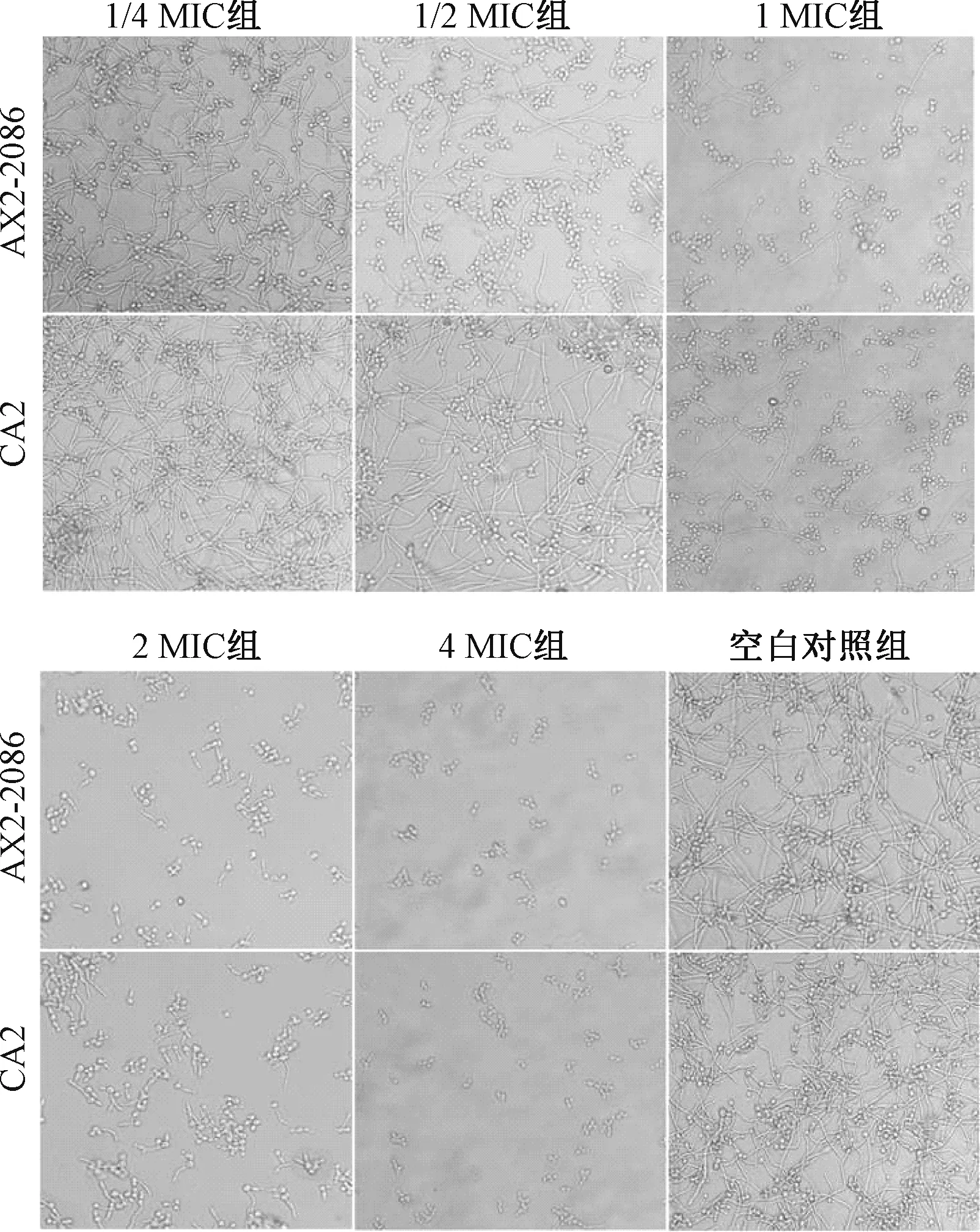
图2 大蒜素对白色念珠菌形态转化的影响(×400)Fig.2 Effect of allicin on morphological transition of C.albicans(×400)
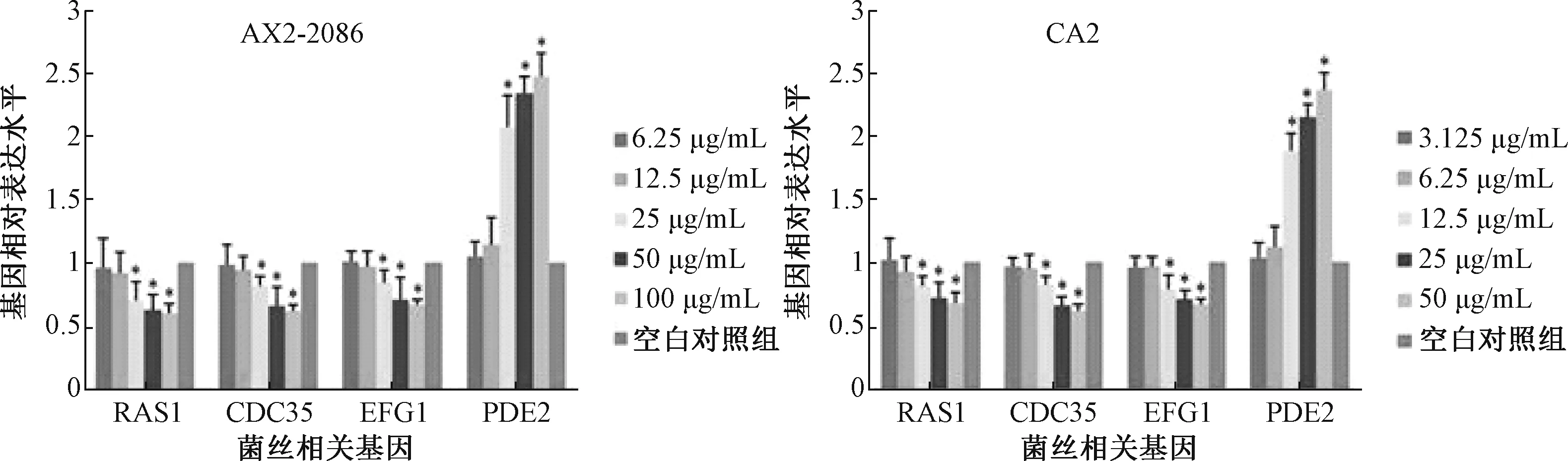
图3 大蒜素对白色念珠菌菌丝相关基因表达的影响Fig.3 Effect of allicin on gene expression of C.albicanshyphae
3.5 大蒜素抑制白色念珠菌细胞外磷脂酶活性卵黄乳液琼脂平板法是检测细胞外磷脂酶的经典方法[8]。在结果观察中,菌落直径代表菌细胞数目的多少,沉淀圈直径代表磷脂酶催化的沉淀产物的量,两者直径比值(Pz)可近似反映单位细胞数量的磷脂酶活性。 Pz越低,反映磷脂酶产生越多,活性越强。图4表明,白色念珠菌标准菌株AX2-2086和临床菌株CA2均能分泌较高活性的磷脂酶。加入浓度为1/4 MIC大蒜素未能明显改变磷脂酶活性,菌体仍能分泌活性较高的磷脂酶。当大蒜素浓度≥1/2 MIC时,与空白对照组比较,白色念珠菌细胞外磷脂酶的活性降低,Pz逐渐升高。结果表明,大蒜素可以抑制白色念珠菌细胞外磷脂酶的活性。
4 讨论
目前,应用于临床的抗真菌药物数量和种类有限,但是由于临床上有限抗真菌药物的大量使用,导致真菌耐药性的情况日益严重,而且出现交叉耐药现象[9]。其中白色念珠菌是临床最常见的条件致病性真菌。白色念珠菌在体内最主要的致病原因在于宿主免疫功能受损导致的不受控制的增殖。过度的增殖导致白色念珠菌毒力因子的释放,进而对机体造成危害[10]。白色念珠菌的毒力因子主要包括粘附、分泌酶、形态转化、生物被膜的形成等等。
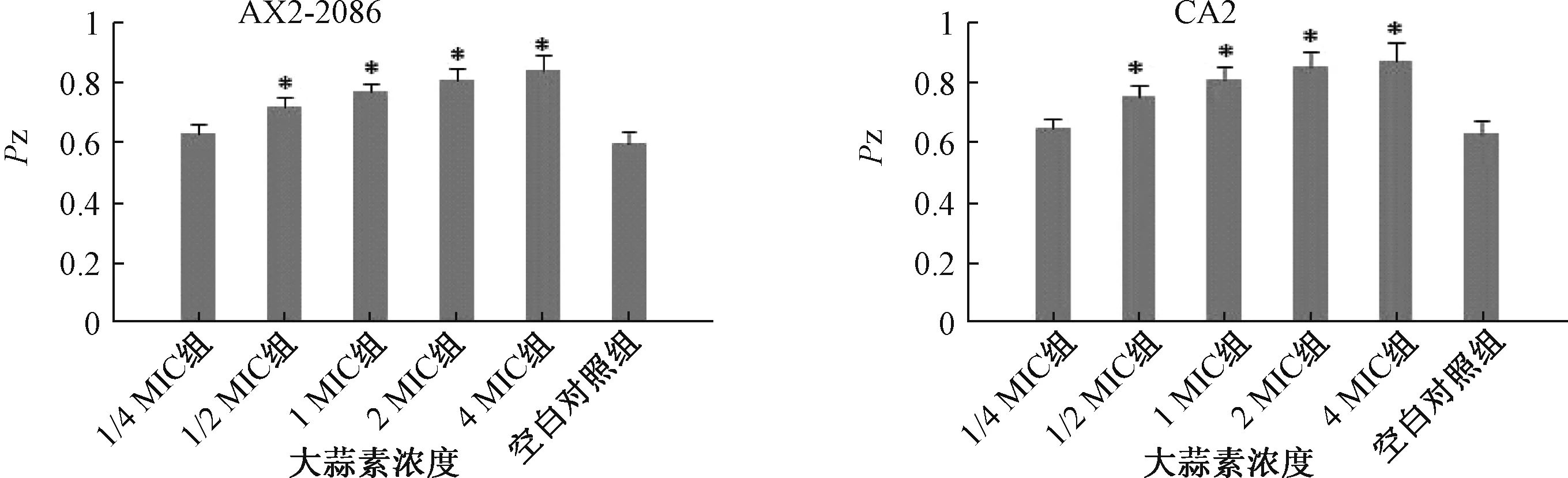
图4 大蒜素对白色念珠菌细胞外磷脂酶活性的抑制作用Fig.4 Inhibitory effect of allicin on the activity of phospholipase of C.albicans
在白色念珠菌的毒力因子中,形态转化是最主要也是最吸引注意力的一种。白色念珠菌是一种二相性真菌,从形态上分为酵母相和菌丝相。在相关诱导因素的刺激下,白色念珠菌能经历酵母相和菌丝相的相互转化。在被感染宿主体内的病灶部位,2种形态的白色念珠菌都能被发现。相关研究发现,在小鼠系统性感染中,多种菌丝形成缺陷的白色念珠菌突变体,其毒力是减弱的[11]。因此,如果能抑制白色念珠菌形态的转化,或许能抑制其毒力和感染性。
Spider培养基常被用来评估白色念珠菌维持菌丝生长的能力[12]。在本实验中,将白色念珠菌标准菌株AX2-2086和临床菌株CA2接种到Spider液体培养基中,镜下观察发现白色念珠菌形成细长的错综复杂的菌丝。加入大蒜素后可抑制菌丝的形成,甚至基本抑制白色念珠菌的形态转化,使其停留在酵母相。
Ras-cAMP-Efg1途径是调节白色念珠菌由酵母相到菌丝相转化的重要信号通路之一,其中第二信使cAMP是重要的调控分子。cAMP由Cdc35酶合成,Pde2酶降解[13]。基因EFG1编码的菌丝生长蛋白是目前研究最深入的多功能调节因子之一,它可以正向调节菌丝的形成过程,并在生物膜形成过程中起着中心作用[14]。为验证大蒜素对白色念珠菌菌丝形成的作用机制,实验进一步通过qRTPCR检测了菌丝相关基因的表达。结果显示,与空白对照组相比,大蒜素能够下调与菌丝形成正相关基因(RAS1、 CDC35、 EFG1),并上调菌丝形成负相关基因(PDE2)的表达。
细胞外磷脂酶是白色念珠菌重要的毒力因子之一,磷脂酶的高表达与小鼠播散性念珠菌病具有显著相关性,而磷脂酶缺陷的白色念珠菌突变体在小鼠系统性感染模型中的毒力是减弱的[15-16]。本实验通过卵黄乳液琼脂培养基测定大蒜素对白色念珠菌细胞外磷脂酶活性的作用,发现加入大蒜素后,白色念珠菌分泌磷脂酶活性降低,表明大蒜素能够有效地抑制白色念珠菌细胞外磷脂酶活性,从而发挥抗真菌作用。
综上所述,大蒜素可通过抑制白色念珠菌菌丝生长、调节菌丝相关基因的表达,以及抑制细胞外磷脂酶活性等,从而发挥抑制白色念珠菌毒力因子的作用。这将为拓宽大蒜素潜在的临床用途奠定了基础。但大蒜素对体内白色念珠菌毒力因子的干预效应尚有待于进一步揭示。
