普洱茶发酵过程中可培养微生物的群落结构分析
2020-10-29王桥美彭文书杨瑞娟赵苗苗蒋勋张军王兴华严亮
王桥美, 彭文书,杨瑞娟,赵苗苗,蒋勋,张军,王兴华*,严亮*
1(云南农业大学 植物保护学院,云南 昆明,650201)2 (普洱茶研究院,云南 普洱,665000)3(普洱市茶叶科学研究所,云南 普洱,665000) 4(滇西应用技术大学 普洱茶学院,云南 普洱,665000)5(云南农业大学 食品科学技术学院,云南 昆明,650201)
普洱茶产于我国云南地区,以云南大叶种[Camelliasinesis(Linn.) var.assamiea(Mastters) Kitmaura)晒青毛茶为原料,是经过渥堆发酵,在水分、温度、微生物作用等综合因素影响下形成的产品[1-2]。渥堆发酵过程中,许多微生物具有强大的降解多糖物质成分的能力[3],使得茶叶产生一系列的生物化学反应,形成香甜醇厚的独特风味[4-7]。可见微生物对普洱茶的品质有着决定性作用[8]。
普洱茶发酵微生物的研究历史是从20世纪80年代开始的,刘勤晋等[9]采用传统分离,形态学和生理生化鉴定法证实了细菌、酵母、霉菌和放线菌都参与了普洱茶的发酵。21世纪后,随着聚合物链式反应(polymerase chain reaction,PCR)分子生物学技术的兴起,周红杰等[10]和赵龙飞等[11]先后从发酵普洱茶中分离到了黑曲霉、酵母菌、米曲霉、根霉、灰绿曲霉和极少的细菌。杨瑞娟等[12]从渥堆发酵普洱茶中分离到大量嗜热细菌和放线菌。李雪玲等[13]研究了普洱茶传统渥堆发酵与发酵罐发酵中的微生物群落结构,结果表明发酵罐发酵过程中的微生物多样性显著低于渥堆发酵。这些结果说明渥堆发酵中的微生物丰富多样,受各种条件影响。
本研究利用传统培养技术对普洱茶各发酵阶段茶样(JC)、发酵室空间空气(KQ)、地面(DM)、茶原料(SC)的可培养微生物进行跟踪分离培养鉴定,并对纯培养菌种进行保存,建立普洱茶自然发酵菌种库,以期探明普洱茶渥堆发酵各阶段的优势微生物群落及其来源,为传统发酵工艺改进、人工接种发酵普洱茶、开发普洱茶新产品提供菌种资源和理论保障。
1 材料与方法
1.1 材料与试剂
本实验所用样品均采自普洱市茶叶科学研究所。LB、YEPD 和PDA培养基,广东环凯微生物科技有限公司;Taq聚合酶(TAKARA, 大连)、KOD酶(TOYOBO,日本)、引物(ITS1F,ITS4;F27,R1492;NL1F,LS2R),华大基因。
1.2 仪器与设备
MJ-150-Ⅰ型恒温培养箱,上海—恒科学仪器有限公司;JN-400i无菌均质器,宁波江南仪器厂;LDZX-50KB立式压力蒸汽灭菌,上海申安医疗器械厂;SW-CJ-2D超净工作台,苏州净化设备有限公司;YNGENE GBOX凝胶成像系统,北京博仪恒业科技发展有限公司;茶样取样器,北京化工大学。
1.3 试验方法
1.3.1 温湿度测定
在普洱茶渥堆发酵过程中,用探针式温湿度检测器插入距茶堆边缘1 m内的5个点的堆心处,持续监测发酵过程中的温湿度变化,在每次取样时读取温湿度检测器的数值,并测定茶样水分含量。
1.3.2 茶样采集
分别在发酵0、7、14、21,28、35、42 d时取发酵茶样进行微生物分离培养,同时采集茶原料(SC)、潮水样(即渥堆发酵前加入30%水的茶原料)、发酵室空气(KQ)、地面(DM)样品进行微生物的分离培养。
1.3.3 样品中微生物的分离培养及鉴定
微生物培养[14]:取10 g茶样,加入90 mL无菌水,均质器中拍打3 min,取上清液稀释至10-1、10-2、10-3、10-4、10-55个浓度梯度,将10-3、10-4、10-5浓度的液体100 μL涂布到PDA、YEPD和LB培养基中上,放入25、37、50、60 ℃培养箱培养24 h,待菌落长出后挑取单菌落划线培养,得单菌落用于菌种保存及鉴定。
菌种鉴定[15-16]:将纯化的菌株制成菌悬液,加入以下体系进行PCR扩增。PCR 体系(50 μL):10×Taq buffer 5 μL,2 mm dNTP mixture 5 μL,Taq酶(5.0 U/μL)1 μL,上游引物(10 μmol/L) 2 μL,下游引物(10 μmol/L)2 μL,菌悬液2 μL,水33 μL。真菌引物:上游引物ITS1F(CTTGGTCATTTAGAGGAAGTAA) 1 μL,下游引物ITS4(TCCTCCGCTTATTGATATGC)1 μL;细菌引物:上游引物F27(AGAGTTTGATCMTGGCTCAG)1 μL,下游引物R1492(TACGGYTACCTTGTTACGACTT) 1 μL。PCR反应条件:(1)预变性 94 ℃ 5 min;(2)变性96 ℃ 10 s;(3)复性(退火)50 ℃ 30 s;(4)延伸72 ℃ 2 min;步骤(2)~(4)循环35次;(5)72 ℃延伸10 min;(6) 4 ℃保温。将扩增产物送至广州华大基因测序,根据测序结果,用菌株的16S rRNA和ITS基因作为靶序列,在GenBank数据库中用BLAST程序搜索同源序列,挑选与靶系列最相近的参考菌株系列,查出相应微生物,完成菌种鉴定。
1.3.4 数据处理
将靶系列与NCBI中的已知序列进行比对,挑选与靶序列相似度最高的已知序列,用MEGA 5.1软件构建系统发育树。用Cytoscape-v3.6.1软件对发酵0、7、14、21、28、35和42 d茶样中可培养微生物的异同进行网络分析,同时对SC、JC、KQ和DM中的可培养微生物的异同进行网络关系分析。
2 结果与分析
2.1 普洱茶发酵过程中的堆温、湿度、水分含量变化趋势
温度、湿度及水分含量的变化趋势如图1所示。温度曲线图显示,发酵0~7 d堆心温度上升较快,第28天温度达到最高值57.1 ℃,而后开始缓慢下降。温度的这一变化趋势可能与微生物大量繁殖有关。何国藩等[17]的研究表明微生物代谢释放大量热量,使堆内温度急剧升高,通过翻堆,使温度产生变化,这种温度变化为微生物生长(35 ℃)和酶促反应(60 ℃)提供合适的条件[18]。温琼英等[19]的研究再次证明微生物新陈代谢释放的呼吸热是湿热作用的热源。含水质量分数变化趋势图显示,从0 d的34.3%到42 d的16.4%,随着发酵的进程,茶叶水分含量缓慢下降。这与发酵过程中微生物代谢及酶促化学反应对水分的消耗有关。在整个发酵过程中湿度变化曲线平稳,从0~35 d保持在96%~99.6%,42 d时,湿度降至87%,这与茶叶水分含量减少呈正相关。
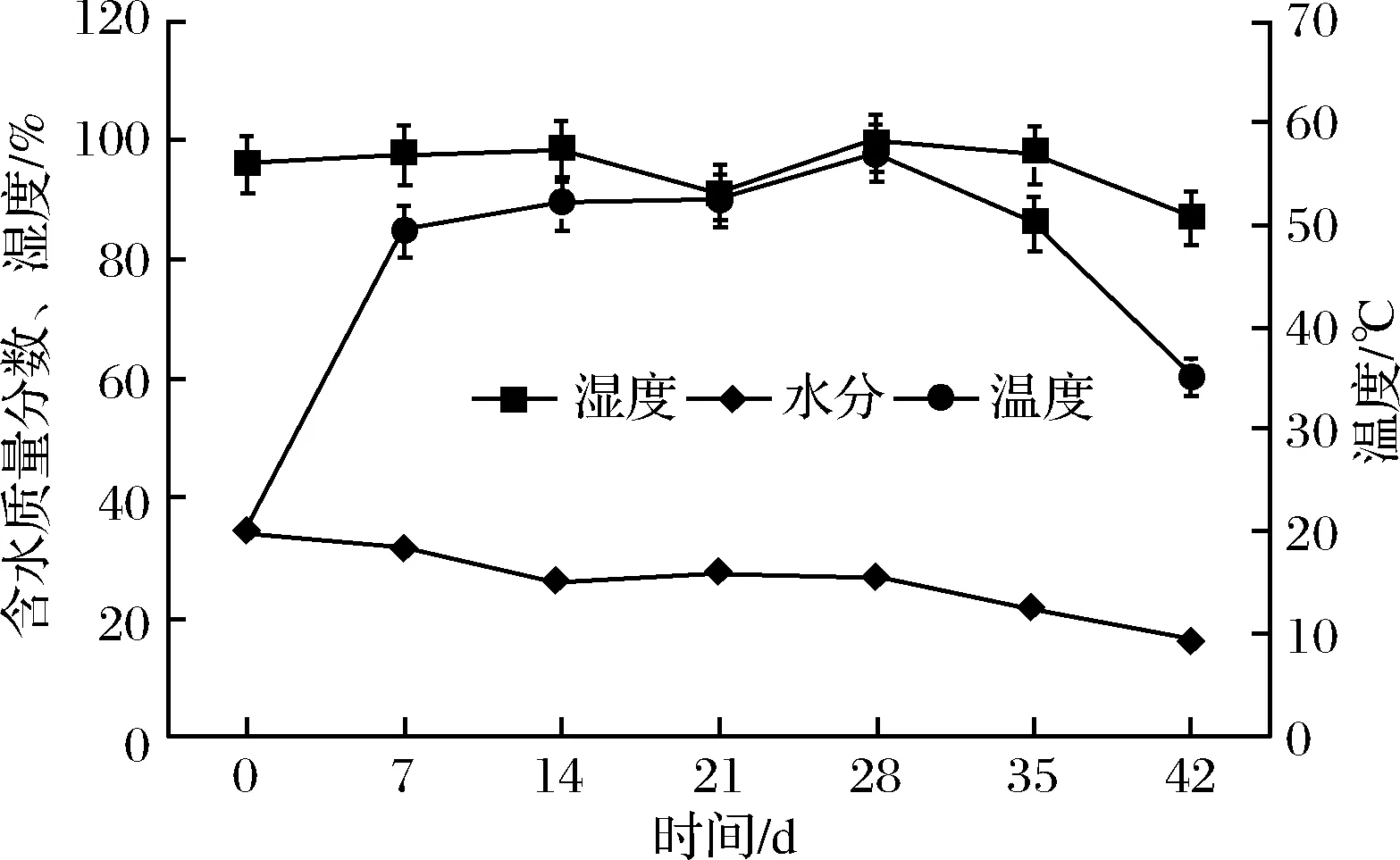
图1 普洱茶发酵过程中堆温、茶样水分含量和湿度的变化情况Fig.1 The temperature, moisture content and humidity of Pu-erh tea during fermentation
2.2 普洱茶发酵过程中可培养优势微生物的分离鉴定
分离到可培养细菌49株,去重后鉴定为14种,构建系统发育树如图2所示,菌株的分类信息如表1所示。14种细菌分属于Firmicutes(Bacillussp.、Geobacillussp.、Brevibacillussp.、Paenibacillussp.)和Actinobacteria(Isoptericolasp.、Corynebacteriumsp.、Kocuriasp.、Streptomycessp.、Brachybacteriumsp.)。其中Bacillussp.的种类最多。Bacillussubtilis、Bacillusthermoamylovorans、Streptomycesrecifensis为嗜热细菌[20],能在60 ℃的发酵高温存活。Corynebacteriumsp.和Streptomycessp.在以往研究中未见报道,此外,还分离到1株疑似新种,正在做新种鉴定。据前人报道[21-23],参与普洱茶发酵的微生物还有Lactobacillussp.、Staphylococcussp.和Microbacteriumsp.,本研究中没有分离到,可能是所选培养基不适合这些微生物生长,也可能与发酵条件不同有关。

图2 细菌16S rRNA基因的Neighbor-Joining系统发育树Fig.2 The Neighbor-joining phylogenetic tree of 16S rRNA gene注:分枝结点数值表示1 000次Bootstrap分析所支持的次数,比例尺(0.01)表示序列差异的分枝长度(图3同)
分离到可培养真菌45株,去重后鉴定为12种,构建系统发育树,如图3所示,菌株的分类地位信息见表1。12种菌株分属于Ascomycota(Aspergillussp.、Candidasp.、Thermomycessp.、Blastobotryssp.)、Mucoromycota(Rhizomucorsp.)和Basidiomycota(Sporidiobolussp.)。其中Aspergillussp.的种类较多。Rhizomucorpusilus能在50 ℃条件下生长,属于嗜热真菌[12, 24]。Aspergillusruber和Aspergilluscarbonarius在之前的研究中未见报道[12, 13, 16, 20, 22-26]。酵母Candidasp.、Arxulasp.和Sporidiobolussp.主要从发酵后期的茶样中获得。
2.3 不同发酵阶段茶样中可培养微生物的网络关系
不同发酵阶段的微生物网络关系如图4所示,Aspergillustamarii、Kocuriaturfanensis、Rhodosporidiobolusruineniae和Paenibacillusbarengoltzii只在SC中分离到,Aspergillusniger和Rhizomucorpusillus在所有阶段都分离到。7、14、21 d样品中分离的微生物种类较少,曲霉属的微生物种类最多。从28、35、42 d样品中分离的微生物种类较多,主要为细菌和酵母菌,且微生物种类相似。

图3 真菌ITS基因的Neighbor-Joining系统发育树Fig.3 The neighbor-joining phylogenetic tree of ITS genes

图4 不同发酵阶段茶样中微生物网络关系图Fig.4 The network of culturable microorganisms in different fermentation stages注:SC代表茶原料,7、14、21、28、35和42 d分别代表发酵第7、14、21、28、35、42天的茶样
2.4 茶样与发酵环境中的微生物网络关系
从发酵环境中分离的微生物种类如表2所示。在发酵室空气(KQ)中分离到35株,去重后鉴定为15种,真菌9种,细菌6种。发酵室地面(DM)分离到15株,鉴定为8种,真菌3种,细菌5种。茶样与发酵环境中的微生物网络关系如图5所示。JC中分离的微生物种类最多,KQ次之,DM最少。Aspergillusniger和Bacillusoleronius是KQ、SC、DM和JC共有种类。Rhodosporidiobolusruineniae、Paenibacillusbarengoltzii、Aspergillustamarii和Rhizomucorpusillus是JC和SC共有的种类。Aspergillusfumigatus是JC与KQ共有的种类。Bacillussubtilis是JC和DM共有的种类。

表1 普洱茶发酵过程中可培养微生物的分类地位Table 1 Taxonomic status of cultureable microbes during the fermentation of Pu-erh tea
3 讨论
从发酵不同阶段的样品中分离到真菌45株,6个属,12种,Aspergillussp.的种类较多,细菌49株,9个属,14种,Bacillussp.的种类较多。Aspergillusniger和Bacillusoleronius存在于所有样品中。发酵茶样与茶原料的可培养微生物相似性较大,与环境中的微生物相似性较小,初步推测发酵中的大部分微生物可能来自于茶原料。结果分析显示,发酵7 d左右,喜温喜湿的黑曲霉增加迅速,成为发酵前期的主要微生物。随着水分含量降低,黑曲霉的数量在中后期逐渐衰减。白飞荣等[25]研究表明,Aspergillussp.代谢能产生有机酸及多酚氧化酶、纤维素酶、单宁酶等,可促进茶叶粗纤维组织的软化和大分子物质转化。黄振兴等[27]的研究表明Aspergillusniger进行糖代谢能分解大量的多糖,并产生大量的单糖,为后期酵母和细菌的滋生提供大量的养分。因此Arxulaadeninivorans和Bacillusoleronius在发酵后期大量增加。杨晓苹等[23]发现Arxulaadeninivorans能分泌大量胞外酶,在高温条件下表现出高活力,可促进茶叶中多酚类物质的转化,形成香醇浓厚的滋味物质,是普洱茶特殊风味形成的关键菌群。MOHAMMAD等[28]的研究表明,发酵后期的优势菌Bacillussp.能产生丰富的多酚氧化酶和过氧化物酶,其分泌的多酚氧化酶能够将黄烷醇类及其糖苷类底物转化为如双黄烷醇、茶黄素、茶红素等物质,在茶叶风味和成色的形成中起着重要作用,有利于提高普洱茶品质及缩短发酵时间。此外,有文章[3]曾报道,本文分离到的嗜热菌Bacillussubtilis、Bacillusthermoamylovorans、Streptomycesrecifensis等能分泌蛋白酶、脂肪酶、果胶酶等多种胞外酶,可能在普洱茶品质形成的中过程起着重要的作用。

表2 普洱茶发酵环境中可培养微生物的分类地位Table 2 Taxonomic status of cultureable microbes in fermentation environment of Pu-erh tea

SC-茶原料;KQ-发酵空气;DM-发酵地面;JC-发酵茶样图5 发酵茶样与发酵环境中可培养微生物类群异同网络图Fig.5 The similarities and differences network of culturable microbial groups between fermenting tea samples and fermentation environment
普洱茶发酵过程中,大量的微生物参与了物质转化,对这些微生物在普洱茶自然发酵过程中的功能研究是发酵工艺改进的前提条件。传统分离培养及菌种保存可建立普洱茶自然发酵菌种库,为人工接种发酵普洱茶工艺研究和优势菌再发酵中的功能研究提供菌种资源保障。
