宜宾芽菜拌盐干腌过程中的主要成分变化及其与亚硝酸盐含量变化的相关性分析
2020-10-29杨建飞左勇马懿徐佳黄雪芹
杨建飞,左勇,2*,马懿*,徐佳,黄雪芹
1(四川轻化工大学 生物工程学院,四川 宜宾,644000)2(四川师范大学 生命科学学院,四川 成都,610101)
宜宾芽菜(简称芽菜)是以芥菜为原料,经过划丝、晾晒、拌盐干腌、拌料复腌等工艺制成的一类发酵蔬菜制品,富含多种氨基酸、有机酸、还原糖、挥发性风味物质等营养成分,具有脆、嫩、鲜、香的口感,深受广大消费者的喜爱。芽菜由于独特的原料及发酵工艺,制作时长需要1年左右,其中拌盐干腌过程需要2~3个月[1],是亚硝峰出现的主要时期[2],也是芽菜风味和色泽形成的重要环节。
现有国内外学者研究表明,蔬菜发酵过程中亚硝酸盐的形成不可避免,且存在超标现象[3-4]。从食品安全角度来说,亚硝酸盐基本上被消费者视为有害物质,原因在于亚硝酸盐能使血液中正常携氧的低铁血红蛋白被氧化成高铁血红蛋白,失去携氧能力而引起组织缺氧[5],若人体摄入过高的亚硝酸盐,具有引发高铁血红蛋白血症、Ⅰ型糖尿病和癌症等的风险[6-7]。因此,亚硝酸盐含量高低已成为衡量发酵蔬菜安全与否的主要指标。
目前,关于蔬菜发酵过程中,亚硝酸盐的形成及含量变化规律已基本明确[8],大量研究主要集中在亚硝酸盐的降解和含量控制方面,而关于发酵蔬菜主要成分的变化与亚硝酸盐含量变化的相关性研究鲜有报道。本文以拌盐干腌过程中的芽菜为研究对象,分析其发酵过程中硝酸盐、氨基酸态氮、还原糖、挥发性风味物质、有机酸等主要成分的变化及其与亚硝酸盐含量变化的相关性,以期为芽菜中亚硝酸盐含量的控制及影响因素研究提供参考。
1 材料与方法
1.1 材料与试剂
芽菜,0 d开始腌制,共腌制80 d,每10 d取样分析,宜宾市某企业提供;KNO3、NaNO2、磷酸二氢钾、草酸、乳酸、乙酸、酒石酸(分析纯),成都市科龙化工试剂厂;苹果酸、柠檬酸、琥珀酸、甲醇(色谱纯),上海源叶生物科技有限公司。
1.2 仪器与设备
STARTER2C pH计,上海奥豪斯仪器有限公司;T6紫外可知分光光度计,北京普析通用仪器有限责任公司;1260 infinity Ⅱ高效液相色谱仪、6890N-5979B气相色谱-质谱联用仪,美国安捷伦公司;0.22 μm水系滤膜,天津市津腾实验设备有限公司;SPME固相微萃取进样器、50/30 mm DVB/CAR/PDMS萃取头,美国Supelco公司。
1.3 方法
1.3.1 芽菜传统制作工艺
芽菜传统制作工艺如下所示:
芥菜→晾晒→刮丝→拌盐→搅拌→拌盐→洗净→脱水→添加辅料→装坛→密封→发酵→加入蒜氨酸→检验→成品→根据需要加工成所需的调味品[9]
1.3.2 硝酸盐的测定
参照赵杰[10]的双波长法,并稍作改进,选择在205 nm处测定芽菜发酵过程中硝酸盐含量的变化,消除亚硝酸盐的干扰,选择275 nm处进行校正,消除大多数有机物的干扰。
1.3.3 亚硝酸盐的测定
依据GB 5009.33—2016中的分光光度法[11],并稍作优化,在芽菜提取样液中加入0.2 g活性炭,避免色泽干扰亚硝酸盐含量的测定。
1.3.4 pH值的测定
依据GB 5009.237—2016中的pH计法[12]测定芽菜发酵过程中pH值的变化。
1.3.5 氨基酸态氮的测定
依据GB 5009.235—2016中的甲醛值法[13]测定芽菜发酵过程中氨基酸态氮含量的变化。
1.3.6 还原糖的测定
依据GB 5009.7—2016中的直接滴定法[14],以葡萄糖计,测定芽菜发酵过程中还原糖含量的变化。
1.3.7 挥发性风味物质的测定
参照GANGULY等[15]和郑炯等[16]的顶空固相微萃取-气质联用法(solid phase micro-extraction gas chromatography mass spectrometry,SPME-GC-MS)并加以改进,芽菜剪碎研磨均匀后,称取4.0 g置于15 mL的顶空进样瓶中,加入饱和NaCl溶液2 mL,以增加离子强度,促进风味物质的挥发,在70 ℃下加热平衡15 min后吸附45 min,在 230 ℃下解析5 min。GC条件:DB-WAX色谱柱(60 m×250 μm×0.25 μm);程序升温:初温50 ℃,保持3 min,再以5 ℃/min到120 ℃,保持1 min,再以10 ℃/min到230 ℃,保持5 min;载气为氦气,不分流进样,体积流量为1.0 mL/min。MS条件:离子源为EI源;离子化能量70 eV,采集模式为全扫描,离子源温度230 ℃,MS四极杆温度150 ℃,溶剂延迟3 min。
1.3.8 有机酸的测定
参照商景天等[17]的高效液相色谱法(high performance liquid chromatography,HPLC)并加以改进,称取2.0 g研磨均匀的芽菜样品,加入75 ℃的蒸馏水50 mL,75 ℃水浴20 min后过滤,临用前经0.22 μm水系滤膜过滤后进样分析。HPLC条件:Agilent ZORBAX SB-Aq (4.6 mm×250 mm,5 μm) 色谱柱,VWD检测器,检测波长210 nm,流动相A为磷酸二氢钾(pH=2.52),流动相B为甲醇,A、B相的体积比为95∶5,进样量15 μL,流速0.4 mL/min,柱温25 ℃。
采用外标法对芽菜有机酸定量,用超纯水分别配制1.0 mg/mL的草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸7种有机酸单标品储备液,再配制质量浓度梯度为10、20、40、60、80、100、120 μg/mL的混合有机酸标准溶液,由于草酸具有较高的峰值,配制其质量浓度梯度为2、4、8、12、16、20、24 μg/mL。按上述色谱条件上机测定。
1.4 数据处理与分析
采用气相色谱-质谱连用技术得到离子色谱图,通过计算机谱库检索,选择相似度≥80%的组分作为芽菜中的挥发性风味成分,采用峰面积归一化法计算相对百分含量[18],采用SPSS 19.0的皮尔逊系数作相关性分析[19],采用Origin 2018进行图表的绘制。
2 结果与分析
2.1 硝酸盐含量的变化
芽菜拌盐干腌过程中,硝酸盐的含量变化如图1所示,芽菜原料中含有大量的硝酸盐,随着腌制时间延长,硝酸盐含量不断降低,最终低至722.58 mg/kg,降低了75.99%,可能是芽菜自身硝酸还原酶与发酵环境中硝酸还原菌产的硝酸还原酶协同降解硝酸盐[20-21],使得硝酸盐含量不断降低,同时产生部分亚硝酸盐。
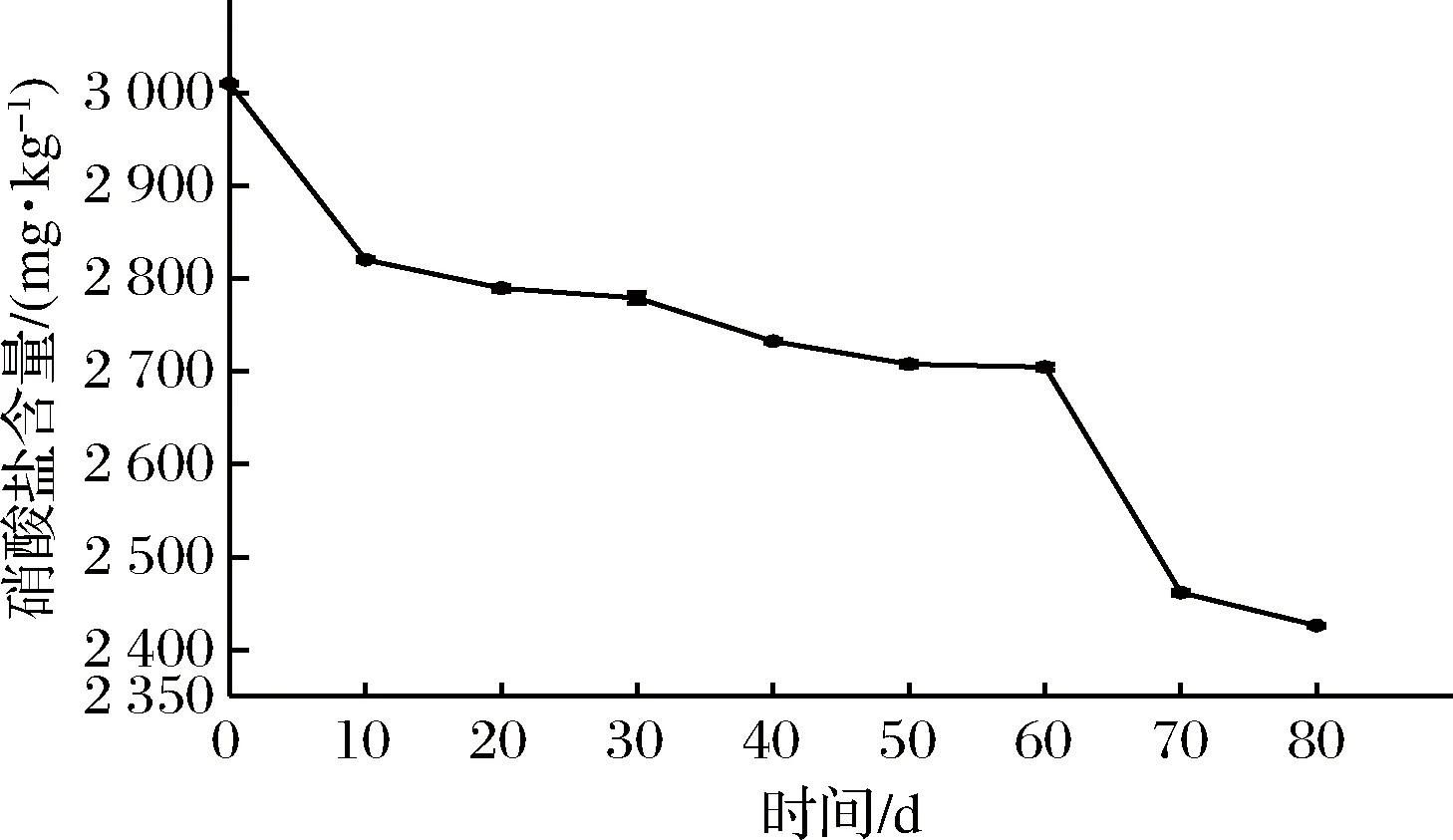
图1 硝酸盐含量的变化Fig.1 The changes of nitrate content
2.2 亚硝酸盐含量及pH值的变化
芽菜拌盐干腌过程中,亚硝酸盐含量和pH值的变化如图2所示,芽菜原料中的亚硝酸盐含量为2.70 mg/kg,随着腌制时间延长,亚硝酸盐含量先增加后降低最后趋于平缓。芽菜在腌制30 d时出现亚硝峰,含量为3.37 mg/kg,可能是部分硝酸盐被还原为亚硝酸盐导致[3],随后亚硝酸盐含量迅速降低,可能是芽菜中的乳酸菌产亚硝酸盐还原酶和产酸协同作用,使得亚硝酸盐迅速降解[22]。芽菜pH值随发酵时间延长不断降低,当pH值低于4.0时,亚硝酸盐的含量保持在1.53 mg/kg左右,可能是强酸性环境抑制了硝酸还原菌的生长繁殖,同时降低了亚硝酸盐还原酶的酶活性,这与WANG等[23]的研究结果相似。
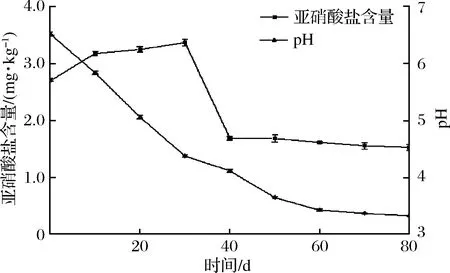
图2 亚硝酸盐含量及pH值的变化Fig.2 The change of nitrite content and pH value
2.3 氨基酸态氮含量的变化
芽菜拌盐干腌过程中,氨基酸态氮的含量变化如图3所示,氨基酸态氮含量的变化趋势和图2中亚硝酸盐含量的变化趋势相似,表明两者之间可能存在正相关关系。氨基酸态氮含量在芽菜发酵30 d时达到最高为3.70 g/kg,可能是芽菜植物蛋白被发酵菌株利用,生成了氨基酸态氮类物质[24],随后,氨基酸态氮含量不断降低至1.60 g/kg,可能是部分游离氨基酸的氨基和还原糖的羰基发生了羰氨反应[2],形成烯醇、呋喃、酮类等香味前体物质。
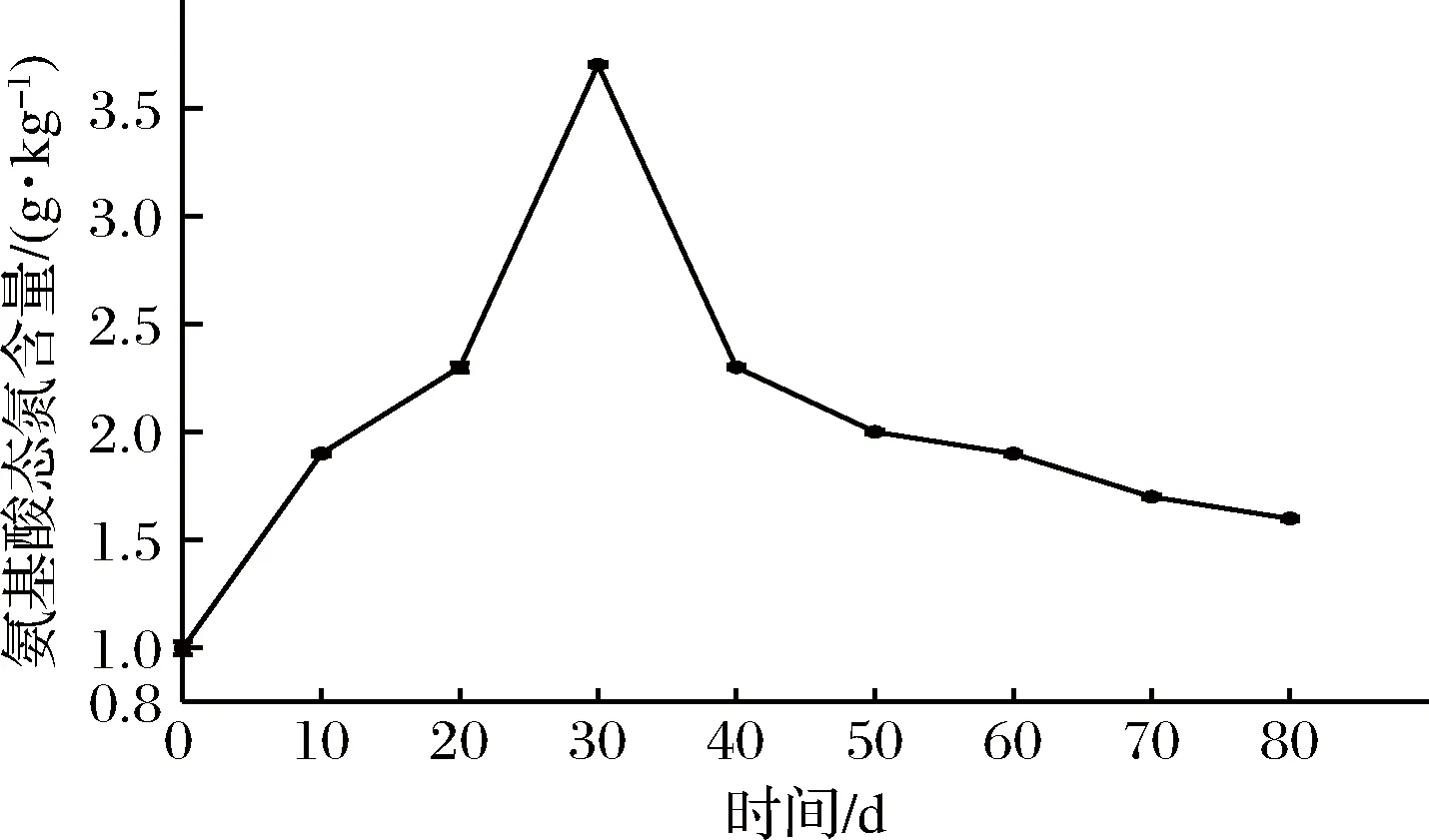
图3 氨基酸态氮含量的变化Fig.3 The changes of nitrogen content in amino acid state
2.4 还原糖含量的变化
芽菜拌盐干腌过程中,还原糖的含量变化如图4所示。还原糖的含量变化与图2中亚硝酸盐含量变化趋势相似,均在芽菜腌制30 d时达到最高含量,表明两者可能存在正相关关系。芽菜腌制前10 d,还原糖含量迅速增加,可能是芽菜纤维素在微生物和纤维素酶作用下分解为还原糖[25],在10~20 d,还原糖含量没有显著变化,可能是发酵菌株利用还原糖为碳源生长繁殖。随后,还原糖含量迅速增加至41.1 g/kg,可能是温度、pH等达到纤维素酶最适范围,最后还原糖含量不断降低,可能是芽菜纤维素含量不足,部分还原糖与氨基酸类发生羰氨反应,最终含量为10.8 g/kg,是发酵初期的5.75倍,这与徐坤等[2]的研究结果相似。
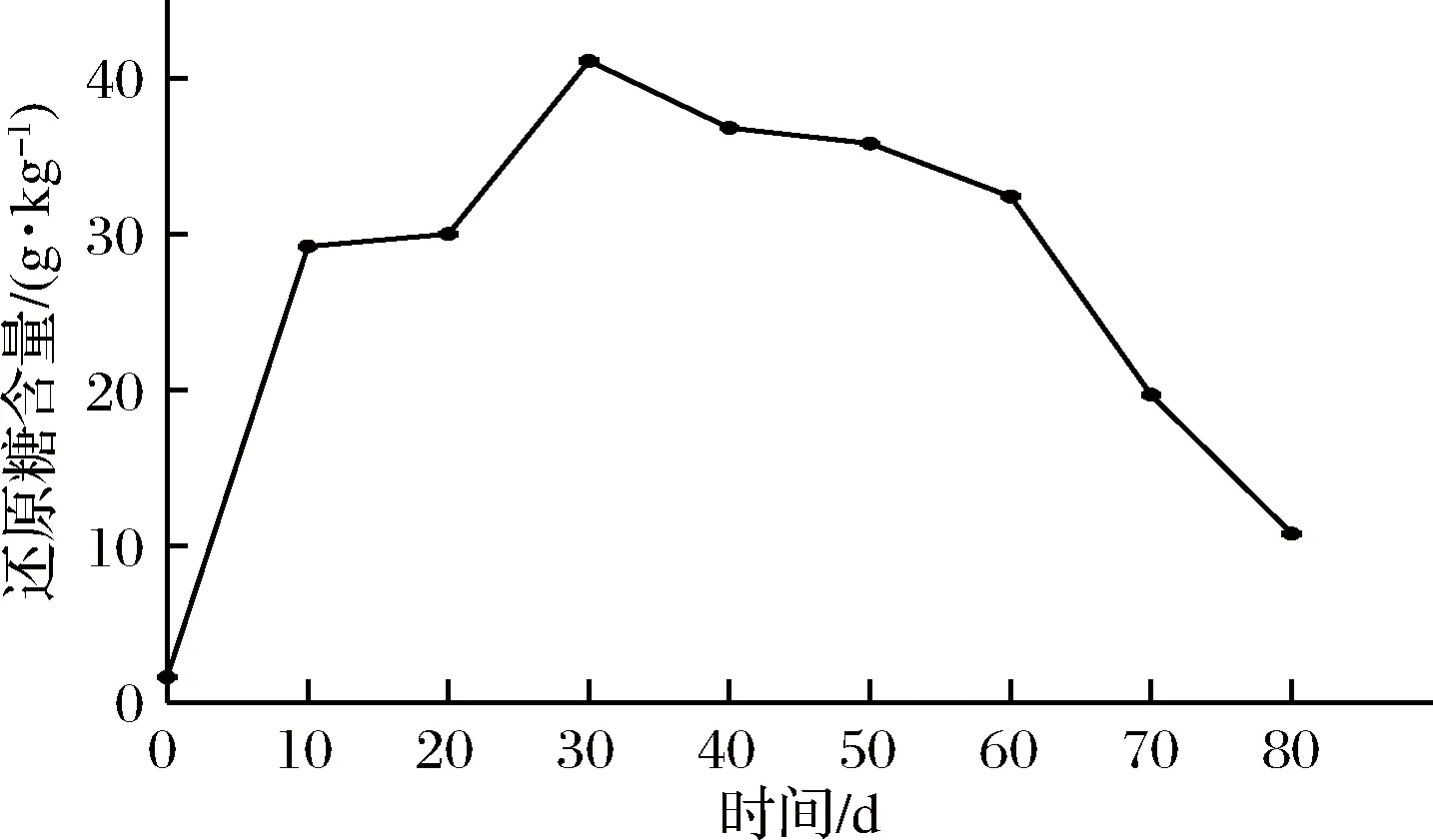
图4 还原糖含量的变化Fig.4 The changes of sugar content
2.5 挥发性风味物质种类和相对含量的变化
芽菜拌盐干腌过程中共检测出83种挥发性风味物质,主要分为10类,包括呋喃类3种、腈类3种、醚类3种、烷类4种、醇类12种、酮类8种、醛类15种、酚类2种、烯类4种、酯类29种。挥发性风味物质的种类和含量变化如表1所示。苯乙醇、乙醇、芳樟醇、4-萜品醇、异硫氰酸烯丙酯的相对含量一直保持较高的水平,这与左勇等[26]的研究结果一致,表明这6种物质可能是芽菜中挥发性风味的主要贡献者。随着腌制时间延长,芽菜挥发性风味物质的种类先增加后降低,但总相对含量不断增加,比原料中高26.96%,贡献较大的成分有苯代丙腈、茴香脑、苯乙醇、乙醇、芳樟醇、4-萜品醇、硫氰酸烯丙酯、棕榈酸乙酯等,这与张静等[27]的研究结果相似。另外可见,芽菜腌制0~60 d,醛类、酮类种数居多,随后烯类和酯类种数增加,醛类、酮类种数明显减少,而且呋喃类、2,6-二甲基环己醇、3,5-辛二烯-2-酮、β-紫罗兰酮、己醛、反式-2-戊烯醛、苯甲醛、异硫氰酸烯丙酯、3-丁烯基异硫氰酸酯、壬基氯乙酸酯、二氢猕猴桃内酯的相对含量随芽菜腌制时间增加而降低,表明这些物质的含量降低,以及烯类和酯类种数的增加可能是标志芽菜腌制成熟的重要指标。

表1 芽菜拌盐干腌过程中挥发性风味物质成分及相对含量的变化 单位:%
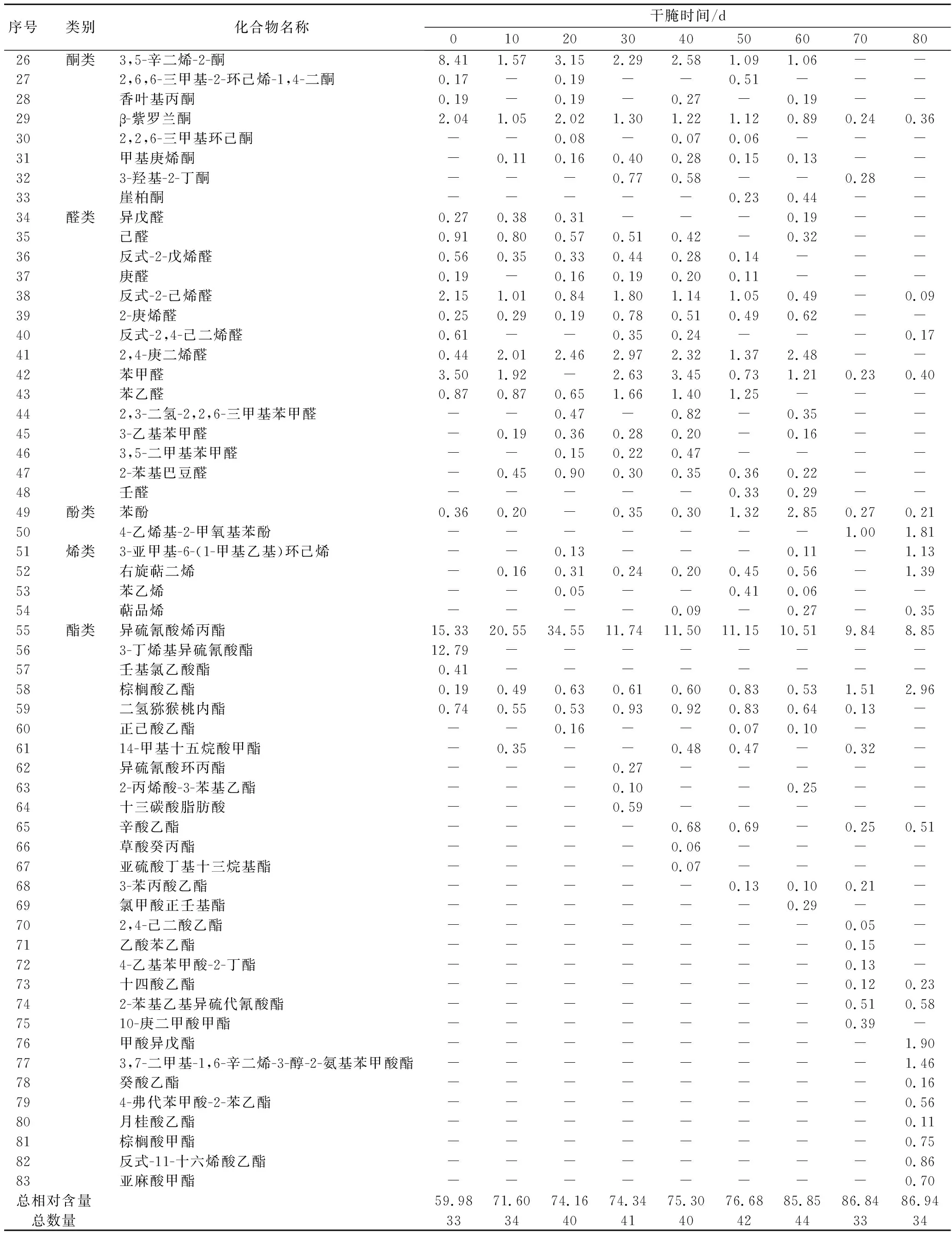
续表1
2.6 有机酸种类和含量的变化
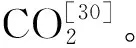
1-草酸;2-酒石酸;3-苹果酸;4-乳酸;5-乙酸;6-柠檬酸;7-琥珀酸图5 混合有机酸标准色谱图Fig.5 Standard diagram of mixed organic acids
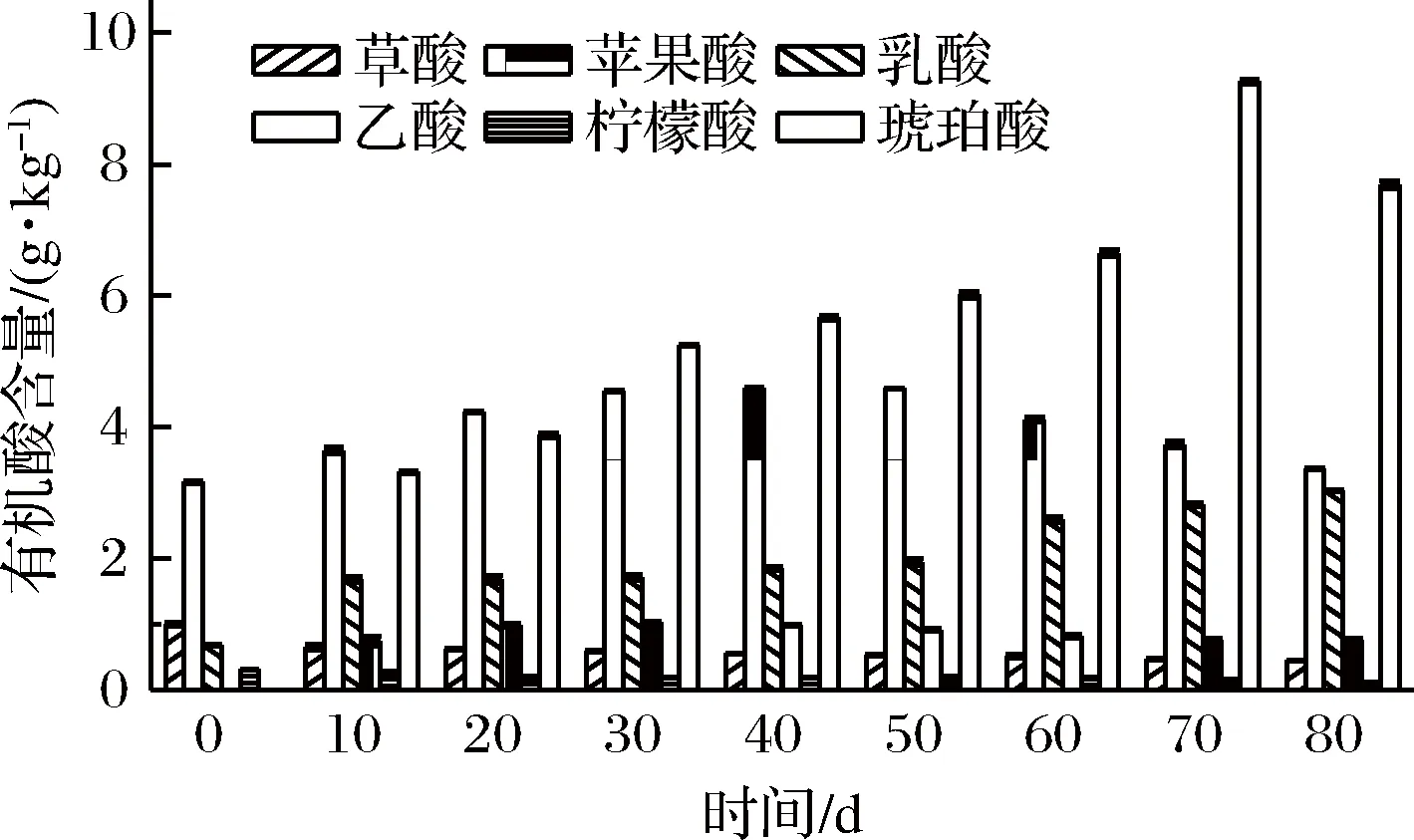
图6 有机酸种类及含量的变化Fig.6 The change of organic acid types and contents
2.7 芽菜主要成分含量变化与亚硝酸盐含量变化的相关性
由于芽菜拌盐干腌过程中检出的挥发性风味物质较多,表2中仅列出与亚硝酸盐含量变化有关的挥发性风味成分。由表2可知,检出的83种挥发性风味物质中,只有5种成分的含量变化与亚硝酸盐的含量变化具有显著相关性,其中己醛、反式-2-戊烯醛、反式-2-己烯醛与亚硝酸盐含量变化呈极显著正相关;β-紫罗兰酮、辛酸乙酯分别与亚硝酸盐含量变化呈显著正相关和显著负相关;硝酸盐、还原糖、氨基酸态氮均与亚硝酸盐含量变化呈显著正相关,这与2.1~2.4分析结果相符。另外可见,芽菜的6种有机酸中,草酸和柠檬酸与亚硝酸盐含量变化呈极显著正相关;乳酸和琥珀酸与亚硝酸盐含量变化呈极显著的负相关;苹果酸和乙酸与亚硝盐含量变化的相关性不显著。表明芽菜发酵过程中,亚硝酸盐含量高低可能对芽菜的挥发性风味物质具有调控作用[31-32],较高含量的硝酸盐会促进亚硝酸盐含量增加[3],而乳酸和琥珀酸可能对亚硝酸盐具有降解作用[33-34]。
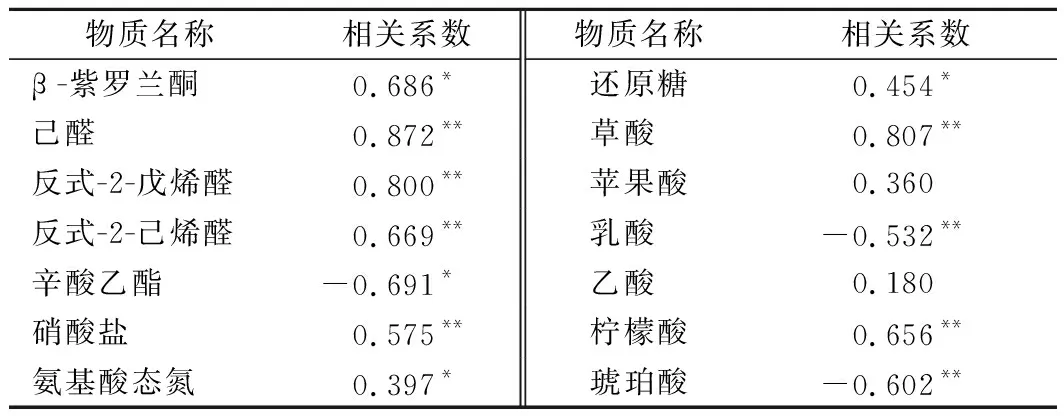
表2 芽菜主要成分含量变化与亚硝酸盐含量变化的相关性Table 2 Correlation between the content of main components and the content of nitrite in sprout
3 结论
在芽菜拌盐干腌过程中,硝酸盐含量不断降低,最终含量为722.58 mg/kg;亚硝酸盐、氨基酸态氮、还原糖的含量先增加后降低最后趋于稳定,最终含量分别为1.53 mg/kg、1.60、10.8 g/kg;挥发性风味物质共检出83种,其种类先增加后降低,但总相对含量不断增加,比原料中高26.96%;有机酸种类由原料中的4种增加到6种,其中苹果酸、琥珀酸的含量先增加后降低,最终含量分别为3.37、7.69 g/kg;乳酸含量不断增加至3.04 g/kg;柠檬酸和草酸的含量分别不断降低至0.11、0.46 g/kg,乙酸含量一直保持在1.0 g/kg以下。
通过分析芽菜主要成分含量变化与亚硝酸盐含量变化的相关性,得出挥发性己醛、反式-2-戊烯醛、反式-2-己烯醛以及硝酸盐、草酸、柠檬酸与亚硝酸盐含量变化呈极显著正相关;β-紫罗兰酮、氨基酸态氮、还原糖与亚硝酸盐含量变化呈显著正相关;乳酸和琥珀酸与亚硝酸盐含量变化呈极显著负相关;挥发性辛酸乙酯与亚硝酸盐含量变化呈显著负相关;苹果酸和乙酸与亚硝酸盐含量变化的相关性不显著。说明在芽菜拌盐干腌过程中,亚硝酸盐含量的变化与其多种主要成分及其含量变化存在显著相关性,这将为芽菜腌制过程中亚硝酸盐含量的控制及影响因素研究提供理论依据。
