贵州不同酒曲在刺梨酵素发酵菌剂制备中的应用
2020-10-29王瑜李立郎解春芝杨礼寿杨娟万丽英杨小生
王瑜,李立郎,解春芝,杨礼寿,杨娟,万丽英,杨小生*
1(贵州医科大学,药用植物功效与利用国家重点实验室,贵州 贵阳,550014)2(贵州省中国科学院天然产物化学重点实验室,贵州 贵阳,550014)3(徐州工程学院 食品与生物工程学院,江苏 徐州,221018)4(六盘水职业技术学院,贵州 六盘水,553001)
酵素是利用微生物的新陈代谢产物的作用,将发酵原料中的糖类、蛋白质等大分子物质转化为小分子物质,富含多种生物活性物质,如醇、酸、醛、酯、维生素、酶、有机酸等的功能性产品[1]。酵素的发酵方式有自然发酵和纯种发酵2种,其中常用的纯种发酵剂优势微生物有乳酸菌、酵母菌及醋酸菌等,采用复合菌剂强化发酵,利用优势菌群在酵素食品发酵体系中快速构建出有益的微生物菌群,抑制腐败菌、致病菌等杂菌的生长,形成新的代谢产物和风味物质[2]。目前对于酵素中微生物菌群组成研究较少,MA等[3]采用单分子实时测序技术分析了日本和中国台湾市场上销售的酵素细菌组成及多样性,鉴定了43个菌属,优势菌群主要为嗜铬杆菌属、乳酸菌属、分枝杆菌属。凌空等[4]分离鉴定了果蔬酵素不同发酵周期中微生物,从3种不同发酵周期的果蔬酵素中分离筛选得到15株菌种。高庆超等[5]采用Illumina MiSeq高通量测序技术分析了不同发酵阶段的黑果枸杞酵素微生物的群落组成及多样性,发现黑果枸杞酵素在发酵期0~20 d细菌群落多样性和丰富度相对较高,在发酵期30~50 d真菌群落多样性和丰富度相对较高。通过研究鉴定了果蔬发酵中的主要微生物菌群,以获得安全的发酵剂及为产品的稳定性和风味提供指导作用[6]。但采用酒曲提供微生物发酵制备酵素的研究相对较少,更无对微生物群落结构和功能因子之间的相关性研究。
因此,本研究通过采集贵州省7个不同行政区域当地传统酒曲发酵刺梨酵素,运用高通量测序方法对刺梨酵素细菌群落组成和多样性进行分析,比较微生物群落结构差异,同时测定刺梨酵素中的主要功能成分与主要细菌种群做相关性分析,为刺梨酵素发酵剂的制备以及刺梨酵素中微生物群落结构和功能成分之间的相关性提供依据,为刺梨酵素的标准化开发提供一定的理论支撑。
1 材料与方法
1.1 材料与试剂
刺梨,贵州贵定敏子食品有限公司;酒曲,来源见1.3;纤维素酶,南宁庞博生物工程有限公司;DNA抽提试剂盒,FastDNA®Spin Kit for Soil;齐墩果酸(纯度99%),中国药品生物制品检定所;芦丁(纯度94.47%)、VC(纯度98%),贵州迪大生物科技有限责任公司。
1.2 仪器与设备
SKG-PB-936打浆机,上海达瑞宝公司;BS-210S电子天平,北京赛多利斯仪器有限公司;EYELA旋转蒸发仪,上海爱朗仪器有限公司;AG285微量分析天平,梅特勒-托利多仪器上海有限公司;GZX-9420MBE鼓风烘箱,上海博迅实业有限公司;PAL-1 ATAGO糖度计,日本爱拓(爱拓)中国分公司;TCL-168离心机,上海安亭科技仪器厂;UV-1800紫外分光光度计,上海精密科学仪器有限公司;Millipore-0026高效液相色谱仪,美国Thermo Fisher公司; ABSON MiFly-6微型离心机,合肥艾本森科学仪器有限公司;Eppendorf 5430 R小型离心机、Eppendorf;NanoDrop2000超微量分光光度计,Thermo Fisher Scientific;DYY-6C电泳仪,北京市六一仪器厂; Illumina Miseq MISEQ测序仪,Illumina;QL-901旋涡混合器,海门其林贝尔仪器制造有限公司;TL-48R粉碎研磨仪,上海万柏生物科技有限公司。
1.3 实验方法
1.3.1 酒曲的采集与刺梨酵素的制备
(1)酒曲的采集:根据贵州省行政区域的划分,按照区域具有代表性的原则,以贵阳为中心,选择贵州的东、西、南、北4个区域地点,于2018年9~10月,分别在贵州省贵阳市花溪区(GY)、遵义赤水市(ZY)、铜仁地区德江县(TR)、黔西南州兴仁县(QXN)、黔东南州凯里市(QDN)、黔南州龙里县(QN)和毕节大方县(BJ)7个行政区域采集传统酿酒用高温大曲用于制备刺梨酵素。
(2)刺梨酵素的制备:取新鲜刺梨洗净去蒂,按照m(刺梨鲜果)∶m(纯净水)=1∶2打浆混合后,按照其总质量的10%白糖,搅拌使白糖完全溶化,添加0.02%(质量分数)纤维素酶,0.03%(质量分数)贵州不同区域采集的酒曲粉末,酒曲使用前采用温水活化,混合均匀后将其转至陶瓷坛内,陶瓷坛采用100目纱布封口,在18~25 ℃下有氧发酵。待发酵3个月后,pH值降至3~4,糖度降至4%~5%,产品澄清透明,呈淡黄色,取表面上清液冷藏备用。
1.3.2 不同区域酒曲发酵刺梨酵素的功能成分检测方法
刺梨酵素中功能成分总三萜和总黄酮采用紫外分光光度计,参考南莹等[7]的方法测定,其中总三萜以齐墩果酸为标准品,总黄酮以芦丁为标准品,VC采用高效液相色谱仪测定,色谱柱为Topsil C18色谱柱(4.6 mm×250 mm,5 μm);糖度采用糖度计测定。
1.3.3 样品DNA提取与高通量测序分析
(1)样本收集:取不同酒曲发酵的刺梨酵素液体样品,离心后倒掉上清液,将菌体沉淀在-80 ℃下冷冻后,干冰保存状态下送至深圳微科服科技有限公司进行DNA提取与细菌菌群检测。
(2)DNA抽提和聚合酶链式反应(polymerase chain reaction,PCR)扩增:根据FastDNA®Spin Kit for Soil试剂盒使用说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop 2000进行检测,利用2%(质量分数)琼脂糖凝胶电泳检测DNA提取质量;采用338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)引物对V3-V4可变区进行PCR扩增,PCR试验采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase;20 μL反应体系:扩增程序为95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s, 72 ℃延伸45 s),最后72 ℃延伸10 min。扩增体系为20 μL,4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μmol/L引物(5 μmol/L),0.4 μL FastPfu聚合酶; 0.2 μL BSA; 10 ng DNA模板[8]。
(3)Illumina Miseq测序:使用2%(质量分数)琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA) 进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluor-ST (Promega, USA) 进行检测定量。根据Illumina MiSeq平台 (Illumina, San Diego, USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库。利用Illumina公司的Miseq PE300平台进行测序。
1.4 数据处理
利用 QIIME 2.0 软件包,对测序片段进行分类操作单元(operational taxonomic units,OUT)聚类,OUT代表序列与Greengene数据库进行比对分析,获取 OUT 对应的分类单元及其相应的丰度信息;计算 Shannon index和Observed-OTU index度量指数,评估样品中细菌菌群的丰富度和多样性;综合应用 PCA 分析、LEfSe 分析、ANOVA 方差分析等方法分析样品中的微生物菌群;应用冗余分析(redundancy analysis,RDA) 分析关联菌群结构和刺梨酵素功能成分总三萜、总黄酮、VC及糖度的相关性,利用Excel 2010和SPSS Statistics 20.0等统计软件进行数据分析和作图。
2 结果与分析
2.1 琼脂糖凝胶电泳检测DNA提取结果
采用338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)引物对V3-V4可变区进行PCR扩增,PCR扩增产物电泳条带均在750 bp 左右,条带长度和亮度较好,表明DNA含量较高,可上机检测进行后续实验。
2.2 不同酒曲发酵的刺梨酵素微生物OTU数目分析
通过检测不同区域酒曲发酵的刺梨酵素共22个样品,得到有效序列1 139 057条,平均每个样品51 775条。图1是展现不同区域间共有和特有OTU数目的花瓣图,由图1可知,7个区域共有的OTU数目为46,贵阳特有的OTU数目为500,毕节特有的OTU数目为840,遵义特有的OTU数目为277,铜仁特有的OTU数目为1 125,黔西南特有的OTU数目为618,黔南特有的OTU数目为559,黔东南特有的OTU数目为433。
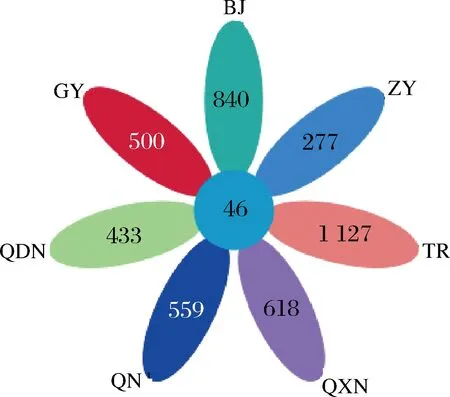
图1 不同区域间共有和特有OTU数目花瓣图Fig.1 Common and unique OTU number of petals among different regions
2.3 不同酒曲发酵的刺梨酵素微生物群落的α-多样性分析
图2是毕节、贵阳、黔东南、黔南、黔西南、铜仁、遵义(BJ、GY、QDN、QN、QXN、TR、ZY)7个地区间α-多样性盒形图,更直观显示不同区域间α-多样性差异。α-多样性指数是对样品中物种多样性的分析,包含样品中的物种组成丰富度和均匀度2个因素,通常用Shannon指数来评估某个样本的物种多样性,Shannon值越大,表明样本的多样性越复杂;而用Observed-OTU指数来评估样本的物种丰富度呈正相关,Observed OTU指数是指样本中实际测定得到的OTU数量,衡量样品中OTU丰富度的指数。

A-Shannon指数统计分析;B-Obsrved-OTU指数统计分析;C-Shannon指数组间差异检验;D-Obsrved-OTU指数组间差异检验图2 不同区域酒曲发酵刺梨酵素微生物α-多样性盒形图Fig.2 Microbial life of Roxburgh rose Jiaosu in different regions - diversity box-like diagram
图2-A反映的是物种的多样性,图2-B反映的是物种的丰富度。由图2-A可知,不同区域的微生物多样性差异较大,Shannon结果表明,铜仁(TR)地区的酒曲发酵制备的刺梨酵素具有最高的微生物多样性,而遵义(ZY)地区酒曲发酵制备的刺梨酵素微生物多样性相对较低;从丰富度方面分析,不同区域酒曲发酵的刺梨酵素都具有较高的丰富度,通过比较Observed OTU指数,铜仁(TR)地区的酒曲发酵制备的刺梨酵素具有最高的微生物丰富度,而黔东南(QDN)地区酒曲发酵制备的刺梨酵素微生物丰富度相对较低。由图2-C和图2-D可知,不同区域细菌多样性和丰富度组间存在一定的差异性,但无显著性差异(P>0.05),然而,有研究发现不同地区的酒曲微生物群落构成及多样性存在明显差异,且酒曲的基本理化指标与微生物菌群结构有一定的相关性[9],可能是地域特有的环境和温度导致的差异性。任海伟等[10]研究发现温度会直接影响微生物菌群的动态变化和多样性,室温更有利于提高乳酸发酵强度,抑制腐败菌生长,使有机酸和有机组分得到优化重组,实现较高贮存品质。温度对微生物的多样性影响显著,铜仁地区常年温度较高,四季温差变化较小,适宜微生物生长,造成该地区较高的微生物多样性和丰富度,因此选择适宜稳定的发酵温度是提高酵素品质的关键。
2.4 不同酒曲发酵的刺梨酵素细菌微生物群落组成分析
2.4.1 不同区域酒曲发酵刺梨酵素在门水平上优势菌群结构组成分析
分析不同区域酒曲发酵的刺梨酵素菌群在门水平上分布前10的菌群有变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、疣微菌门(Verruco-microbia)、酸杆菌门(Acidobacteria)、梭杆菌门(Fusobacteria)、绿弯菌门(Chloroflexi)、螺旋体门(Spirochaetes)、未知细菌(unspecified_Bacteria),其中相对丰度>1%的菌群有3种,即变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)。母应春等[11]研究了贵州花溪、贵州和安顺3个地区酒曲的微生物多样性,发现厚壁菌门、变形菌门、放线菌门的相对丰度在3个地区酒曲中均较高;另外陈玲等[12]以浓香型白酒大曲为研究对象,基于16S rRNA基因为目的片段,采用微生物指纹图谱分析技术16S rDNA克隆文库法和高通量测序法分析了大曲中细菌微生物群落的组成,发现大曲中的微生物主要分布于厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和蓝藻菌门(Cyanobacteria/Chloroplast)4个菌门,由此可知刺梨酵素中微生物菌群的组成与发酵酒曲密切相关。进一步分析不同区域中各优势菌群所占的比例,其中毕节(BJ)地区酒曲发酵的刺梨酵素中变形菌门(Proteobacteria)占52.3%,厚壁菌门(Firmicutes)占37.9%,拟杆菌门(Bacteroidetes)占7.2%;贵阳(GY)地区酒曲发酵的刺梨酵素中变形菌门(Proteobacteria)占69.2%,厚壁菌门(Firmicutes)占26.7%,拟杆菌门(Bacteroidetes)占2.2%;黔东南(QDN)地区酒曲发酵的刺梨酵素中变形菌门(Proteobacteria)占71.8%,厚壁菌门(Firmicutes)占19.5%,拟杆菌门(Bacteroidetes)占7.0%;黔南(QN)地区酒曲发酵的刺梨酵素中变形菌门(Proteobacteria)占67.0%,厚壁菌门(Firmicutes)占28.2%,拟杆菌门(Bacteroidetes)占2.0%;黔西南(QXN)地区酒曲发酵的刺梨酵素中变形菌门(Proteobacteria)占62.9%,厚壁菌门(Firmicutes)占28.9%,拟杆菌门(Bacteroidetes)占2.7%;铜仁(TR)地区酒曲发酵的刺梨酵素中变形菌门(Proteobacteria)占58.4%,厚壁菌门(Firmicutes)占27.7%,拟杆菌门(Bacteroidetes)占7.4%;遵义(ZY)地区酒曲发酵的刺梨酵素中变形菌门(Proteobacteria)占69.2%,厚壁菌门(Firmicutes)占27.6%,拟杆菌门(Bacteroidetes)占2.0%。综上可知,采用酒曲发酵的刺梨酵素中优势菌群为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria),其中以变形菌门(Proteobacteria)的相对丰度最高,每个区域都占到了50%以上,不同区域各个菌群有一定差异性,但在门水平上差异不显著。
2.4.2 不同区域酒曲发酵刺梨酵素在属水平上优势菌群结构组成分析
在属水平上,7个区域酒曲发酵的刺梨酵素中分布前10的细菌属为假单胞菌属(Pseudomonas)、醋酸杆菌属(Acetobacter)、乳酸菌属(Lactobacillus)、未知的胞菌科属(unspecified_Aeromonadaceae)、葡糖醋杆菌属(Gluconacetobacter)、肠球菌属(Enterococcus)、未知的乳杆菌属(unspecified_Lactobacillaceae)、未知的肠杆菌属(unspecified_Enterobacteriaceae)、未知的梭菌属(unspecified_Clostridiales)、拟杆菌属(Bacteroides)、普氏菌属(Prevotella),其相对丰度如图3所示。其中相对丰度>10%的菌属有毕节(BJ)的假单胞菌属(Pseudomonas)占28.6%,醋酸杆菌属(Acetobacter)占17.9%,乳酸菌属(Lactobacillus)占25.2%,贵阳(GY)的假单胞菌(Pseudomonas)占40.7%,醋酸杆菌属(Acetobacter)占17.4%,乳酸菌属(Lactobacillus)占14.8%,黔东南(QDN)地区的假单胞菌属(Pseudomonas)占13.0%,醋酸杆菌属(Acetobacter)占53.8%,乳酸菌属(Lactobacillus)占8.9%,黔南(QN)地区的假单胞菌属(Pseudomonas)占36.2%,醋酸杆菌属(Acetobacter)占21.7%,乳酸菌属(Lactobacillus)占20.9%,黔西南(QXN)地区的假单胞菌(Pseudomonas)占38.3%,醋酸杆菌属(Acetobacter)占8.4%,乳酸菌属(Lactobacillus)占11.9%,铜仁(TR)地区的假单胞菌(Pseudomonas)占43.3%,醋酸杆菌属(Acetobacter)占6.6%,乳酸菌属(Lactobacillus)占14.1%,遵义地区(ZY)的假单胞菌(Pseudomonas)占24.8%,醋酸杆菌属(Acetobacter)占34.7%,乳酸菌属(Lactobacillus)占22.2%。
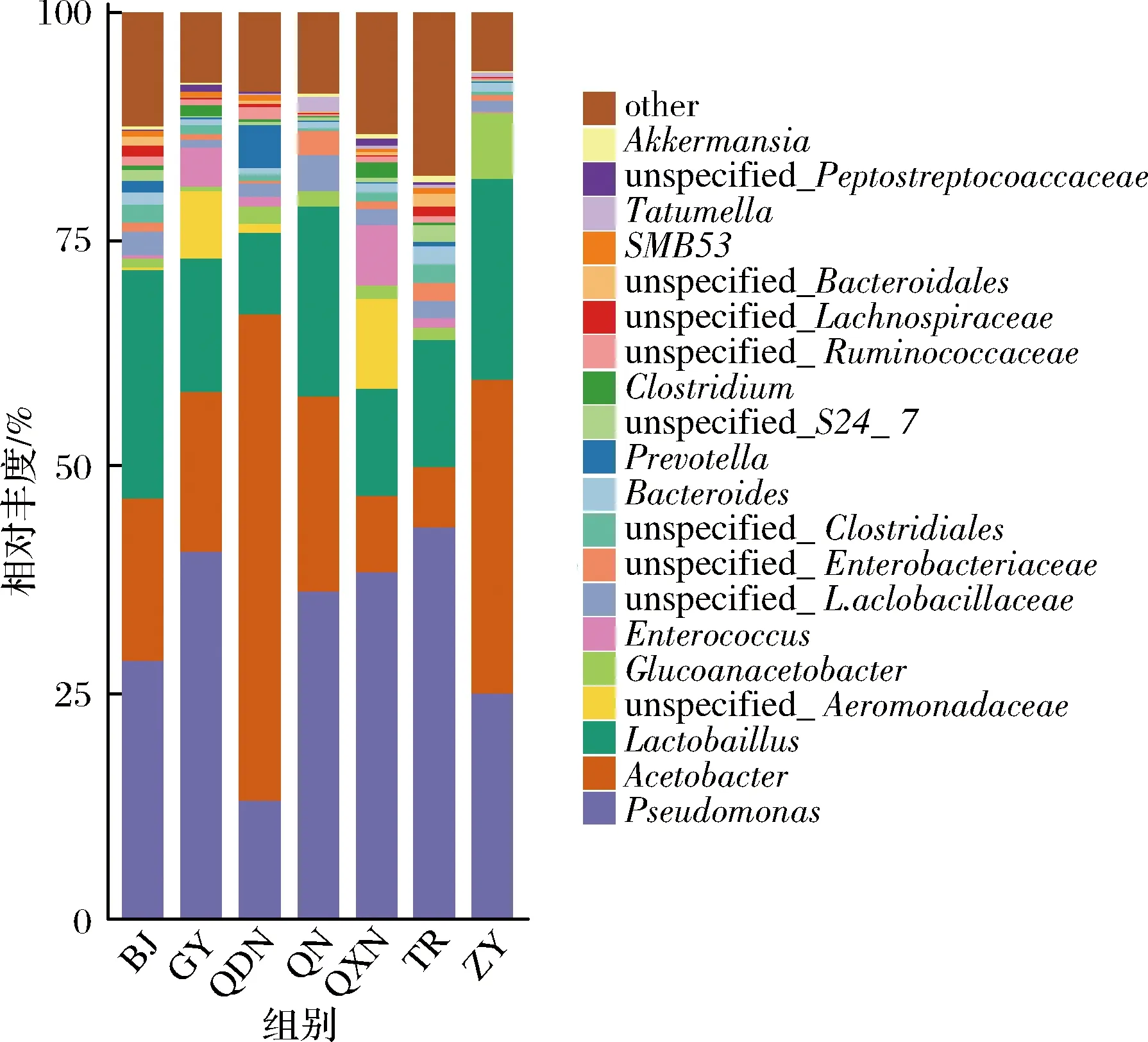
图3 不同区域酒曲发酵刺梨酵素菌群属水平分布图Fig.3 Horizontal distribution of flora genus of Roxburgh rose Jiaosu in different regions
由以上分析可知,在属水平上不同地区酒曲发酵的刺梨酵素中已鉴定到的优势菌群为假单胞菌属(Pseudomonas)、醋酸杆菌属(Acetobacter)、乳酸菌属(Lactobacillus)。酵素发酵过程是由醇和酸共同参与转化的过程,在酶和微生物的作用下将糖类或蛋白质直接转化为醇或酸类[13],厚壁菌门中的乳酸菌属能够产酸且在酸度较高的环境下生长[14],主要参与了酵素发酵的生物转化,与酵素中有机酸的形成密切相关,乳酸菌是一类具有提高机体免疫力,促进营养物质吸收,维持胃肠道菌群平衡的益生菌[15]。研究表明不同乳酸菌种发酵对桂圆肉中游离态、结合态酚类物质含量、单体酚组成及其抗氧化活性都有影响,乳酸菌能提高桂圆肉中游离态酚类物质含量,降低结合态酚类物质含量,同时提高其抗氧化能力[16],因此,乳酸菌代谢对酵素功能的表达至关重要。醋酸杆菌属是酵素发酵过程中的一大类产酸细菌,了解醋酸菌属的组成及发酵特性有助于合理控制酵素发酵进程,有效提高酵素的风味品质[17]。另外醋酸杆菌属(Acetobacter)与葡糖醋杆菌属(Gluconacetobacter)也是酵素发酵过程中产生菌盖的关键菌群[28],醋酸和乳酸是酵素风味的主要成分,二者存在的酸性条件可影响有机酸、功能成分的稳定性[19]。
2.5 不同酒曲发酵的刺梨酵素功能成分与菌群属水平物种RDA分析
分析不同区域酒曲发酵刺梨酵素的功能成分,结果如表1所示。
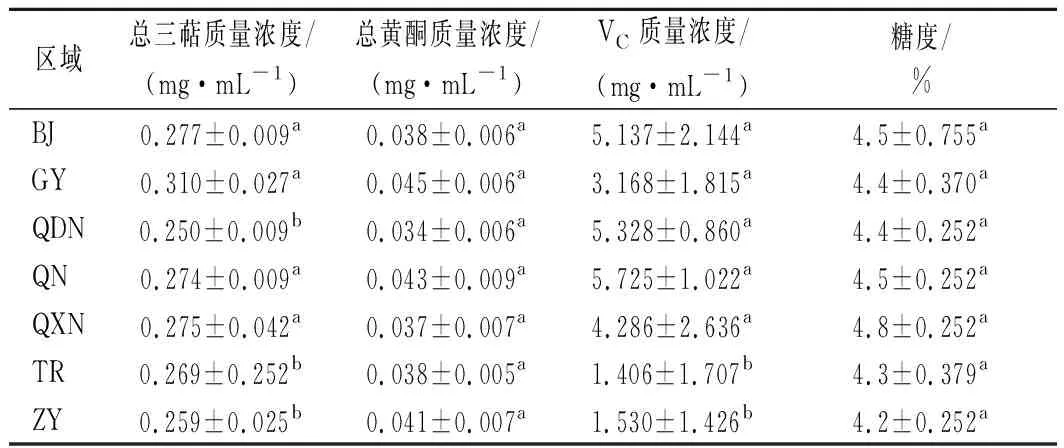
表1 不同区域酒曲发酵刺梨酵素功能成分含量表Table 1 Contents of functional components of Roxburgh rose Jiaosu in different regions
由表1可知,功能成分总三萜和VC含量存在显著性差异(P<0.05),而不同酒曲发酵的刺梨酵素中总黄酮和糖度的含量差异不显著。在相同的发酵条件下,发酵底物相同,而发酵剂不同,导致发酵产物中功能成分含量的改变,因此发酵剂中微生物与发酵产物之间可能存在相关性, 典型相关分析(canonical correlation analysis,CCA)/RDA排序如图4所示。
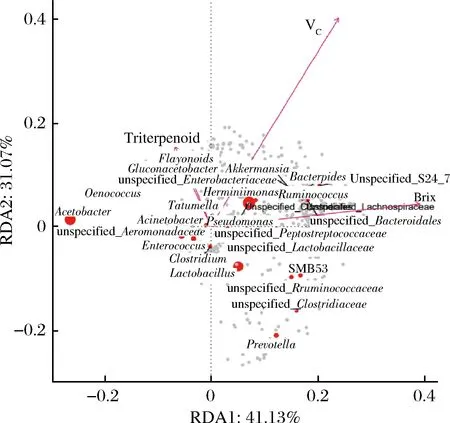
图4 不同酒曲发酵的刺梨酵素菌群属水平物种CCA/RDA排序图Fig.4 CCA/RDA sequence of flora genus of Roxburgh rose Jiaosu in different regions
RDA物种排序图内,环境因子用箭头表示,箭头连线的长度代表某个环境因子与群落分布和种类分布间相关程度的大小(解释方差的大小),箭头越长,说明相关性越大,反之越小[20]。箭头连线和排序轴的夹角代表某个环境因子与排序轴的相关性大小,夹角越小,相关性越高,反之越低。环境因子之间的夹角为锐角时表示2个环境因子之间呈正相关关系,钝角时呈负相关关系。每个点代表一个物种,点越大,对应物种丰度越高,灰色点代表丰度较低的物种[21],通过功能因子用箭头连线的长度代表某个环境因子与群落分布和种类分布间相关程度的大小[22]。由图4可知,刺梨酵素中的功能成分与菌群结构之间存在相关性,通过图中原点大小判断醋酸杆菌属(Acetobacter)、假单胞菌属(Pseudomonas)、乳酸杆菌属(Lactobacillus)、葡糖醋杆菌属(Gluconacetobacter)与刺梨酵素中功能成分的相关性较大,通过箭头连线的长度可知VC与菌群的相关程度最大,功能因子总三萜和总黄酮之间夹角为锐角,表明2个指标之间具有协同效应。而糖度与总三萜、总黄酮之间夹角为钝角,表明糖度与功能因子总三萜和总黄酮之间呈负相关性,由以上结果可知,刺梨酵素中细菌菌群组成与其含有的主要功能成分之间存在相关性。
3 结论
本试验采用高通量测序方法对贵州不同区域酒曲发酵的刺梨酵素细菌群落组成和多样性进行分析,比较不同地区酒曲发酵刺梨酵素的微生物群落结构差异,探究刺梨酵素中微生物群落与功能因子的相关性。通过对菌群多样性分析,贵州省7个区域酒曲发酵的刺梨酵素共得到有效序列1 139 057条,平均每个样品51 775条,α-多样性分析表明,铜仁(TR)地区酒曲发酵制备刺梨酵素的微生物多样性和丰富度相对其他地区均较高,而遵义(ZY)地区多样性相对较低,黔东南(QDN)地区丰富度相对较低。从菌群结构组成上分析,醋酸杆菌属(Acetobacter)、乳酸菌属(Lactobacillus)作为酵素中的主要微生物;通过RDA分析得出刺梨酵素中细菌菌群组成与其含有的主要功能成分之间存在相关性,其中与功能因子相关的菌群按照相关性依次为醋酸杆菌属(Acetobacter)、假单胞菌属(Pseudomonas)、乳酸杆菌属(Lactobacillus)、葡糖醋杆菌属(Gluconacetobacter)。以上结论能够为日后从酒曲中筛选益生菌作为酵素发酵剂提供借鉴与参考,同时也为酒曲发酵刺梨酵素的可行性提供了理论依据,后期将进一步探究不同酒曲在刺梨酵素发酵过程中微生物的动态变化,为刺梨酵素的标准化开发提供数据支撑。
