单性木兰枝多酚提取工艺及抗氧化性研究
2020-07-03郑燕菲蓝亮美许建本黄秋萍林依娜
郑燕菲 张 强 蓝亮美许建本 黄秋萍 林依娜
(1. 广西民族师范学院化学化工学院,广西 崇左 532200;2. 广西中医药大学药学院,广西 南宁 530022; 3. 柳州城市职业学院机电与汽车工程系,广西 柳州 545036)
单性木兰又名广西木兰,花单性、雄雌异株[1]。目前,单性木兰的有效成分研究主要集中在挥发油、脂肪酸、多糖、多酚及其生物活性[2-4][5]63-90。黄品鲜等[3]采用气相色谱—质谱联用技术对单性木兰种皮的挥发组分中的油层精油和溶解在水中的化学成分分别进行了定性定量分析;课题组前期曾对单性木兰的新鲜雄花、雌花、叶、果皮和果肉的挥发性成分进行了分析,并研究了单性木兰叶多糖提取工艺及其抗肿瘤活性[4][5]15-37;还优化了单性木兰叶多酚的微波辅助提取工艺,最高提取率为(2.44±0.02)%,并评价得知单性木兰叶多酚具有良好的抗氧化性[6]。但对单性木兰枝中多酚的研究未见报道,若能将修剪丢弃的单性木兰枝作为原料提取多酚类化合物,并将其应用于开发保健药品及功能食品,有利于扩大其应用价值。植物多酚是具有抗氧化[7]、抗菌[8]、抗肿瘤[9-10]等活性的一种可再生绿色资源,其常见的提取方法有溶剂法、微波辅助法、超声辅助法和酶解法等[11],其中超声辅助法因简单易行、溶剂消耗少、提取率高等而被广泛使用[12]。
为了全面构建单性木兰化学成分库,完善开发单性木兰的综合利用,试验拟以单性木兰枝为原料,采用超声波辅助法提取多酚,通过响应面优化设计确定最佳提取工艺,并研究单性木兰枝多酚的总抗氧化性、对DPPH·和·OH的清除作用,以期扩展单性木兰该资源化学成分研究的数据资源以及为单性木兰作为功能性食品、天然抗氧剂品的开发提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
单性木兰枝:采摘于广西南宁武鸣;
福林酚:分析纯,上海宝曼生物科技有限公司;
丙酮:分析纯,国药集团化学试剂有限公司;
单宁酸、结晶紫:分析纯,成都市科龙化工试剂厂;
DPPH:分析纯,阿拉丁工业公司。
1.1.2 仪器与设备
数控超声波清洗仪:KQ-300DB型,上海越众仪器设备有限公司;
分析天平:AR224CN型,上海奥豪斯仪器有限公司;
紫外可见分光光度计:AOE型,翱艺仪器有限公司。
1.2 试验方法
1.2.1 原料预处理 单性木兰枝于50 ℃烘干,粉碎,过40目筛。以石油醚为溶剂,按4∶1 (mL/g)液固比,于70 ℃油浴回流4 h,趁热抽滤,55 ℃烘干3 h,得单性木兰枝脱脂原料,密封保存以备用。
1.2.2 单性木兰枝多酚的定性分析 分别往单性木兰枝多酚提取液中加入少量的0.3% FeCl3溶液、1%明胶溶液,摇匀,观察试验现象;向10 mL单性木兰枝多酚提取液中依次加入1 mL 36%甲醛和2 mL浓盐酸,煮沸,回流30 min,观察试验现象;取单性木兰枝多酚提取液0.1 mL,进行Folin-Ciocalteaus显色,用紫外分光光度计扫描[5]68。以单宁酸作为对照。
1.2.3 单性木兰枝多酚的定量分析 以蒸馏水为溶剂,配制质量浓度为105 μg/mL的单宁酸标准溶液,准确移取0.3,0.5,0.8,1.0,1.3 mL的单宁酸标准溶液于5个25 mL的棕色容量瓶中,加入1.3 mL的福林酚溶液,摇匀静置6 min,加入5 mL的饱和碳酸钠溶液,摇匀静置6 min,定容至刻度线,摇匀避光静置30 min[13]。以单宁酸溶液的质量浓度(x)为横坐标,吸光度(y)为纵坐标,绘制出单宁酸的标准曲线,拟合回归方程为:y=0.106 4x+0.090 7,R2=0.999 2。说明在1.00~6.00 μg/mL范围内,单宁酸呈现良好的线性关系。
准确量取一定体积的样品提取液,用上述方法显色后测定吸光度,用标准曲线方程计算相关浓度,根据式(1)计算单性木兰枝多酚的得率。
(1)
式中:
Y——单性木兰枝多酚的得率,%;
WR——脱脂原料的质量,g;
C——通过标准曲线方程求出的浓度,μg/mL;
V1——提取液的总体积,mL;
V2——测定时量取的提取液体积,mL。
1.2.4 单性木兰枝多酚提取工艺优化 称取10.00 g单性木兰枝脱脂原料,在温度65 ℃下进行超声辅助提取,研究不同提取剂、丙酮浓度、液固比、提取时间对单性木兰枝多酚得率的影响。
(1) 提取剂:采用液固比20∶1 (mL/g),提取时间为10 min,提取剂分别为70%丙酮,70%乙醇,70%乙醇(1%盐酸)酸性溶液,蒸馏水,考察单性木兰枝多酚的得率。
(2) 丙酮浓度:采用液固比20∶1 (mL/g),提取时间为10 min,丙酮溶度分别为50%,60%,70%,80%,90%,考察单性木兰枝多酚的得率。
(3) 液固比:采用丙酮浓度70%,提取时间为10 min,液固比分别为10∶1,15∶1,20∶1,25∶1,30∶1 (mL/g),考察单性木兰枝多酚的得率。
(4) 提取时间:采用丙酮浓度70%,液固比为20∶1 (mL/g),提取时间分别为5,10,15,20,25 min,考察单性木兰枝多酚的得率。
(5) 响应面优化试验:在单因素试验后,对丙酮浓度、液固比、提取时间进行响应面Box-Behnken设计试验,以单性木兰枝多酚得率为评价指标,优化单性木兰枝多酚提取工艺条件。
1.2.5 单性木兰枝多酚的分离 将单性木兰枝多酚提取液在40 ℃下减压浓缩,于50 ℃烘干得多酚粗提物。将单性木兰枝多酚提取液在40 ℃下减压浓缩,依次用石油醚、乙酸乙酯萃取,取乙酸乙酯层和水层于50 ℃下浓缩干燥,分别得到乙酸乙酯层样和水层样。
1.2.6 单性木兰枝多酚抗氧化性的测定 试验取单性木兰枝多酚粗提物、乙酸乙酯层样、水层样为研究对象,对其总抗氧化性、DPPH·清除能力和·OH清除能力进行抗氧化性测定。
(1) 总抗氧化性:分别取质量浓度为0.01,0.02,0.03,0.04,0.05,0.06,0.07 mg/mL的单性木兰枝多酚的粗提物、乙酸乙酯层样、水层样溶液各1 mL,依次加入0.6 mol/L浓硫酸1 mL、28 mmol/L磷酸钠溶液1 mL、4 mmol/L钼酸铵溶液1 mL,于95 ℃的水浴中恒温1.5 h,在695 nm的波长下测定其吸光度[14],用VC溶液作对照。试验平行3次,取平均值。
(2) DPPH·清除作用:分别取质量浓度为0.000 1,0.000 5,0.001 3,0.001 7,0.002 3,0.003 5,0.005 0 mg/mL的单性木兰枝多酚的粗提物、乙酸乙酯层样、水层样溶液2 mL,分别加入0.004 mg/mL的DPPH·乙醇溶液2 mL,摇匀,避光放置0.5 h,在514 nm的波长下测定其吸光度Ai[5]71[15],其中不加DPPH·乙醇溶液时的吸光度为Aj,在加入DPPH·乙醇溶液前用蒸馏水代替多酚样品溶液作空白,测定吸光度A0,用VC溶液作对照。试验平行3次,取平均值。按式(2)计算单性木兰枝多酚对DPPH·的清除率。
(2)
式中:
S——多酚对DPPH·的清除率,%;
A0——水与DPPH·混合溶液的吸光度;
Ai——样品溶液与DPPH·混合反应后的吸光度;
Aj——样品溶液与无水乙醇混合溶液的吸光度。
(3) ·OH清除作用:分别取质量浓度为0.10,0.15,0.20,0.25,0.30,0.35,0.40 mg/mL的单性木兰枝多酚的粗取物、乙酸乙酯层样、水层样溶液1 mL于10 mL刻度试管中,依次加入0.4 mmol/L结晶紫0.3 mL、1.0 mmol/L硫酸亚铁溶液1.2 mL、2.0 mmol/L过氧化氢溶液0.6 mL,用pH 4.0的磷酸氢二钠—柠檬酸的缓冲溶液定容到刻度线,混匀,避光静置0.5 h,在580 nm的波长下测定其吸光度As[16],其中不加过氧化氢溶液时的吸光度为A0,在加入过氧化氢溶液前用蒸馏水代替多酚样品溶液作空白,测定吸光度Ab,用VC溶液作对照。试验平行3次,取平均值。按式(3)计算单性木兰枝多酚对·OH的清除率。
(3)
式中:
S——多酚对·OH的清除率,%;
A0——体系中不加过氧化氢溶液的吸光度;
As——加入样品溶液的吸光度;
Ab——不加样品溶液的吸光度。
2 结果与分析
2.1 单性木兰枝多酚的定性分析
2.1.1 颜色反应对比 用单性木兰枝的多酚提取液的颜色反应进行定性分析,用单宁酸溶液作对比,结果如表1所示。由表1可知,单性木兰枝的提取液中含有多酚类物质——单宁。
2.1.2 紫外可见光谱分析 经福林酚显色,单性木兰枝

表1 提取液和单宁酸的对比
多酚提取液和单宁酸标准品的紫外可见光谱如图1所示。由图1可知,单性木兰枝多酚提取液和单宁酸标准品的最大吸收波长,均显示在760 nm处,故选择760 nm作为测定的吸收波长。
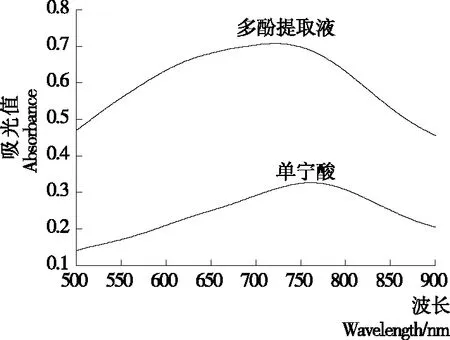
图1 单性木兰枝多酚的紫外可见光谱图
Figure 1 UV spectra ofM.kwangsiensisbranch polyphenols
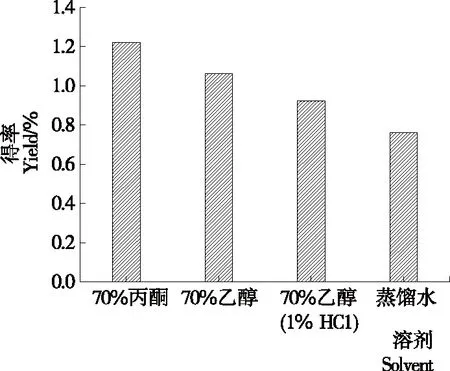
图2 提取剂对单性木兰枝多酚得率的影响
Figure 2 Effect of different solvent on yieldM.kwangsiensisbranch polyphenols
2.2 单性木兰枝多酚提取工艺的优化
2.2.1 提取剂的影响 由图2可知,提取剂对单性木兰枝多酚得率影响的次序为:70%丙酮>70%乙醇>70%乙醇(1%盐酸)酸性溶液>蒸馏水。根据相似相溶原理可知,丙酮溶液与多酚物质的极性相近,确定丙酮溶液为单性木兰枝多酚的最佳提取溶剂。
2.2.2 丙酮浓度的影响 由图3可知,随着丙酮浓度的增大,单性木兰枝多酚的得率呈先增大后降低的趋势,当丙酮浓度为70%时得率最高,原因可能是丙酮浓度过大,脂溶性物质溶出增加,从而多酚得率降低[17]。故选择60%,70%,80% 3个水平进行响应面优化试验。
2.2.3 液固比的影响 由图4可知,随着液固比的增大,单性木兰枝多酚的得率呈先增大后趋于平缓的趋势,在液固比>20∶1 (mL/g)时,单性木兰枝多酚得率几乎保持不变。适当增大液固比有利于多酚溶出,但液固比过大,会消耗大量溶剂、增大后续浓缩的操作难度[18]。故选择15∶1,20∶1,25∶1 (mL/g)3个水平进行响应面优化试验。
2.2.4 提取时间的影响 由图5可知,随着提取时间的增加,单性木兰枝多酚的得率呈先增大后减少的趋势,当提取时间为15 min时得率最大,这是因为刚开始超声辅助提取时,单性木兰枝粉末细胞破碎度逐渐增加,但超声提取时间过长时,多酚虽已基本溶出,但部分多酚已被氧化分解[19]。故选择10,15,20 min 3个水平进行响应面优化试验。

图3 丙酮浓度对单性木兰枝多酚得率的影响
Figure 3 Impact of acetone concentration on yield ofM.kwangsiensisbranch polyphenols
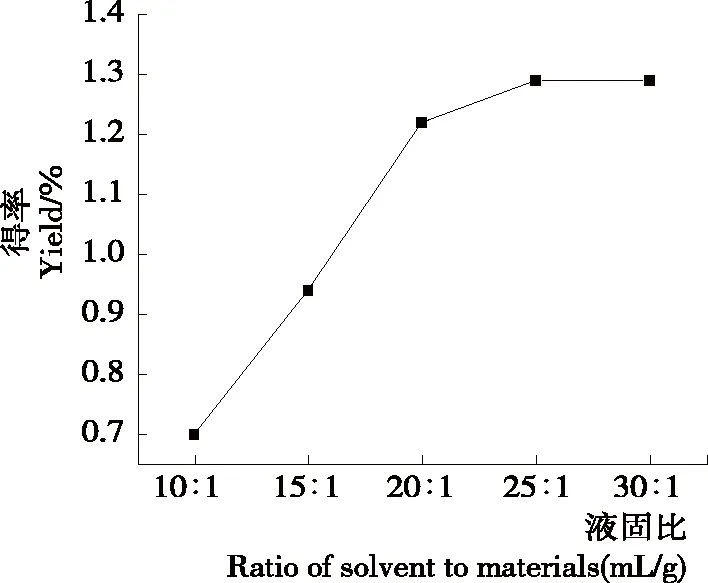
图4 液固比对单性木兰枝多酚得率的影响
Figure 4 Impact of ratio of solvent to materials on yield ofM.kwangsiensisbranch polyphenols
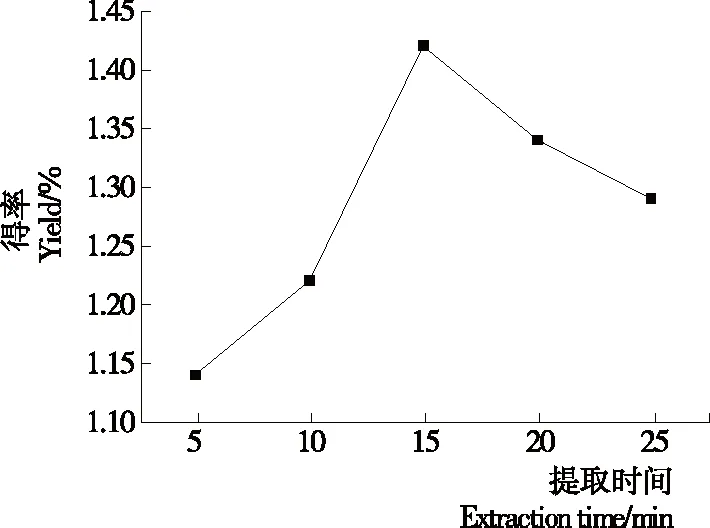
图5 提取时间对单性木兰枝多酚得率的影响
Figure 5 Impact of extraction time on yield ofM.kwangsiensisbranch polyphenols
2.2.5 提取条件的优化 根据单因素试验结果,选择丙酮浓度、液固比、提取时间3个因素进行响应面优化试验。试验选取的因素与水平见表2,试验方案与结果见表3。
表2响应面设计试验的因素和水平表
Table 2 Independent variables and their levels in the response surface methodology test
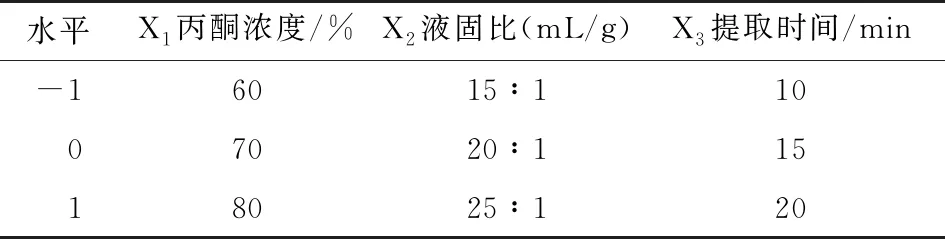
水平X1 丙酮浓度/%X2 液固比(mL/g)X3 提取时间/min-16015∶11007020∶11518025∶120
表3响应面设计试验方案及结果
Table 3 The experimental design and results for yield of polyphenols in the response surface methodology test
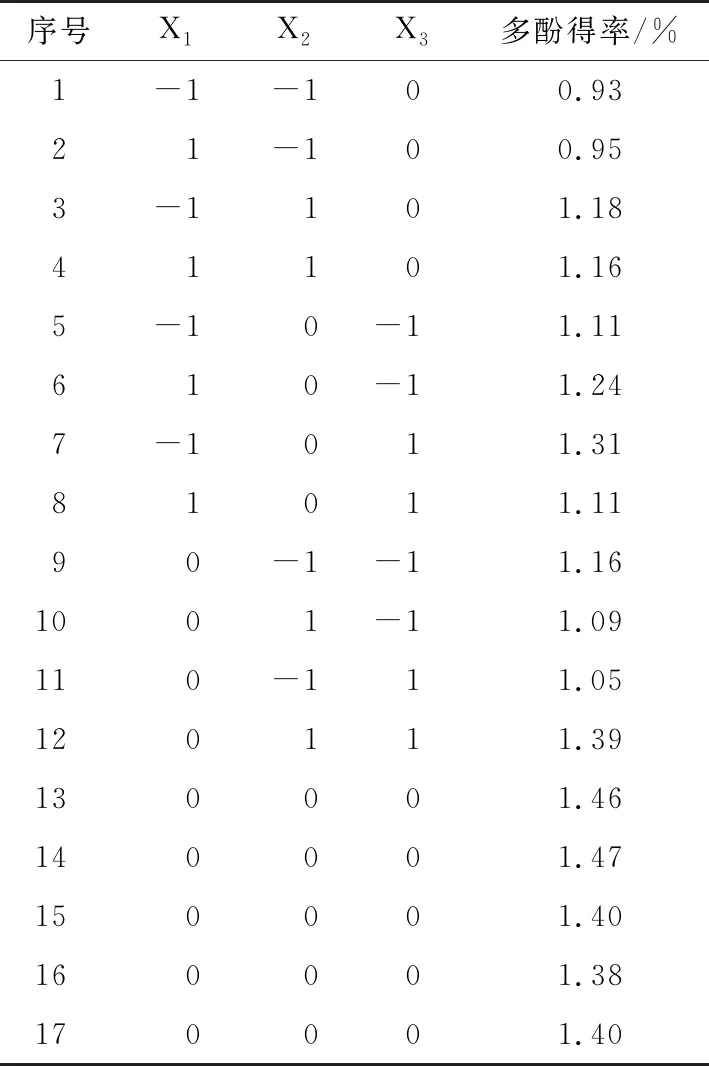
序号X1X2X3多酚得率/%1-1-100.9321-100.953-1101.1841101.165-10-11.11610-11.247-1011.3181011.1190-1-11.161001-11.09110-111.05120111.39130001.46140001.47150001.40160001.38170001.40
对表3中的试验结果进行响应面优化分析,将各个数值与对应的各因素之间的关系进行二元回归拟合,可以得到单性木兰枝多酚的得率(Y)对丙酮浓度(X1)、液固比(X2)、提取时间(X3)的回归方程为:
Y=-11.86+0.270 8X1+0.280 4X2+0.107 2X3-0.000 2X1X2-0.001 7X1X3+0.004 1X2X3-0.001 7X12-0.007 7X22-0.002 3X32。
(4)
由回归方程可知,对单性木兰枝多酚得率影响的因素从大到小的顺序为:液固比>丙酮浓度>提取时间。将单性木兰枝多酚得率的二次多项回归方程进行方差分析,结果见表4。
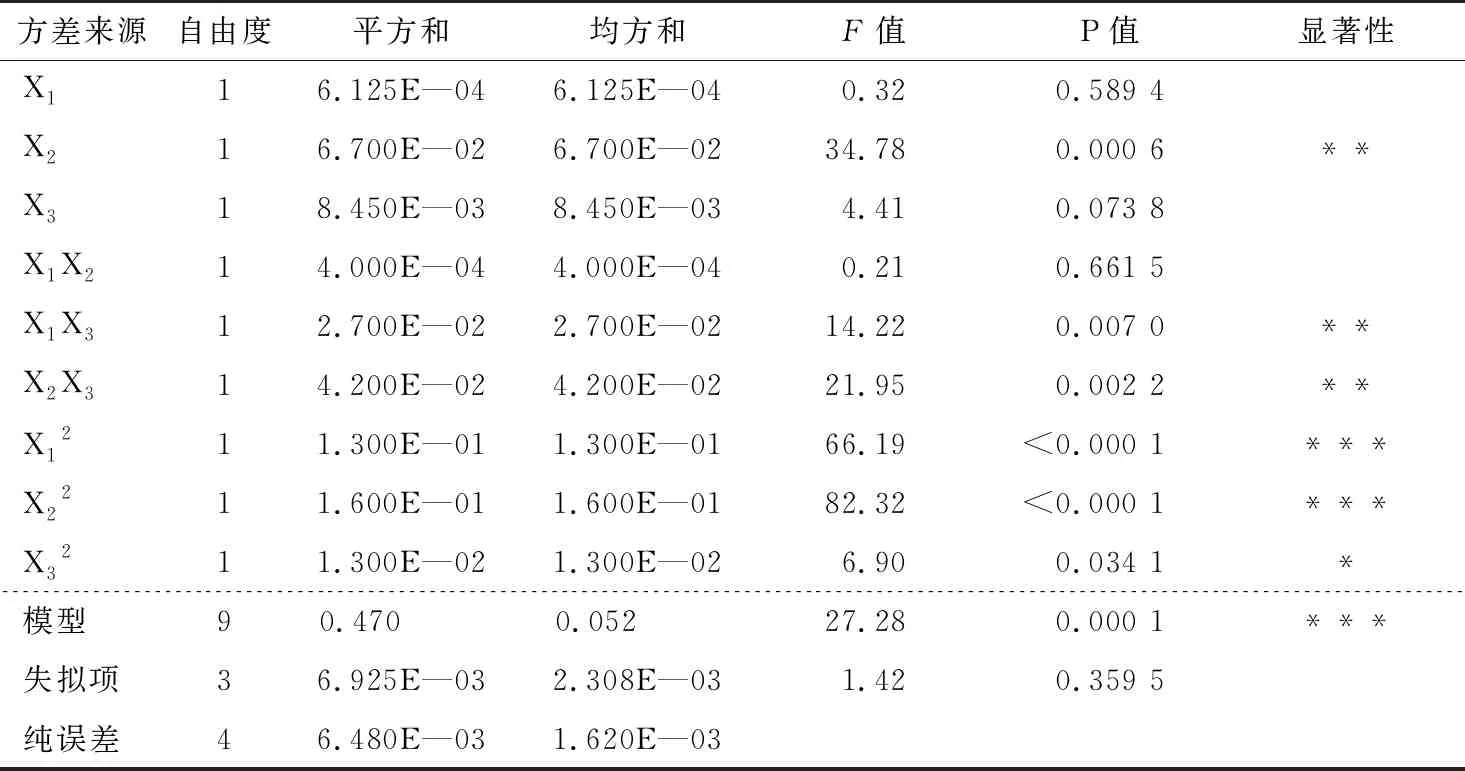
表4 回归方程方差分析†
† * P<0.05,** P<0.01,*** P<0.000 1。
由表4可知,R2=0.972 3,失拟项不显著,表明单性木兰枝多酚得率的二次多项方程拟合较好,方程可靠性较强。在一次项X1、X2、X3中,仅X2的P值在0.001~0.010范围内,效果较为显著,表明液固比对单性木兰枝多酚的得率影响最强,丙酮浓度和提取时间影响较弱。在交互项X1X2、X1X3、X2X3中,丙酮浓度和提取时间、液固比和提取时间之间的交互作用对单性木兰枝多酚的得率均有较强的影响。在二次项X12、X22、X32中,丙酮浓度和液固比的二次项比提取时间的二次项对单性木兰枝多酚的得率影响较大。
2.2.6 响应面图和等高线图分析 通过Design Expert 7.0软件对响应面的试验结果进行拟合,研究丙酮浓度、液固比、提取时间这3个因素对单性木兰枝多酚得率的影响相应的响应面和等高线如图6~8所示。由图6~8可
知,对单性木兰枝多酚得率影响较大的是丙酮浓度和提取时间、液固比和提取时间的交互作用,影响较小的是丙酮浓度和液固比的交互作用。
2.2.7 最优条件的验证 通过响应面优化试验得单性木兰枝多酚最优提取条件为:67.40%丙酮浓度、22.44∶1 (mL/g)液固比、19.64 min提取时间,预测单性木兰枝多酚的得率为1.46%。综合试验条件,将最优提取条件调整为67%丙酮浓度、22∶1 (mL/g)液固比、20 min提取时间。在调整后的条件下平行提取4次,单性木兰枝多酚的得率分别为1.46%,1.45%,1.45%,1.44%,平均得率为1.45%,与预测值的相对误差为0.46%,证明该响应面优化试验结果可靠。有文献[5]82[6]指出,单性木兰叶中多酚的得率为2.44%,高于试验单性木兰枝多酚得率,可能是因为单性木兰不同部位的多酚含量有所差别,或是因为不同提取条件对得率有影响。
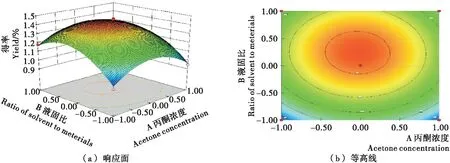
图6 丙酮浓度和液固比对多酚得率的3D和2D作用

图7 丙酮浓度和提取时间对多酚得率的3D和2D作用

图8 液固比和提取时间对多酚得率的3D和2D作用
2.3 单性木兰枝多酚的抗氧化性
2.3.1 总抗氧化性 由图9可知,所有样品溶液的总抗氧化性均随浓度的增大而增强。当浓度为0.07 mg/mL时,VC的吸光度为0.56,单性木兰多酚的粗提物、乙酸乙酯层样、水层样的吸光度分别VC的40.71%,30.18%,41.07%。说明单性木兰多酚具有一定的总抗氧化性,但弱于VC。
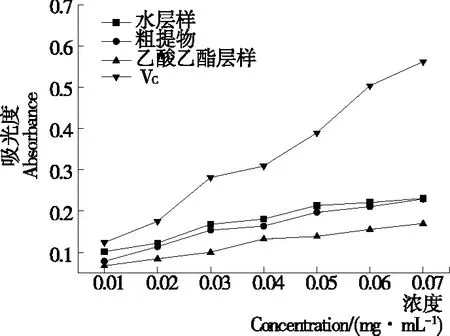
图9 单性木兰枝多酚的总抗氧化性能力
Figure 9 Total antioxidant activities ofM.kwangsiensisbranch polyphenols
2.3.2 DPPH·清除作用 由图10可知,单性木兰枝多酚样品对DPPH·清除能力与浓度呈正相关。当浓度为0.005 mg/mL时,单性木兰枝多酚的粗提物、乙酸乙酯层样、水层样的清除率分别为90.22%,67.39%,82.61%。与VC的清除作用相比,单性木兰枝多酚具有良好的DPPH·清除效果。
2.3.3 ·OH清除作用 由图11可知,单性木兰枝多酚样品对·OH具有良好清除能力,清除能力与浓度呈正相关的量效关系。当浓度为0.40 mg/mL时,VC对·OH的清除率为36.43%,而单性木兰枝多酚的清除作用均强于VC,粗提物、乙酸乙酯层样、水层样的清除率分别相当于VC的2.31,2.69,2.41倍。
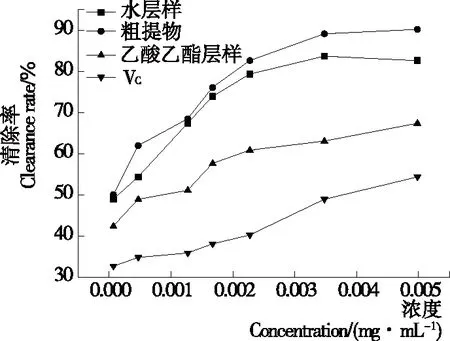
图10 单性木兰枝多酚的DPPH·清除能力
Figure 10 Scavenging activities ofM.kwangsiensisbranch polyphenols on DPPH·
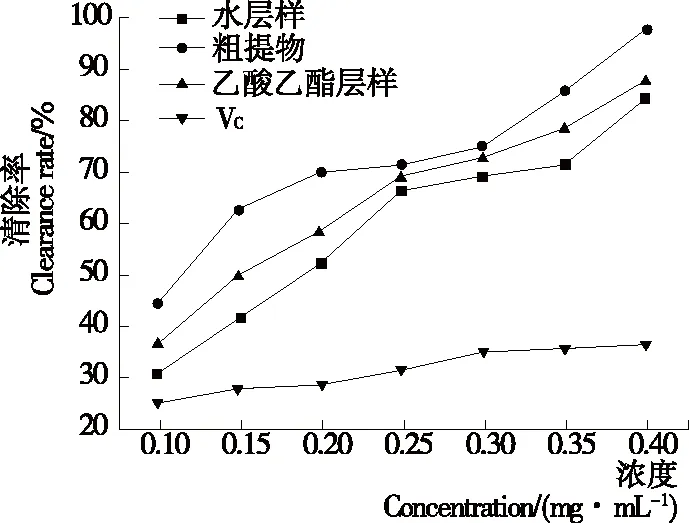
图11 单性木兰枝多酚的·OH清除能力
Figure 11 Scavenging effect ofM.kwangsiensisbranch polyphenols on ·OH
3 结论
试验采用响应面设计法优化单性木兰枝多酚超声波辅助提取法提取工艺最优条件:丙酮浓度67%,液固比22∶1 (mL/g),提取时间20 min,该条件下,单性木兰枝多酚得率达1.45%。抗氧化性研究发现,单性木兰枝多酚具有一定的总抗氧化性,但具有良好的DPPH·和·OH清除效果,说明单性木兰枝多酚可开发作为食品、药品、化妆品等行业的天然抗氧化物。试验并未对单性木兰枝多酚类物质进行深入的纯化分离,后续可采用大孔吸附树脂进行分析纯化,以及探究单性木兰枝多酚抗氧性的量效关系。
