三叶青主要成分抗炎作用及其机制
2020-07-03郑溜丰邓泽元刘小如
邢 倩 郑溜丰 甘 婷 肖 婷 邓泽元 刘小如
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
由肥胖、糖尿病等导致的心血管疾病已成为全球死亡的首要原因[1]。根据《中国心血管病报告2018》指出,过去10年中国死于心血管疾病的居民占总构成比的40%以上,居于首位,高于肿瘤及其他疾病[2]。虽然心血管疾病的病因和发病机制复杂,但慢性低水平炎症是包括心血管疾病在内的多种慢性病发生发展的典型特征之一[3]。炎症本身是人体重要的免疫性防御机能,但是长期过剩的慢性低水平炎症会造成人体功能受损,最终直接导致慢性病的发生[4-5]。更有研究[6]指出,动脉粥样硬化最有潜质的干预靶点是低水平炎症。另外,血管内皮细胞损伤是心血管疾病发生的始动环节,其中炎症是其重要诱因[7]。因此,通过抑制低水平炎症导致的血管内皮细胞损伤是防治心血管疾病的重要手段[8]。
近年来发现,药食兼用植物以安全、低耐药、特异性强等优势对于炎症有良好的治疗作用[9]。三叶青(TetrastigmahemsleyanumDiels et Gilg)是中国民间常用的中草药,有药食两用功效,主要分布于江西、安徽、浙江及西南地区[10],以安全无副作用、低耐药性的特点被广泛应用[11]。作为中草药,三叶青具有祛风化痰,清热解毒等多种活性。三叶青临床应用历史悠久,对于治疗恶性肿瘤、炎症反应、抗病毒、保肝的效果尤为显著[12-13]。三叶青的抗癌作用已被广泛研究[14],其可抑制癌细胞的生长与繁殖。Peng等[15]发现三叶青乙酸乙酯提取物可激活线粒体途径,诱导人肝癌细胞HepG2的凋亡。试验主要探究三叶青的抗炎活性成分,为三叶青的药用价值寻找新靶点。Liu等[16]报道了以10~160 μg/mL的三叶青根部黄酮粗提物处理细胞,可以显著降低一氧化氮、IL-1β、TNFα等促炎因子的产生,抑制NF-κB通路活性,并上调抗炎细胞因子IL-10的表达,从而缓解炎症反应。这些提示除抗癌外,三叶青有望成为安全有效的药食两用抗炎中草药。此外,课题组[17]从三叶青的根部和叶片中鉴定出了133种天然产物,其中根部中山奈酚-3-O-芸香糖苷、芦丁、异槲皮素含量较多;而叶片中富含的成分有5-咖啡酰奎宁酸、荭草苷、异牡荆苷、异荭草苷、牡荆苷,但具体何种成分发挥抗炎作用及其机制有待于进一步研究。核转录因子NF-E2相关因子(Nuclear factor NF-E2 related factor,Nrf2)是被广泛关注的药效靶标,参与对慢性病下细胞损伤的保护作用,激活Nrf2可成为防治心血管疾病的有效方法[18-19]。最新的研究指出,Nrf2是抗炎网路中的关键节点[20],在正常条件下,Nrf2主要存在于细胞质中,与泛素连接酶肌动结合蛋白Keap1结合并促进自身泛素化及降解[21]。值得注意的是,与Keap1的结合是植物活性物质促使Nrf2解离并入核发挥作用的关键环节[22]。
试验拟基于与Keap1蛋白的分子对接,从三叶青中筛选了可能具有潜在抗炎活性的成分,同时在肿瘤坏死因子-α(Tumor necrosis factor-α,TNFα)联合白细胞介素-17(Interleukin-17,IL-17)诱导的血管内皮细胞低水平炎症模型下深入探究具体何种活性成分能强效抗炎,并分析该活性成分在培养基及缓冲盐溶液中的稳定性及细胞中的摄取,同时揭示其抗炎机制,旨在为三叶青发挥强效抗炎作用提供有力的依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料
人脐静脉血管内皮细胞(Human umbilical vein endothelial,HUVEC):武汉普诺赛生命科技有限公司。
1.1.2 试剂
细胞因子IL-17、肿瘤坏死因子TNFα:美国Peprotech公司;
Ham's F-12K (Kaighn's) Medium(F-12K)培养基:武汉普诺赛生命科技有限公司;
胎牛血清(FBS):以色列Biolnd公司;
胰蛋白酶:美国Sigma公司;
山奈酚-3-O-芸香糖苷、异槲皮苷、芦丁、5-咖啡酰奎宁酸(新绿原酸)、牡荆苷、荭草苷标准品:>98%,中国索莱宝科技有限公司;
Cell Counting Kit-8(CCK-8试剂盒)、BCA蛋白浓度测定试剂盒:中国碧云天生物科技公司;
RIPA裂解液:加拿大Thermo Fisher公司;
一抗:英国Abcam公司;
二抗:北京全式金生物有限公司;
TRIzolTMReagent:加拿大Thermo Fisher公司;
PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time):日本TaKaRa公司;
Bestar®qPCR mastermix(SYBR Green):德国DBI®Bioscience公司。
1.1.3 仪器与设备
超高效液相色谱仪:1290型,美国Agilent公司;
三重四级杆液质联用仪:6470型,美国Agilent公司;
生物安全柜:BHC-1300A/B3型,苏州安泰空气技术有限公司;
低温高速离心机:Neofuge 15R型,香港力康公司;
细胞破碎仪:Qsonica Sonicator Q500型,加拿大Thermo Fisher 公司;
CO2细胞培养箱:Forma series II型,加拿大Thermo Fisher公司;
化学发光成像仪:ChemiDocTMXRS+型,美国伯乐公司;
蛋白质电泳仪:DYCZ-24DN型,北京六一生物科技有限公司;
转膜仪:Criterion系,美国伯乐公司;
倒置显微镜:37XC(XDS-1A)型,上海蔡康光仪器公司;
震荡混合器:WH-866型,中国太仓科教器材厂;
实时定量PCR:CFX96 Touch型,美国伯乐公司。
1.2 方法
1.2.1 Keap1蛋白的同源建模和分子对接 采用同源模型服务软件SWISS-MODEL预测人源Keap1蛋白的三维结构,选择相似度且评分最高的模型作为蛋白的三维晶体结构[23]。采用Ramachandran plot和Profile-3D方法对模型进行评估,进一步采用分子对接软件AutoDockTools将Keap1与成分进行对接,使用Flexible Docking模块计算两者相互作用的位点及对接能。成分的分子结构从Automated Topology Builder上下载。
1.2.2 细胞培养 人脐静脉血管内皮细胞HUVEC培养在含10%胎牛血清(FBS)及0.1%双抗的F-12K培养基中。待细胞长满后弃去培养液,用磷酸盐缓冲液(PBS)洗涤细胞两次,加入含乙二胺四乙酸的胰蛋白酶液消化细胞,显微镜下观察到游离细胞后弃去消化液,加入培养液反复吹打,稀释后装入新培养瓶置于37 ℃、5% CO2恒温恒湿箱中培养。
1.2.3 Western blot测定细胞蛋白表达水平 将山柰酚-3-O-芸香糖苷、异槲皮苷、芦丁、5-咖啡奎宁酸、牡荆苷、荭草苷标准品分别用二甲基亚砜溶解,配成200 mmol/L的母液,用培养基稀释至试验需求浓度。将HUVEC细胞用胰蛋白酶消化后加入培养基稀释。取6 cm小皿,每皿加入3 mL细胞,放进37 ℃、5% CO2培养箱培养12 h至贴壁。倒掉培养基,每皿加入不同浓度的标准品孵育2 h,再用1 ng/mL TNFα联合100 ng/mL IL-17诱导细胞低水平炎症,37 ℃培养12 h。结束后参考Zheng等[24]的方法制备细胞全蛋白裂解液,BCA法测定蛋白浓度,进行SDS-PAGE电泳及转膜,最终发光显影拍照,导入软件分析得到蛋白表达量。
1.2.4 CCK8方法测定细胞存活率 96孔板中每孔加入100 μL细胞悬液,待细胞贴壁。在进行牡荆苷自身的细胞毒性试验时加入不同浓度的牡荆苷,每个浓度8个复孔,37 ℃、5% CO2培养箱内培养24 h。在进行牡荆苷缓解内皮细胞炎症的试验时先加入不同浓度的牡荆苷孵育2 h,再用1 ng/mL TNFα联合100 ng/mL IL-17诱导细胞低水平炎症,37 ℃、5% CO2培养24 h。培养结束后倒掉培养基,加入CCK8,1 h后用酶标仪测定OD450 nm值。按式(1)计算细胞存活率。
(1)
式中:
c——细胞存活率,%;
OD1——试验组OD450 nm值;
OD2——对照组OD450 nm值。
1.2.5 荧光定量PCR检测mRNA表达 细胞接种到24孔板中,贴壁后加入不同浓度牡荆苷培养24 h。使用Trizol试剂提取法[24]提取细胞中总RNA,按照逆转录试剂盒操作得到所需cDNA,取2 μL进行扩增。引物序列:Nrf2,上游5'-CACATCCAGTCAGAAACCAGTGG-3',下游5'-GGAATGTCTGCGCCAAAAGCTG-3';白细胞介素-1β(IL-1β),上游5'-GCATCCAGCTACGAATCTCC-3',下游5'-GAACCAGCATCTTCCTCAGC-3';细胞间黏附分子(ICAM),上游5'-GGAAATACTGAAACTTGCTGCCTAT-3',下游5'-ACACATGTCTATGGAGGGCCAC-3';β-actin,上游5'-CCTGACTGACTACCTCATGAAG-3',下游5'-GACGTAGCACAGCTTCTCCTTA-3'。配置好反应混合液,加入96孔反应板中,使用荧光定量PCR仪进行扩增。
1.2.6 药物稳定性的测定 用F-12K培养基或Hank's平衡盐溶液(HBSS)稀释牡荆苷标准品至60 μmol/L。放入37 ℃、5% CO2恒温恒湿培养箱中培养,在0.0,0.5,1.0,2.0,4.0,6.0,12.0 h后取出,过0.22 μm的滤膜,利用超液相色谱检测牡荆苷的含量。
液相条件:色谱柱型号为Zorbax Eclipse Plus C18(5 μm,3.0 mm×100 mm);流动相0.1% 甲酸—乙腈(A)和0.1% 甲酸—水(B)。梯度洗脱条件为:0~2 min,20%~25% A;2~7 min,25%~30% A;7~8 min,30%~20% A。流速0.3 mL/min,色谱柱温度25 ℃,参比波长280 nm,收集波长340 nm,进样量10 μL。
以0 h培养基中牡荆苷的含量作为100%,将不同处理时间下牡荆苷的含量与0 h的含量对比分析,得到牡荆苷随时间变化在培养基中残留的百分率。
1.2.7 细胞吸收的测定 HUVEC细胞接种于6 cm培养皿中,贴壁后加入不同浓度牡荆苷培养2 h。弃去细胞培养液,PBS洗涤两遍,加入1.5 mL PBS收集细胞至离心管中,取1/10测蛋白浓度,剩下的部分2 000 r/min离心5 min。弃上清,5%甲酸—甲醇复溶,冰水浴超声处理5 min使细胞破碎,结束后放入-80 ℃冰箱过夜。第2天取出室温溶解,涡旋2 min,2 000 r/min离心10 min,收集上清。再用1 mL 5%甲酸—甲醇重复提取两次。上清液合并,氮吹后用250 μL甲醇复溶,过0.22 μm滤膜,用液相色谱-质谱联用仪检测分析细胞中牡荆苷的含量。
质谱条件:采用三重串联四级杆质谱仪,装备电喷雾离子源(ESI),负离子+MRM模式定量分析。牡荆苷的定量条件为:母离子m/z431.1,子离子m/z311.1,裂解电压160 V,碰撞能18 eV;进样量5 μL[25]。
1.2.8 数据处理与分析 每个样品指标测定3次,以均值±标准偏差(mean±SD)形式表示。以SPSS软件中的单因素方差分析处理,Duncan比较进行显著性分析,P<0.05(*)、P<0.01(**)、P<0.001(***)表示与未处理的对照组有显著性差异。P<0.05(#)、P<0.01(##)、P<0.001(###)表示与1 ng/mL TNFα联合100 ng/mL IL-17诱导的低水平炎症组有显著性差异。
2 结果与分析
2.1 三叶青中6种候选成分与Keap1蛋白的分子对接
分子对接是一种在分子层面预测配体和受体之间结合模式和亲合力的一种理论模拟方法。试验采用分子对接方法初步对比分析了三叶青根部和叶片中几十种含量丰富的成分与Keap1蛋白的结合能力,筛选出了6种成分可与Keap1蛋白显著结合,分别是山柰酚-3-O-芸香糖苷、异槲皮苷、芦丁、5-咖啡奎宁酸、牡荆苷和荭草苷。由图1可知,这6种成分均结合在Keap1蛋白分子的活性空腔之中,并且主要的结合位点是缬氨酸残基。该活性空腔恰恰是Keap1与Nrf2结合的区域,提示这6种成分与Keap1的结合很可能阻断了Keap1与Nrf2的相互作用,进而使Nrf2解离活化。另外,白藜芦醇具有良好的抗炎活性,通常作为阳性对照,图1中显示山柰酚-3-O-芸香糖苷、异槲皮苷、芦丁、5-咖啡奎宁酸、牡荆苷和荭草苷6种成分的对接能均小于白藜芦醇的,证明与Keap1蛋白的结合能力均强于白藜芦醇;其中最强的是山柰酚-3-O-芸香糖苷,其次是牡荆苷。以上提示,三叶青中的这6种成分可能均具有良好的抗炎效果。
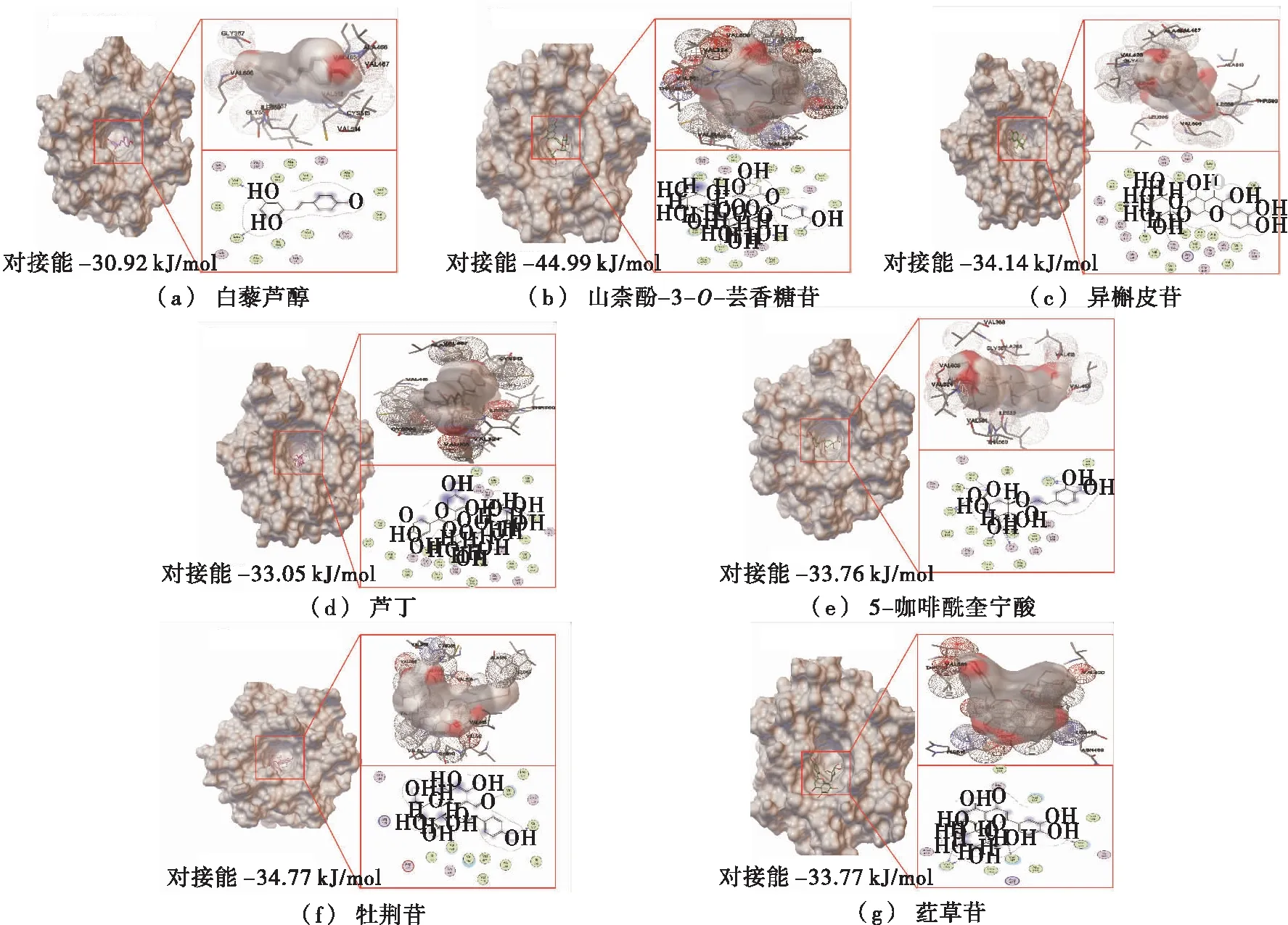
图1 三叶青中6种候选成分与Keap1蛋白的分子对接
Figure 1 Molecular docking betweensix candidate ingredients inTetrastigmahemsleyanumDiels et Gilg and Keap1 protein
2.2 三叶青中6种候选成分对血管内皮细胞炎症的抑制作用
研究使用浓度为100 μmol/L或50 μmol/L的成分处理细胞,联合低剂量TNFα与IL-17诱导低水平血管内皮细胞炎症,采用Western blot法检测山柰酚-3-O-芸香糖苷、异槲皮苷、芦丁、5-咖啡奎宁酸、牡荆苷和荭草苷6种成分对促炎因子和黏附分子表达的影响。如图2所示,联合低剂量TNFα与IL-17可升高各类炎症相关因子的蛋白表达,6种成分可不同程度的下调炎症因子表达量。当浓度为100 μmol/L时,异槲皮苷、芦丁、荭草苷、牡荆苷对于ICAM的抑制作用更为显著,而牡荆苷可更加显著地抑制血管细胞黏附分子(VCAM)的表达。当浓度为50 μmol/L时,牡荆苷更明显地下调了白细胞介素-6(IL-6)和白细胞介素-8(IL-8)的蛋白表达。综上所述,牡荆苷的抗炎效果最明显。
2.3 牡荆苷对血管内皮细胞炎症损伤的保护作用
CCK8试验测定了牡荆苷对HUVEC细胞的毒性作用以及在血管内皮细胞中牡荆苷对低剂量TNFα与IL-17诱导低水平炎症的缓解作用,结果见图3。图3(a)为牡荆苷对血管内皮细胞的毒性作用,与未处理的空白对照组细胞相比,牡荆苷浓度<80 μmol/L时,对细胞活性没有影响,高于80 μmol/L后对细胞表现明显的抑制生长作用。因此,选用20,40,60 μmol/L作为试验组浓度。图3(b)显示,与对照组相比,联合低剂量TNFα和IL-17降低细胞存活率,但以20,40,60 μmol/L牡荆苷对血管内皮细胞预孵2 h后,细胞存活率呈浓度依赖性的升高,证明牡荆苷对低剂量TNFα与IL-17诱导的低水平炎症具有缓解作用。
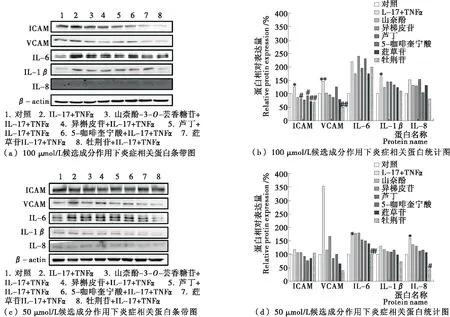
图2 三叶青中6种候选成分的抗炎活性
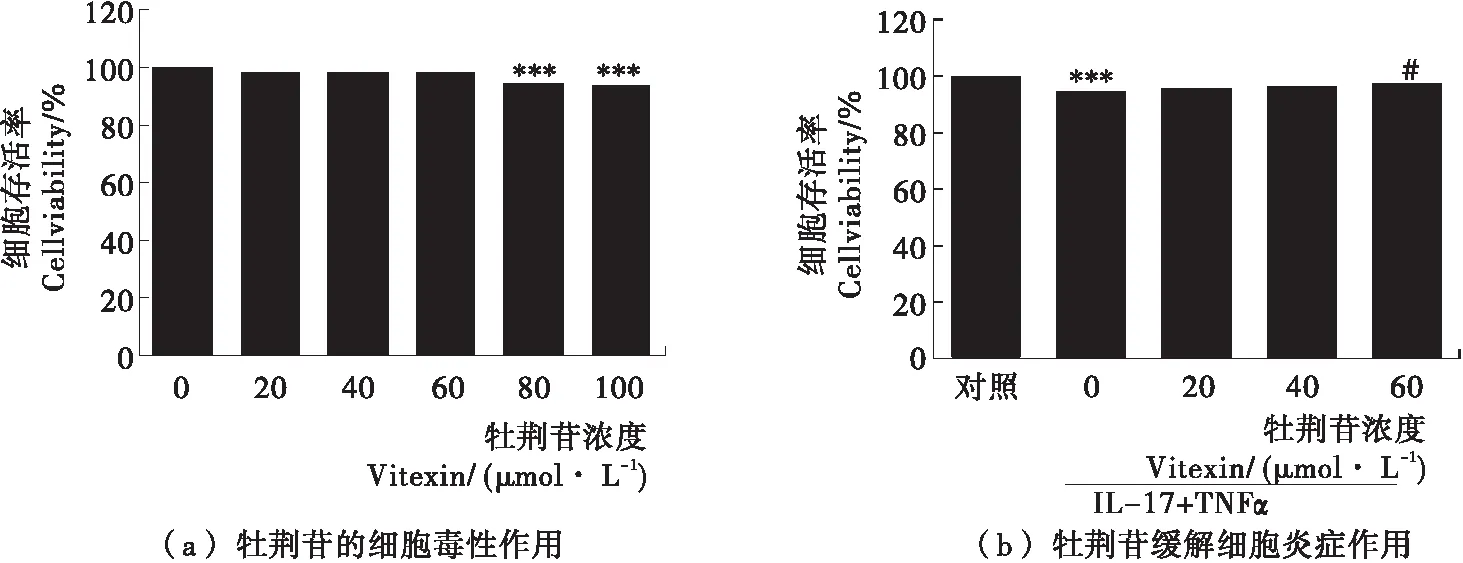
图3 牡荆苷对HUVEC细胞炎症损伤的保护作用
2.4 牡荆苷激活Nrf2信号通路
从Nrf2-Keap1复合物上解离的Nrf2能在细胞内富集并活化,为了在细胞水平进一步验证分子对接结果,即牡荆苷与Keap1的结合可活化Nrf2,试验检测了牡荆苷处理细胞后Nrf2信号通路活性。图4(a)~(c)显示,20~60 μmol/L牡荆苷以浓度依赖方式显著增加Nrf2的基因和蛋白表达水平,相反降低Keap1蛋白的表达水平,故而Nrf2/Keap1比值会逐渐升高[见图4(d)],表明Nrf2通路被激活。
2.5 牡荆苷抑制血管内皮细胞炎症相关因子的基因表达
为检测牡荆苷对HUVEC细胞中炎症相关因子表达的影响,采用荧光定量PCR法检测了20,40,60 μmol/L牡荆苷调节细胞炎症相关因子表达的作用,结果见图5。20,40,60 μmol/L牡荆苷均可下调促炎因子IL-1β和黏附分子ICAM的基因表达,随着牡荆苷浓度的加大基因表达量下降,证明牡荆苷可缓解血管内皮细胞炎症。因此,牡荆苷对血管内皮细胞中低剂量TNFα与IL-17诱导低水平炎症有抑制作用。
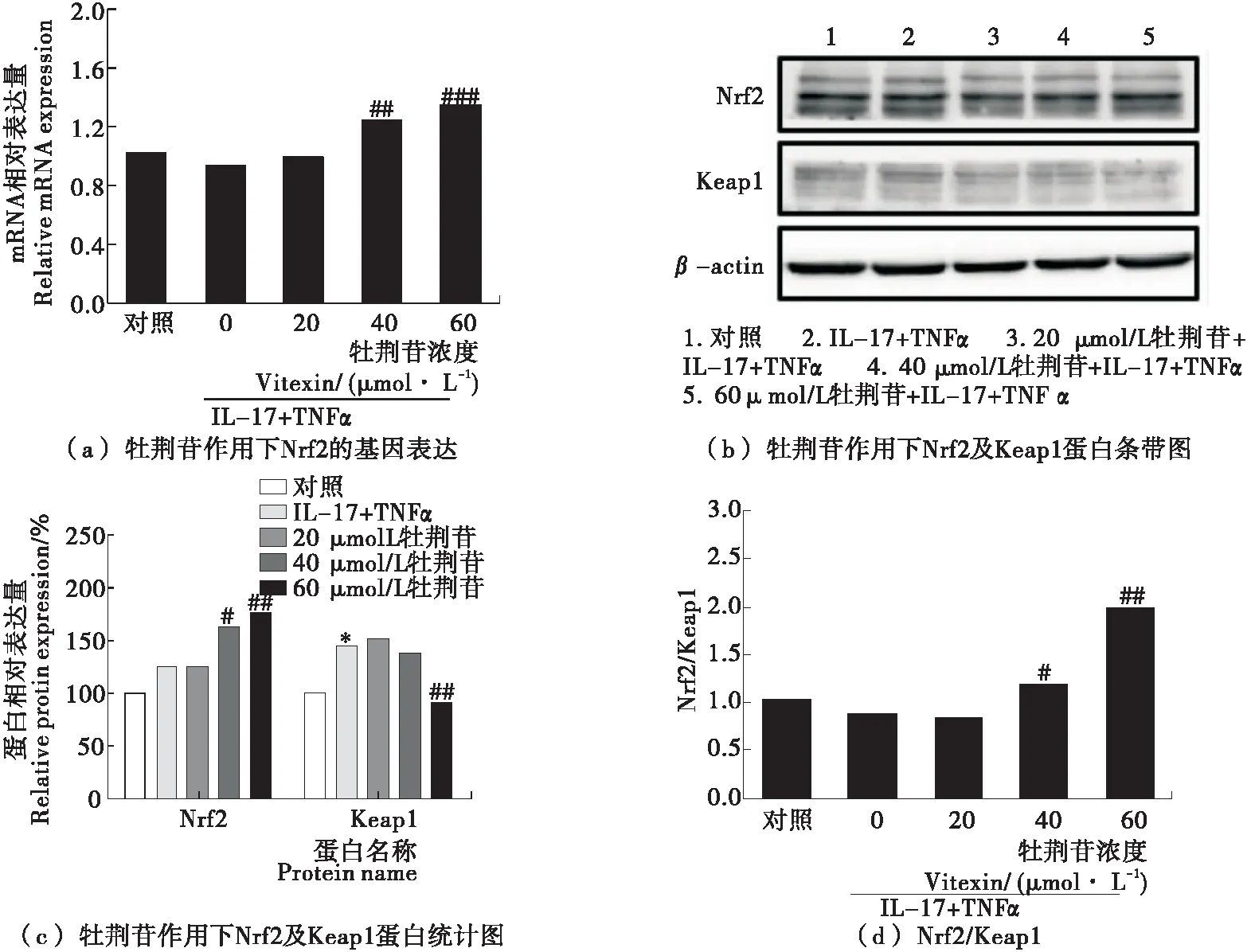
图4 牡荆苷激活Nrf2信号通路

图5 牡荆苷抑制HUVEC细胞炎症相关因子的基因表达
2.6 牡荆苷抑制血管内皮细胞炎症相关因子的蛋白表达
采用Western blot方法研究了20,40,60 μmol/L牡荆苷对HUVEC细胞中炎症相关因子蛋白表达的影响。细胞发生炎症之后,引起炎症相关因子的基因表达升高,由基因进一步翻译成蛋白质,炎症相关因子的蛋白表达如图6所示。20,40,60 μmol/L牡荆苷可逐渐下调炎症相关因子的蛋白表达,其中促炎因子IL-6表达水平与低水平炎症组比有显著性下降,IL-1β无显著差异。证明牡荆苷可抑制促炎因子的蛋白表达,其结果与基因表达结果一致,更好地说明了牡荆苷具有良好的抗炎效果。Lu等[26]证明在C57BL/6小鼠中,牡荆苷抑制脂多糖引起的TNFα、IL-6以及IL-1β表达增加,发挥抗炎作用。
2.7 牡荆苷抑制血管内皮细胞NF-κB信号通路的活性
核因子-κB(NF-κB)调控着细胞的炎症水平,抑制NF-κB信号通路可以阻止产生过多的炎症介质。利用Western blot法检测了牡荆苷对NF-κB p65蛋白磷酸化的影响,结果如图7所示。20,40,60 μmol/L牡荆苷可以逐渐降低磷酸化p65蛋白水平,呈剂量依赖关系。证明了牡荆苷可以抑制NF-κB信号通路的活性,从而进一步降低促炎因子的基因和蛋白表达。
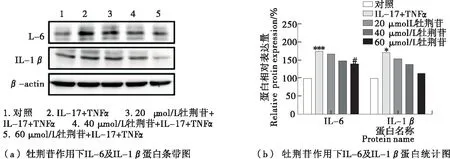
图6 牡荆苷抑制HUVEC细胞炎症相关因子的蛋白表达
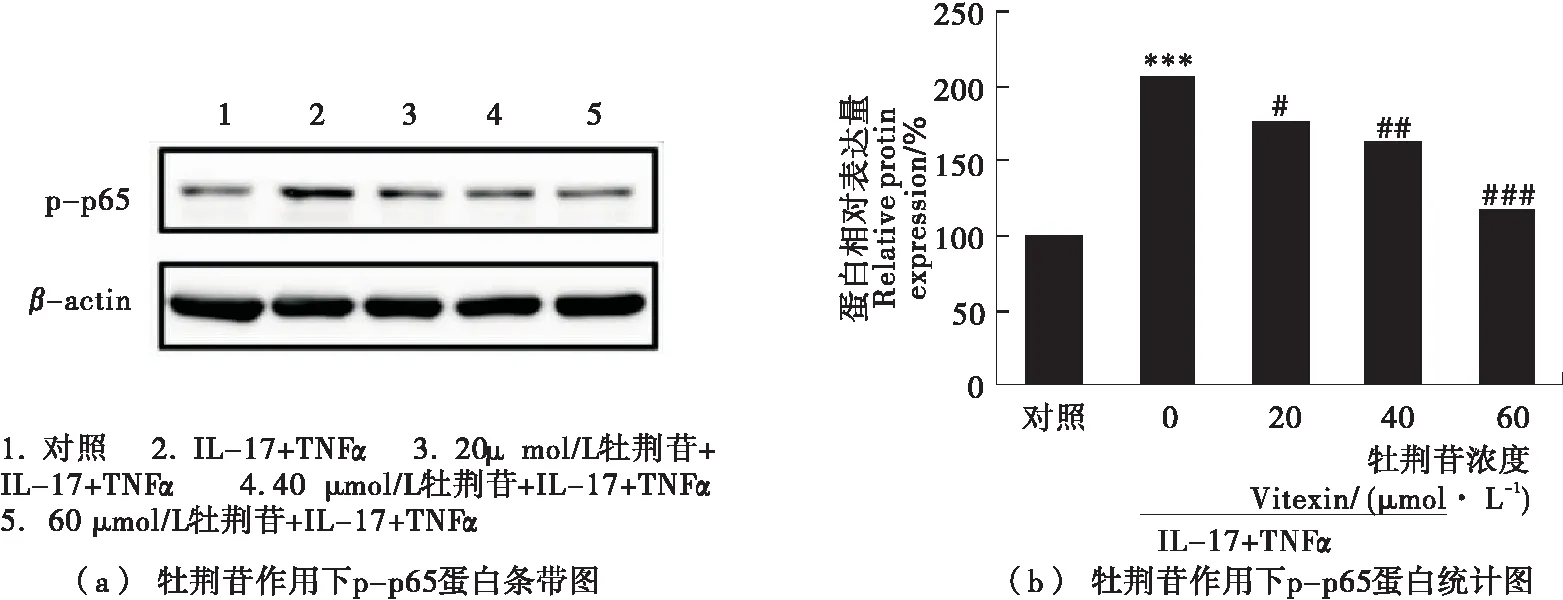
图7 牡荆苷对NF-κB p65蛋白磷酸化的影响
2.8 牡荆苷在细胞培养基及缓冲盐溶液中的稳定性
药物的作用与其在培养基中的稳定性有紧密联系,经不同时间处理后,牡荆苷在HBSS及F-12K培养基中残留的液相图及计算结果见图8。结果表明,牡荆苷在F-12K细胞培养基及HBSS缓冲液中均表现为很强的稳定性,尤其是12 h后在F-12K细胞培养基中的保留率达80%以上。牡荆苷的强稳定性源于自身结构中存在8号位点糖基化[27],而在培养基中稳定性更高可能是由于细胞培养基中含有血清蛋白。Tang等[28]报道,多酚化合物可以与蛋白质相互作用,使得多酚的稳定性增强。
2.9 牡荆苷在血管内皮细胞中的摄取
研究[27]表明,药物的抗炎效果与其细胞内的吸收有关。试验利用了液相三重串联四极杆液相质谱联用系统(HPLC-QqQ-MS)检测了20,40,60 μmol/L牡荆苷在血管内皮细胞内的含量。由图9可知,血管内皮细胞可以原型形式摄取牡荆苷,且随着牡荆苷的浓度增加,血管内皮细胞对牡荆苷的摄取程度加大,在细胞内的牡荆苷含量增多。特别是以60 μmol/L牡荆苷刺激细胞之后,牡荆苷在细胞内的含量达到了(3.03±0.79) pmol/mg·蛋白。说明吸收的牡荆苷含量增多,所以逐渐下调了各类炎症相关因子的表达,增加了抗炎效果。

图8 牡荆苷在细胞培养基及缓冲盐溶液中的稳定性
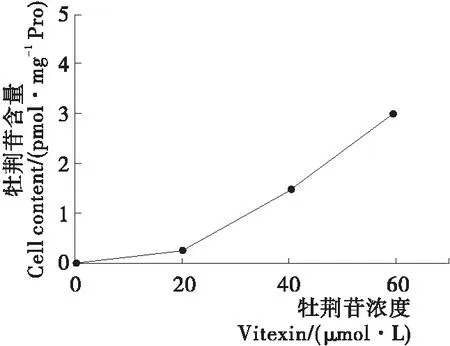
图9 牡荆苷在HUVEC细胞中的含量
3 结论
三叶青中山柰酚-3-O-芸香糖苷等6种候选成分均具有抗炎活性,其中活性最强的是牡荆苷。牡荆苷主要富含于山楂、牡荆草等植物中,且在三叶青中含量也达到了(8.28±2.03) mg/g干物质[17]。目前牡荆苷主要用于治疗心血管疾病,并且还能发挥明显的防癌抗肿瘤作用[29]。研究通过血管内皮细胞试验证实了牡荆苷的抗炎效果,这也许解释了其为何能降低心血管疾病风险。
Nrf2是在抗炎反应中发现的新机制,其活化机理主要包括两个方面:① 亲电子化合物以共价键的方式与Keap1蛋白的半胱氨酸残基结合,使Keap1蛋白发生构象改变,结构变得松散,促进Nrf2从Nrf2-Keap1复合物上解离[22]。Mills等[20]报道衣康酸通过烷化Keap1蛋白上的半胱氨酸残基使得Nrf2解离活化。② 小分子化合物以非共价键的方式与Keap1蛋白结合,通过占据Nrf2与Keap1蛋白结合的活性空腔使Nrf2解离活化[22]。研究筛选出的牡荆苷等小分子植物化学物正是结合在Keap1蛋白的活性空腔中,促使Nrf2活化。
牡荆苷能够激活转录因子Nrf2,抑制血管内皮细胞低水平炎症,有望成为防治慢性炎症乃至慢性疾病的新契机。试验还有待进一步完善与探索。
