生物胺降解菌株的筛选与鉴定
2020-07-03妥彦峰
杜 雪 妥彦峰
(大连工业大学食品学院,辽宁 大连 116034)
生物胺是由相应的氨基酸经脱羧作用产生,是维持正常生理功能的必需物质,但摄入过量会导致头晕、呕吐、高血压等不良症状,危害身体健康[1]。发酵豆制品、鱼类制品、乳制品中均有生物胺存在[2]。目前,常用的控制生物胺的手段主要是通过控制产品生产温度、pH值、盐浓度[3],或者使用辐照[4]等方法。但此方法会在一定程度上影响产品品质,利用生物胺脱羧酶活性较低或者具有生物胺氧化酶活性的菌株作用发酵剂发酵食品,可以控制发酵食品中的生物胺含量[5-6]。邓红梅等[7]从发酵香肠中分离得到了具有生物胺减少能力的模仿葡萄球菌,该菌可降低MRS培养液中色胺、苯乙胺、腐胺、尸胺、组胺及酪胺含量。吴燕燕等[8]从咸鱼中分离获得了能够降解腐胺、尸胺、组胺、酪胺的鼠李糖乳杆菌、植物乳杆菌和戊糖片球菌。
试验拟以实验室保藏的疑似乳酸菌株为试验菌株,筛选出能降低培养液中色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺含量的菌株,并测定该菌株的生长曲线、耐盐性以及不同pH值下的生长能力,旨在为控制发酵食品中生物胺含量提供备选菌株。
1 材料与方法
1.1 试验菌株
疑似乳酸菌菌株:分别从东北传统大酱、新疆发酵酸奶以及婴儿粪便中分离得到,共121株,大连工业大学大连市益生菌功能特性研究重点实验室。
1.2 主要试剂
20%氨水:分析纯,天津大茂化学试剂厂;
无水碳酸钠:分析纯,天津市瑞金特化学品有限公司;
色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺:色谱纯,源叶生物试剂有限公司;
丹磺酰氯、乙腈:色谱纯,美国Sigma-Aldrich公司;
MRS培养基:北京陆桥技术股份有限公司;
正己烷:分析纯,生工生物工程(上海)股份有限公司;
三氯乙酸:分析纯,阿拉丁生物试剂有限公司。
1.3 主要仪器与设备
pH计:S210-K型,瑞士METTLER TOLEDO公司;
冷冻离心机:FS-1C-50型,德国HERMLE Labortechnik GmbH公司;
恒温振荡器:DKZ型,上海一恒科技有限公司;
数控超声清洗仪:KQ5200DE型,昆山市超声仪器有限公司;
微生物培养箱:DNP-9082型,上海精密实验设备有限公司;
液相色谱仪:S6000型,广东华普科技股份有限公司;
酶标仪:Multiskan FC型,美国Thermo公司;
全自动生长曲线分析仪:Bioscreen C型,上海谓载商贸发展有限公司。
1.4 试验方法
1.4.1 生物胺降解菌株的筛选 参照吴燕燕等[8]的方法并修改。将菌株活化3代,按2%接种量接种至pH 5.5,含8种生物胺的30 mL MRS培养基中,30 ℃培养48 h,以未接种的MRS培养基为对照,4 000 r/min离心10 min,测定上清液中生物胺含量,并按式(1)计算降解率。
(1)
式中:
A——生物胺降解率,%;
ω——对照组生物胺含量,mg/kg;
ω1——处理组生物胺含量,mg/kg。
1.4.2 生物胺的测定 参照文献[9-10]的方法并进行修改。
(1) 生物胺标准品的制备:准确称取色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺各10 mg,用0.1 mol/L HCl定容至100 mL,分别制备成0.5,1.0,2.0,5.0,10.0,25.0,50.0 mg/L系列浓度的生物胺标准溶液。
(2) 样品衍生化:取1.4.1中离心后的菌液750 μL于2 mL EP管中,加入150 μL饱和碳酸钠溶液和750 μL丹磺酰氯,震荡混匀,45 ℃水浴30 min,加入150 μL氨水,混匀,再加入200 μL乙腈,混匀,离心,过0.22 μm滤膜,待测。
(3) 高效液相色谱(HPLC)分析:HPLC洗脱梯度如表1 所示。流动相A为水,流动相B为乙腈;色谱柱为华普C18柱(250 mm×4.6 mm×5.0 μm);流速1.0 mL/min;柱温40 ℃;进样体积20 μL;紫外检测波长235 nm。
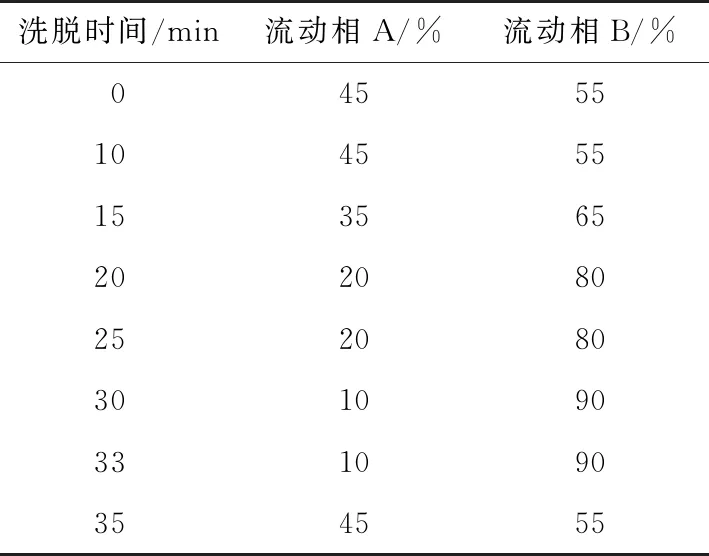
表1 HPLC洗脱梯度
1.4.3 生物胺降解菌株鉴定 根据细菌16S rDNA序列的V3-V4区设计引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)。通过PCR扩增进行16S rDNA序列分析(上海美吉生物医药科技有限公司)。
1.4.4 生物胺降解菌株生长曲线 将菌株HM22、HM24、YF10042接种至MRS培养基中,全自动生长曲线分析仪培养温度37 ℃,每隔2 h测定菌株培养液在600 nm处吸光度值,绘制生长曲线[11]。
1.4.5 生物胺降解菌株的耐盐性能 参照徐鑫等[12]的方法并修改,MRS培养液中NaCl浓度分别为0%,2%,4%,6%,8%,10%,121 ℃灭菌20 min。将筛选出的3株菌株接种至含不同NaCl浓度的无菌MRS液体培养基中,37 ℃培养24 h,测定菌液在600 nm处吸光度值。以乳酸菌接入不含NaCl的MRS培养液为对照组;未接种乳酸菌的对应盐浓度的MRS培养液为空白组。按式(2)计算抑制率。
(2)
式中:
ω——抑制率,%;
A0——空白组OD600nm值;
A1——对照组OD600nm值;
A2——处理组OD600nm值。
1.4.6 pH值对生物胺降解菌株生长能力的影响 将3株菌株分别接种至pH值为3.5,4.5,5.5,6.5,7.5,8.5,9.5的MRS液体培养基中,37 ℃培养24 h,测定OD600 nm,以不接种任何乳酸菌的各种pH的培养液为空白,以OD600 nm值评价其耐酸能力[13-14]。
1.4.7 统计分析 所有指标均重复测定3次,采用SPSS 23.0软件进行数据统计分析,比较各数据间的显著差异性(P<0.05)。
2 结果与讨论
2.1 生物胺标准图谱及标准曲线
由图1可知,8种生物胺在35 min内能很好地分离,并依此确定了各生物胺标准品的保留时间,说明此方法具有良好的分离检测生物胺的效果。
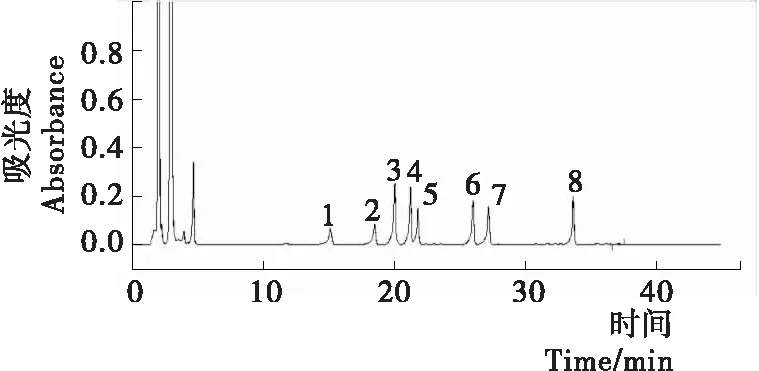
1. 色胺 2. 苯乙胺 3. 腐胺 4. 尸胺 5. 组胺 6. 酪胺 7. 精胺 8. 亚精胺
图1 生物胺混合标品HPLC色谱图
Figure 1 HPLC chromatogram of biogenic amine mixed standard
由表2可知,8种生物胺的峰面积与其浓度呈良好的线性关系,相关系数均>0.998 0,说明采用HPLC法对于定量测定样品中生物胺具有良好的可靠性[15]。
2.2 生物胺降解菌株的筛选
由图2可知,菌株HM24和4-6对精胺的降解率达50%以上;菌株YF10042和HM24对亚精胺的降解能力>30%;菌株YF10042、HM24及HM22对色胺的降解能力>20%;菌株HM24对组胺的降解能力为(22.54±2.64)%,显著高于其他菌株;菌株YF10042、HM24及HM22对苯乙胺的降解能力均>20%,其中菌株HM24对苯乙胺的降解能力达(35.75±2.71)%;菌株YF10042、HM24及HM22对8种生物胺均有降解作用,且对色胺、苯乙胺、腐胺、尸胺和组胺的降解率显著高于其他菌株,同时对酪胺、精胺和亚精胺的降解率也较高,均高于邓红梅等[6]的研究结果,故选取菌株YF10042、HM24和HM22进行后续试验。

表2 8种生物胺回归方程及相关系数
2.3 生物胺降解菌株的鉴定
将筛选出的菌株HM22、HM24和YF10042在MRS固体培养基上培养48 h,其菌落形态和经革兰氏染色的菌体特征[16]如表3所示。

表3 菌落形态与菌体形态
将筛选得到的菌株按《乳酸菌分离鉴定及其试验方法》的方法进行生理生化鉴定,将试验结果与《常见细菌系统鉴定手册》进行对比[17](表4),初步判断菌株HM22为发酵乳杆菌(Lactobacillusfermentum),菌株HM24为植物乳杆菌(Lactobacillusplantarum),菌株YF10042为粪肠球菌(Enterococcusfaecalis)。
由表5、图3可知,菌株HM22与发酵乳杆菌(Lactobacillusfermentum)的同源性为99%,将其命名为发酵乳杆菌HM22;菌株HM24与植物乳杆菌(Lactobacillusplantarum)的同源性为100%,将其命名成植物乳杆菌HM24;菌株YF10042与粪肠球菌(Enterococcusfaecalis)的同源性为100%,将其命名为粪肠球菌YF10042。
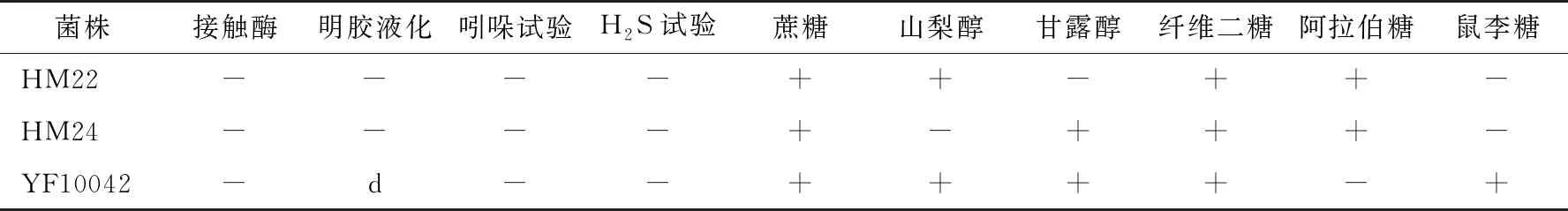
表4 生理生化试验结果†
† “+”为阳性;“-”为阴性;“d”为迟缓反应。

字母不同表示差异显著(P<0.05)
2.4 生物胺降解菌株的生长曲线
由图4可知,菌体在4 h时生长迅速,OD值显著上升,为对数生长期;10 h后生长缓慢,进入稳定生长期。
2.5 生物胺降解菌株的耐盐性能
由图5可知,当盐浓度为2%~4%时,菌株YF10042的生长能力无显著差异;当盐浓度为6%时,菌株YF10042的生长受到了一定的抑制;当盐浓度为10%时,菌株YF10042的抑制率为68.30%。随着盐浓度的增加,菌株HM22的耐受能力显著下降,当盐浓度为10%时仍有一定的耐受性;菌株HM24的抑制率逐渐增大,当盐浓度为6%时其生长受到了抑制,当盐浓度为10%时仍有一定的耐受能力。表明菌株对NaCl有一定的耐受能力,有利于菌株在高盐发酵食品中生长繁殖,为控制高盐发酵食品中生物胺含量奠定了基础[18]。

表5 生物胺降解菌株的16S rDNA序列分析结果

图3 菌株的系统发育树

图4 生物胺降解菌株的生长曲线

字母不同表示差异显著(P<0.05)
2.6 pH值对生物胺降解菌株生长能力的影响
由图6可知,菌株HM22的最佳生长pH为4.5~6.5,菌株HM24的最佳生长pH为5.5,菌株YF10042的最佳生长pH为4.5;当pH为3.5时,3株菌株仍具有很好的生长能力,菌株HM24的生长能力弱于HM24和YF10042。当pH为9.5时,菌株HM24的生长能力强于其他两株菌株,3株菌株仍能良好生长。因此,生物胺降解菌株在低pH或高pH的发酵环境中均能发挥降胺作用[19-21]。

字母不同表示差异显著(P<0.05)
3 结论
从实验室保存的不同来源的疑似乳酸菌中筛选出具有降解生物胺作用的菌株,经16S rDNA序列分析,分别鉴定为发酵乳杆菌(Lactobacillusfermentum)、植物乳杆菌(Lactobacillusplantarum)、粪肠球菌(Enterococcusfaecalis);3株菌株对色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺均有不同程度的降解能力,其中植物乳杆菌HM24的降解能力最优,对色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺的降解率分别为(25.90±2.30)%,(35.75±2.71)%,(27.61±3.94)%,(25.91±3.76)%,(22.54±2.64)%,(34.55±1.90)%,39.25±1.86)%,(55.66±7.08)%;3株菌株在10%的高盐浓度、pH 3.5的酸性环境到pH 9.5的碱性环境条件下仍有存活和生长能力。后续将对其实际应用进行研究[22-24]。
