不同盐分条件下硅对两个高羊茅品种生物量分配和营养元素氮、磷、钾吸收利用的影响
2022-07-08陈文瑞蒋朝周齐新王云琴李春鸣郭鹏辉刘慧霞
陈文瑞,蒋朝,周齐新,王云琴,李春鸣,郭鹏辉,刘慧霞
(西北民族大学生命科学与工程学院,甘肃 兰州 730030)
高羊茅(Festuca arundinacea)是多年生禾本科饲草,通常用于干旱和半干旱地区人工草地种植[1]。长期多频次的灌溉和蒸散作用,使高羊茅经常生长在盐渍化的土壤中[2-3],植株内Na+含量升高,渗透压降低,影响了N、P、K+营养元素的吸收和利用。
硅(silicon,Si)是一种环境友好型元素。大量研究表明,环境友好型元素硅能改善植物的膜功能和H+-ATP酶活性,促进植物对土壤中磷元素的吸收,进而减少植物对Na+的吸收[4-5]或增加生境下N、P 和K+的吸收来减轻对植物的有害影响[6-7],但硅减轻盐生境对植物不利影响的效果因植物的种和品种抗盐性的强弱有关。已有研究表明,硅对耐盐型小麦(Triticum aestivum)品种Izmir-85 和盐敏感型小麦品种Gediz-75[8-9]、耐盐性弱的美洲狼尾草(Pennisetum americanum)和耐盐性强的杂交狼尾草(P. americanum×Pennisetum purpureum)[10]以及黄瓜(Cucumis sativus)[11],甜瓜(Cucumis melo)[12]等物种的耐盐性影响程度不同,这说明硅调解植物耐盐性时,具有品种和抗性依赖性。不同品种高羊茅的耐盐性也不同,那么,硅对不同耐盐性高羊茅品种在盐生境下耐盐性的影响如何呢?本研究拟通过盆栽试验研究不同盐浓度条件下施硅对两个不同耐盐性的高羊茅品种生物量、Na+、N、P、K+含量的影响,揭示不同耐盐性的高羊茅品种在不同盐浓度生境下对施硅的响应规律,为高羊茅人工草地的管理提供科学依据。
1 材料与方法
1.1 试验设计
试验采用高羊茅品种,硅处理,盐浓度三因素设计,试验共24个处理,每个处理重复6 次。高羊茅品种为来自北京百绿集团抗性较弱的“K31”和抗性较强的“XD”;硅处理包括不添加(-Si)和添加(+Si);试验用盐为氯化钠(NaCl),分别添加于不加硅(-Si)或加硅(+Si)的 Hoagland 营养液,配置成 0、50、100、150、200 和 250 mmol·L-1的培养液,用 0.2 mmol·L-1的H2SO4或 1 mmol·L-1的 KOH 将培养液 pH 值调至 6.0,用于培养高羊茅种子发芽和幼苗生长。本研究中的硅浓度设计为 2 mmol·L-1的硅酸钠(Na2SiO·39H2O)[13],Na+浓度来自氯化钠和硅酸钠。
采用盆栽控制试验,于2016年5月20 日至7月20 日在兰州大学草地农业科技学院智能温室进行[温度:(23±2)℃,湿度:(46±2)%]。体积比为1∶1 的珍珠岩和蛭石培养植料在120 ℃的烘箱中灭菌 5 h 后,装入直径14 cm、高15 cm,底部有孔且带有托盘的塑料盆。每盆播种300 粒种子,培养期间用相应盐浓度的培养液每2 d 浇灌一次至盆底托盘有液体析出,塑料盆任意摆放并每周随机调换位置。播后21 d 间苗至50 株·盆-(1高羊茅的种子发芽标准时间为 21 d)[11]。
1.2 样品收集和元素含量测定
间苗后40 d 时取样,将每个盆中的高羊茅植株完整移出,用剪刀将茎叶和根系分开,蒸馏水冲洗根系,用镊子除去附着在根上的蛭石和珍珠岩。每盆茎叶和根系样品分别置于115 ℃烘箱中杀青15 min 使酶失活,然后75 ℃烘干至恒重。每处理的3个重复用于测量茎叶和根系的生物量,其他3个用于测量高羊茅体内Na+、N、P 和K+的含量。
采用凯氏定氮法(Foss Kjeltec 8400,丹麦)测定总氮(N)含量,Mo-Sb 比色法(UV-2102C,上海)测定总磷(P)含量,火焰光度法(Jenway,PFP-7)测定K+和Na+含量[7]。根冠比用每盆根系生物量除以地上生物量来计算,而K+/Na+通过K+含量除以Na+含量来计算。
1.3 数据统计与分析
采用SPSS 11.7 三因素方差分析法分析品种、盐浓度、硅交互作用对各指标的影响;采用Duncan 法进行多重比较;采用Excel 2016 作图。
2 结果与分析
三因素ANOVA 分析结果表明,品种对地上生物量、地下生物量、根冠比、地上部(K+、N、Na+、K+/Na+)含量、地下部(P、K+、N、Na+、K+/Na+)含量均具有显著影响(P<0.05),而对地上部P 含量影响不显著(表1);盐浓度和添加硅对所有的生物量和元素含量均具有显著影响(P<0.05);品种与盐浓度的互作对地上生物量、地下生物量、根冠比、地上部(P、K+、Na+、K+/Na+)含量、地下部(K+、N、Na+、K+/Na+)含量影响显著(P<0.05);品种与硅互作对地上部K+/Na+含量、地下部(K+、Na+)含量影响显著(P<0.05);盐浓度与硅的互作对地上生物量、地下生物量、地上部(P、N、Na+、K+/Na+)含量、地下部(P、K+、N、Na+、K+/Na+)含量影响显著(P<0.05);品种、盐浓度、硅处理三者的交互作用对地上生物量、地下生物量、地上部P 含量、地下部K+含量影响显著(P<0.05)。
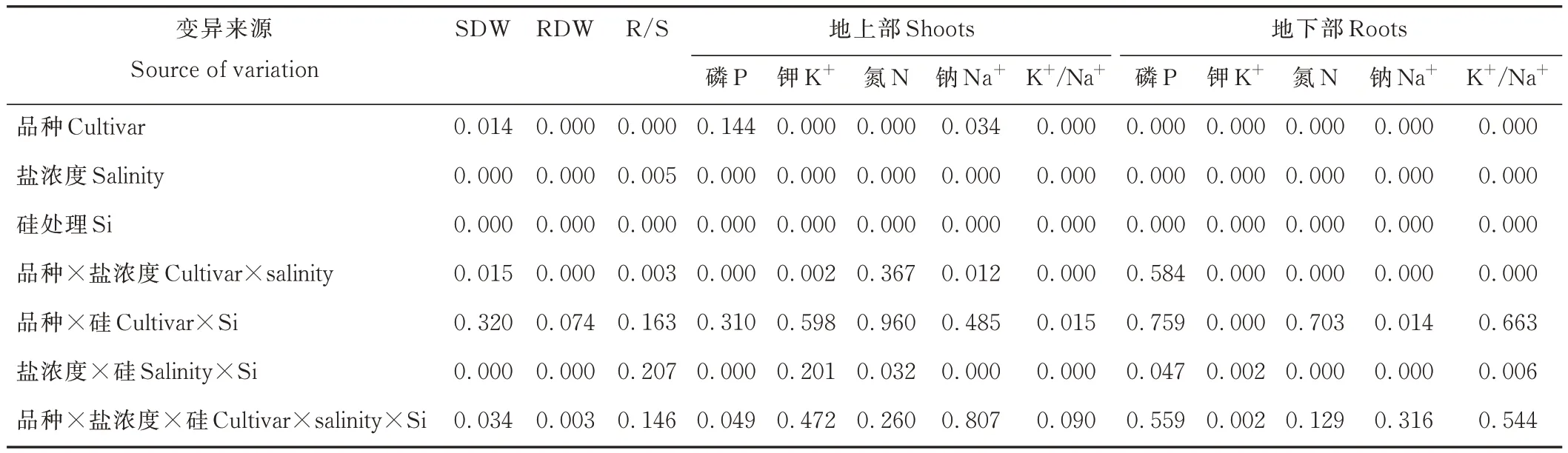
表1 品种、盐浓度和硅对高羊茅生物量和元素含量影响的三因素方差分析Table 1 Three-way ANOVA of effect of cultivar,salinity and Si on biomass and element content of tall fescues(P-value)
2.1 不同盐浓度下硅对两个高羊茅品种生物量的影响
两个高羊茅品种的地上、地下生物量无论在加硅还是不加硅条件下随盐浓度的增加均呈下降趋势(表2),但下降幅度因高羊茅的品种和硅元素添加与否而不同。无硅(-Si)条件下,XD 和K31 的地上生物量在相邻盐浓度间显著变化的盐浓度范围分别为0~100 mmol·L-1和0~150 mmol·L-1,两个品种的地下生物量在相邻盐浓度间变化均不显著。硅的添加(+Si)使XD 和K31 两个品种地上和地下生物量在相邻盐浓度间同时发生显著变化,其显著变化的盐分阈值分别为0~100 mmol·L-1和0~200 mmol·L-1。同一盐浓度下加硅对XD 和K31 的两个高羊茅品种的地上生物量无显著影响,但显著提高了XD 和 K31 在低盐浓度下(0~100 mmol·L-1)的地下生物量。因此,硅对两个高羊茅品种地上和地下生物量的有益影响与盐浓度有关。

表2 不同盐浓度下硅对两个高羊茅品种生物量的影响Table 2 Effect of Si on biomass of two tall fescue cultivars under different salinities
2.2 不同盐浓度下硅对两个高羊茅品种根冠比的影响
随着盐浓度的增加,两个高羊茅品种的根冠比变化趋势相似,均呈先降低后增加的趋势(图1)。不加硅(-Si)条件下,XD 和 K31 分别在 100 和 50 mmol·L-1盐浓度下根冠比降至最低。加硅(+Si)条件下,XD 的根冠比在各盐浓度之间相对稳定,盐浓度为50 mmol·L-1时K31 根冠比最小。除个别盐浓度外,施加硅均增加了相同盐浓度下 XD 和 K31 的根冠比。

图1 不同盐浓度下硅对两个高羊茅品种根冠比的影响Fig.1 Effect of Si on roots/shoots of two tall fescues cultivars under different salinities
2.3 不同盐浓度下硅对两个高羊茅品种地上部N、P、K+、Na+含量的影响
无论加硅与不加硅,随着盐浓度的增加,两个高羊茅品种地上部N、P、K+含量逐渐降低,Na+含量逐渐增加,其变化幅度因盐浓度和高羊茅品种的不同而不同(表3)。不加硅(-Si)条件下,XD 地上部的N 和P 含量在相邻盐浓度间变化显著的盐分阈值为盐浓度100~150 mmol·L-1,K+含量在相邻盐浓度间变化显著的盐分阈值为盐浓度 0~50 mmol·L-1和>150 mmol·L-1;K31 的地上部 N 含量仅在盐浓度为 200~250 mmol·L-1间变化显著,P含量在相邻盐浓度间变化显著的盐分阈值为盐浓度0~50 mmol·L-1和100~150 mmol·L-1,K+含量在相邻盐浓度间变化显著的盐分阈值为盐浓度≤200 mmol·L-1。XD 和K31 的地上部Na+含量在相邻盐浓度间显著变化的盐分阈值分别为盐浓度≤150 mmol·L-1和≤250 mmol·L-1。

表3 不同盐浓度下硅对两个高羊茅品种地上部N、P、K+、Na+含量的影响Table 3 Effect of Si on P,K+,Na+,N content in shoots of two tall fescue cultivars under different salinities(%)
加硅(+Si)条件下,XD 地上部的P 含量在相邻盐浓度间变化显著的盐分阈值为盐浓度>50 mmol·L-1,其N和K+含量在相邻盐浓度变化显著的盐分阈值为盐浓度>150 mmol·L-1;K31 的N 含量在盐浓度200~250 mmol·L-1间变化显著,P 和K+含量在所有相邻盐浓度0~200 mmol·L-1间变化均显著。XD 地上部Na+含量在盐浓度100~250 mmol·L-1间变化显著,K31 的Na+含量在所有盐浓度间变化均显著。相同盐浓度下,加硅显著降低了盐浓度≥150 mmol·L-1时 XD 的 P、N 含量以及盐浓度为 0~200 mmol·L-1时 K31 的 P、K+含量,显著提高了盐浓度≥50 mmol·L-1条件下 XD 和 K31 的 Na+含量。
2.4 不同盐浓度下硅对两个高羊茅品种地下部N、P、K+、Na+含量的影响
无论加硅与不加硅,随着盐浓度的增加,两个高羊茅品种地下部N、P、K+含量逐渐降低,Na+含量逐渐增加,其变化幅度因盐浓度和高羊茅品种的不同而不同(表4)。不加硅(-Si)条件下,XD 和K31 地下部的N、P 含量在相邻盐浓度间显著变化的盐分阈值分别为盐浓度≤250 mmol·L-1和≤200 mmol·L-1。XD 的K+含量在相邻盐浓度间变化均不显著,K31 的K+含量在相邻盐浓度间变化显著的盐分阈值为盐浓度≤200 mmol·L-1。
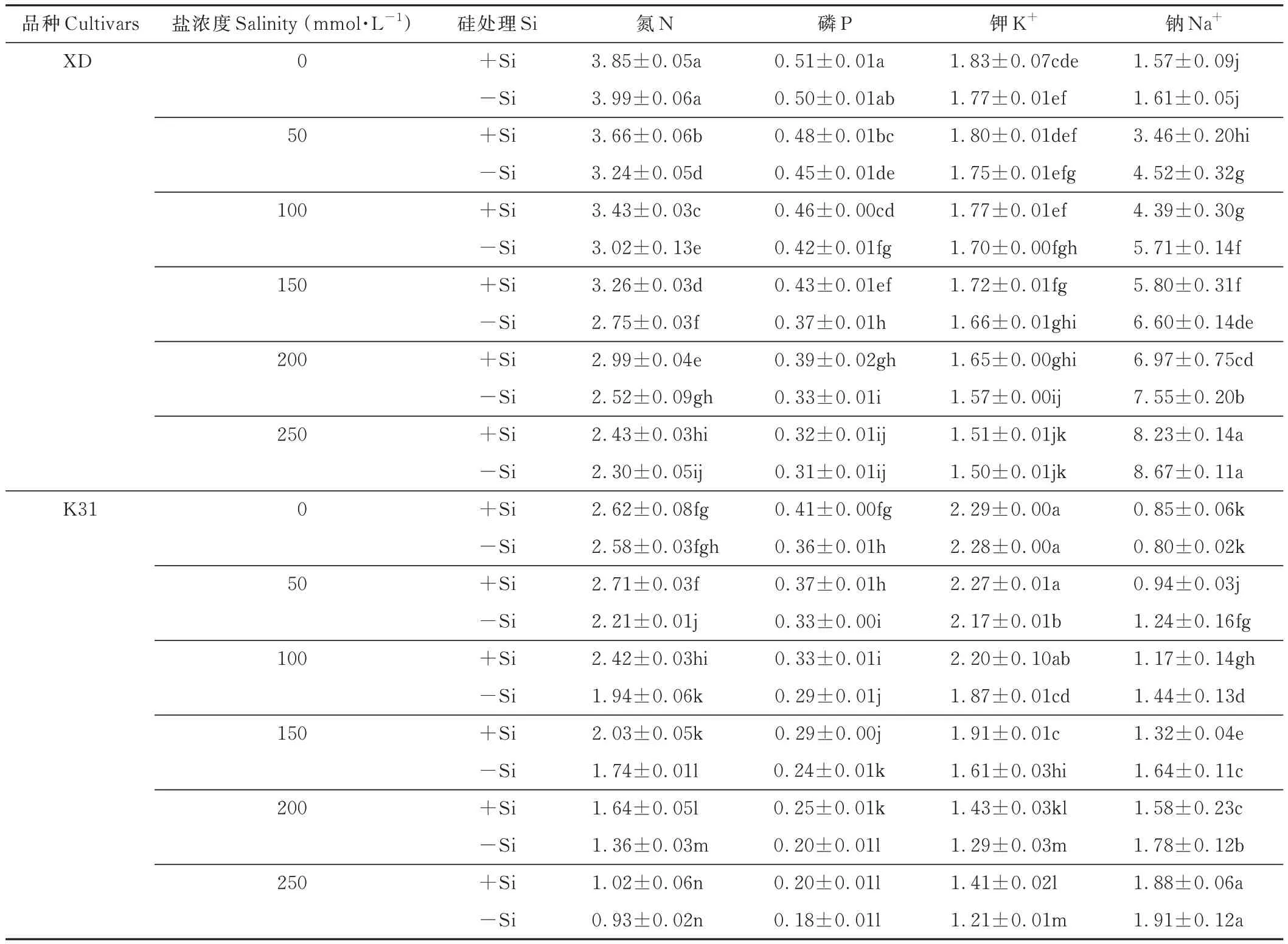
表4 不同盐浓度下硅对两个高羊茅品种地下部N、P、K+、Na+含量的影响Table 4 Effect of Si on P,K+,Na+,N content in roots of two tall fescue cultivars under different salinities(%)
加硅(+Si)条件下,XD 地下部N 含量和K31 地下部P 含量在所有盐浓度间变化均显著,XD 地下部P 含量在相邻盐浓度间显著变化的盐分阈值为盐浓度100~250 mmol·L-1,K31 地下部N 含量在相邻盐浓度间显著变化的盐分阈值分别为盐浓度50~250 mmol·L-1。XD 和K31 地下部K+含量在相邻盐浓度间显著变化的盐分阈值分别为盐浓度>200 mmol·L-1和100~200 mmol·L-1,Na+含量在各盐浓度间变化均显著。相同盐浓度下,施硅显著提高了 XD 在盐浓度≤200 mmol·L-1时 N、P 含量和盐浓度为 100~200 mmol·L-1时 K31 的 K+含量,显著降低了盐浓度≤250 mmol·L-1条件下 XD 和 K31 的 Na+含量。
2.5 不同盐浓度下硅对两个高羊茅品种地上和地下部K+/Na+的影响
随着盐浓度的增加,两个高羊茅品种地上部K+/Na+呈下降趋势(图2)。不加硅(-Si)条件下,XD 地上部K+/Na+在盐浓度为 0~150 mmol·L-1范围内变化显著,K31 地上部 K+/Na+在盐浓度为 0~200 mmol·L-1范围内变化显著;加硅(+Si)条件下,地上部K+/Na+在相邻盐浓度间变化均显著。加硅显著增加了高羊茅地上K+/Na+值。

图2 不同盐浓度下硅对两个高羊茅品种地上部K+/Na+的影响Fig.2 Effect of Si on K+/Na+ of shoots of two tall fescues cultivars under different salinities
随着盐浓度的增加,两个高羊茅品种地下部K+/Na+呈下降趋势(图3),不加硅(-Si)条件下,XD 和K31 的地下部 K+/Na+在盐浓度为 0~100 mmol·L-1范围内变化显著。加硅(+Si)条件下,盐浓度<150 mmol·L-1和<200 mmol·L-1时,XD 和 K31 地下部 K+/Na+在各盐浓度间变化显著。低盐浓度下(≤100 mmol·L-1)加硅显著提高了两个高羊茅品种地下部K+/Na+值。
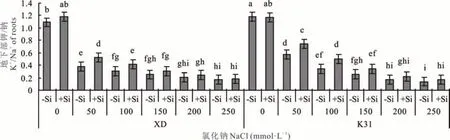
图3 不同盐浓度下硅对两个高羊茅品种地下部K+/Na+的影响Fig.3 Effect of Si on K+/Na+ of roots of two tall fescue cultivars under different salinities
3 讨论
硅能改善土壤盐渍化[14]促进植物生长发育[15],植物生物量是植物适应盐渍化环境的综合反映[16]。本研究表明,硅的施用对两个高羊茅品种地上、地下部生物量的影响趋势相似,硅不会随着盐浓度的增加而改变地上和地下部生物量的变化趋势,但是显著影响了地上和地下部的生物量。当盐浓度<100 mmol·L-1时,施硅显著增加了地下部生物量,对地上部生物量没有显著影响,当盐浓度>150 mmol·L-1时,施硅对地上和地下部生物量均无影响,这是因为低盐浓度下,硅在根组织中的沉积,缓解了因Na+和Cl-的过量积累而引起根组织的渗透压的增大[17]和细胞膜氧化损伤程度,减轻了盐对根系的毒害作用[18],促进根系生长。但基质中硅元素更有利于植物根系对营养的吸收和利用,这一结果与对豆梨(Pyrus calleryana)[19]和枳壳(Citrus aurantium)[20]的研究一致;而对较高盐浓度下高羊茅地上、地下部生物量没有影响的原因是大量积累的Na+和Cl-对高羊茅的损伤超过了硅所能调控的盐分域值范围[21]。本研究发现,施硅使高羊茅的根冠比的单峰变化趋势随着盐浓度的增加而相对平缓,表明中等盐浓度条件下施硅能促进植物生物量在根系中的分配。虽然XD 和K31 的根冠比达到最小值时的盐浓度不同,但施硅弥补了品种间对盐浓度敏感的差异。由此可以推断,低盐浓度引起的高羊茅地下部生物量的减少可以通过施硅得到改善,而高羊茅遭受高盐浓度胁迫时,施硅不能恢复盐胁迫对高羊茅的损伤,随着盐胁迫程度的增加,不同耐盐品种的高羊茅生物量对施硅的变化趋势相似,但硅对盐胁迫下不同抗性品种生物量显著提高的盐分阈值不同,对抗盐性弱的K31 生物量提高的盐分阈值大于抗盐性强的XD。
植物组织中过量Na+的积累会影响一些必需元素的吸收和转运[14],最终导致营养失衡[22]。虽然随着盐浓度的增加,两个品种地上部和地下部N、P、K+、Na+含量有相似的变化趋势,但K31 积累高浓度Na+的盐浓度范围大于XD,这说明XD 比K31 有更强的耐盐性。施硅对两个高羊茅品种Na+含量的影响相似。当盐浓度<200 mmol·L-1时,施硅显著降低了两个高羊茅品种的地上部和地下部 Na+含量,在小麦[9],水稻(Oryza sativa)[23]和高粱(Sorghum bicolor)[16]中也发现了类似的结果。然而,在250 mmol·L-1的盐浓度下,施硅对两个高羊茅品种的地上部Na+含量没有显著影响,因为高盐浓度通常会导致Na+到达细胞质,尤其是在叶肉细胞中达到毒性浓度[24]。因此,在较高盐浓度条件下施硅不能降低Na+含量,这表明硅对降低高羊茅Na+积累的有益作用受盐浓度范围的限制。无论加硅(+Si)还是不加硅(-Si)条件下,相同盐浓度下高羊茅地上部Na+含量均低于地下部,可能是因为硅通过部分抑制蒸腾速率而被动地影响植物吸收Na+的过程[25]。在本研究中,施硅对两个高羊茅品种K+含量的影响不同,施硅除了对XD 地下部分K+含量没有显著影响外,显著增加了K31 地上、地下部以及XD 地上部K+含量,这有助于高羊茅在盐渍化条件下保持细胞膜的完整性[26]而增强其耐盐性,同时也说明硅对盐渍化条件下高羊茅体内K+含量的影响因品种而不同,这可能是因为硅提高了盐渍化条件下XD 的K+向地上部运输的能力,但没有改变其地下部对K+的吸收。硅能增加细胞膜K+通道和载体的活性,增加K+的跨细胞膜吸收[27]或通过减少Na+的吸收而增加K+的反吸收[25,28]。K+/Na+反映了植物在盐胁迫下对K+吸收和转运的选择性。施硅显著提高了两个品种的K+/Na+,表明施硅提高了高羊茅对K+的选择性吸收。硅影响地下部K+/Na+的盐浓度范围小于地上部,表明硅对地上部Na+和K+选择性吸收的影响大于地下部。
研究结果表明,随着盐浓度的增加,两个品种的高羊茅体内P 含量呈逐渐降低趋势,地下部P 含量显著降低的盐浓度范围均大于地上部,这表明高羊茅地下部P 含量的变化比地上部更为敏感。施硅对两个品种地上部和地下部P 含量影响趋势相同,而同一盐浓度条件下,施硅显著增加了高羊茅地下部P 含量。施硅引起的P 含量增加可能有助于膜功能的改善和H+-ATP 酶活性的增加[27-28],进而促进植物对土壤P 的吸收和利用[29]。本研究中,盐浓度显著降低了XD 和K31 地下部N 含量,这可能与Cl-和NO3-之间的相互拮抗有关[17],或者是盐浓度通过减少对NO3-的吸收和影响蛋白质合成来干扰N 的获取和利用[30]。施硅显著提高了XD 和K31 的地上部N 含量,且XD 地上部的N 含量显著增加的盐浓度阈值大于K31,地下部的N 含量高于地上部,说明施硅有助于高羊茅更好地吸收N,且施硅对高耐盐性XD 的地上部N 含量的增加比低耐盐性K31 的地上部N 含量的增加更为有利。
盐浓度对植物生长的抑制可能归因于植物组织中过量Na+的积累[15]。结果表明,施硅通过减少Na+的积累,增加N、P、K+的吸收,减轻了高羊茅的盐害,促进了两个高羊茅品种的生长。而硅对高羊茅生长的有利作用受盐浓度的调控,高盐浓度会抵消硅的有利作用,在相对低盐浓度下,硅有利于高羊茅的健康生长。本研究发现硅对高羊茅的影响与品种有关,说明施硅对两个高羊茅品种地上和地下生物量、Na+、P 含量的影响相似,但其对地上部K+和N 含量的影响在品种间表现不同,对耐盐性强的XD 的有益作用优于耐性弱的K31。因此,硅对植物耐盐性具有有利影响,而品种的抗性更为重要。这一结果在高羊茅草地管理中具有广泛的应用前景。
