口腔疣状癌中PTEN的表达及其抑癌作用的初步研究
2020-07-01付镇地邓雪花顾立群唐瞻贵
付镇地 邓雪花 顾立群 唐瞻贵
口腔疣状癌(oral verrucous carcinoma,OVC)是一种好发于中老年人、具有典型推进缘结构、有局部侵袭性、分化程度高的恶性肿瘤[1]。OVC作为口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)的一种独特变种,有时很难将其与OSCC区分开来。1948 年,Ackerman[2]首次将口腔疣状癌作为独立的实体瘤从口腔鳞癌中划分出来。目前,口腔疣状癌的治疗手段以手术切除为主,虽然大部分预后良好,但易复发;少数预后较差,易发生转移[3]。造成这一独特生物学行为的机制,目前尚不清楚。口腔疣状癌的致病因素主要与咀嚼烟草、槟榔和感染人乳头状病毒(human papilloma virus,HPV)有关,本课题组及国内外学者对口腔疣状癌的发病机制做了大量工作,但其具体机制目前尚未完全清楚[3-9]。
磷酸酶及张力蛋白同系物(phosphate and tensin homolog,PTEN)是一种常见的抑癌基因,在多种肿瘤中突变或缺失[10]。PTEN通过调控多条信号转导通路,包括PI3K/AKT通路、FAK/p130cas通路、Shc/MAPK通路以及参与调控胰岛素信号等,可诱导细胞凋亡、抑制细胞周期、抑制肿瘤细胞侵袭和转移、抑制肿瘤血管形成、维持免疫系统稳定性等发挥其抑癌作用[10-11]。本研究运用免疫组化法检测PTEN在OVC中的表达,并对其抑癌作用进行初步研究。
1 资料与方法
1.1 病例资料
收集2000~2016 年中南大学湘雅医院病理科确诊并保存完好的OVC、OSCC石蜡标本各20 例。OVC组男性13 例,女性7 例,平均年龄(52±14.2) 岁,原发于口腔且不伴发其他口腔肿瘤。OSCC组均为高分化鳞癌,其中男性16 例,女性4 例,平均年龄(55±8.2) 岁,也原发于口腔且不伴发其他口腔肿瘤。另经患者及家属同意取10 例外伤患者正常口腔黏膜(NM)标本,固定、包埋,作为对照。其中男性6 例,女性4 例,平均年龄(32±12.3) 岁。
1.2 试剂耗材
Non-phospho PTEN(批号7960,兔,CST公司,美国);AKT1(phospho S473)(EP2109Y兔,abcam公司,英国);通用性免疫组化试剂盒(SP-9000,中杉金桥);3%过氧化氢、PBS缓冲液、DAB显色剂、苏木紫、二甲苯等其他未列试剂(武汉博士德公司)。
1.3 免疫组化染色
切片厚度4 μm,40 ℃烘烤过夜;60 ℃烤片40 min置于梯度酒精:无水乙醇Ⅰ-无水乙醇Ⅱ-95%酒精Ⅰ-95%酒精Ⅱ-70%酒精各10 min,PBS浸泡10 min;加入0.01 mmol/L柠檬酸盐缓冲液,水浴30 min;150~200 μl 3% H2O2避光室37 ℃孵育10 min;山羊血清封闭37 ℃ 孵育20 min;一抗(pAKT 稀释至1∶200,PTEN 稀释至1∶200) 37 ℃温箱孵育1 h;滴加B液37 ℃恒温孵育 15 min;滴加C液37 ℃恒温孵育 15 min。DAB显色;苏木素复染;空白对照以PBS缓冲液代替一抗。
1.4 染色结果判定
用Aperion ScanScope CS扫描切片,运用配套的软件量化核、膜或总表达水平。量化上皮细胞和癌变区域。核和膜的表达分数(3+、2+、1+分别表示强、中、弱阳性染色)按公式(3+)*3+(2+)*2+(1+)*1计算。总量化的表达分数被列为总强度或总细胞数。
1.5 统计学分析
各指标在OVC组、OSCC组和正常组之间的表达差异采用单因素方差分析,多重比较采用Tukey's检验。PTEN与pAKT的相关性采用two tailed Pearson’s相关性分析,检验水准取α=0.05,P<0.05表示差异有统计学意义。所有图表均用GraphPad Prism 5.01 绘制。
2 结 果
2.1 PTEN的表达
PTEN在各组织的胞核胞浆中均有不同程度表达。通过免疫组化结果,我们发现PTEN在Nm中表达显著高于OVC和OSCC。PTEN在OVC组中的表达低于Nm组,高于OSCC组(图1)。

图1 PTEN在NM、OVC、OSCC中的表达(免疫组化,×100)Fig 1 PTEN expression in NM,OVC and OSCC tissue(IHC,×100)
2.2 pAKT的表达
pAKT主要表达在OVC组和OSCC组的胞质中,在Nm组中pAKT的表达教OSCC组和OVC组明显降低,OVC组的pAKT表达水平较OSCC低(图2)。
2.3 PTEN与pAKT相关性
在Nm、OVC、OSCC中PTEN与pAKT的表达呈显著负相关(图3)。
3 讨 论
口腔疣状癌作为口腔鳞状细胞癌的亚型,其恶性程度低于口腔鳞癌。其独有的“推进缘”结构是其有别于口腔鳞癌的病理学特征[7,12]。本研究中PTEN在口腔疣状癌及口腔鳞癌中均低表达,这与国内外文献报道PTEN作为抑癌基因在多种肿瘤细胞中低表达[13],如肝癌、胃癌、宫颈癌、乳腺癌等相一致[14-18]。PTEN在口腔疣状癌中的表达高于口腔鳞癌,说明PTEN的表达与肿瘤的恶性程度有相关性。张玉领等[17]对中国食管癌患者PTEN表达与临床病理因素相关性Meta分析发现PTEN的表达与肿瘤分化程度、浸润深度及淋巴结转移密切相关。Jolly等[19]发现在小鼠模型中BRAF基因和PTEN基因的缺失导致甲状腺乳头状癌迅速发展为甲状腺低分化癌。这些提示PTEN基因可能是一种抑癌基因并参与了肿瘤的发生发展。PTEN基因定位在人类染色体的10q23位点,PTEN基因的编码蛋白脂质磷酸酶的活性对调控细胞凋亡发挥重要作用,其可使细胞周期快速阻滞在G1期,从而促进了细胞的凋亡;PTEN可阻断AKT通路,进而诱导细胞凋亡及影响细胞周期。

图2 pAKT在NM、OVC、OSCC中的表达(免疫组化,×100)Fig 2 pAKT expression in NM,OVC and OSCC tissue(IHC,×100)
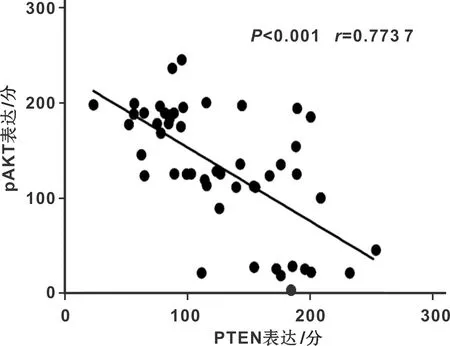
图3 在Nm、OVC、OSCC中PTEN、pAKT的相关性Fig 3 The correlation between PTEN and pAKT in Nm,OVC and OSCC
pAKT是AKT的磷酸化活化形态。AKT通路发挥功能的核心事件是AKT的磷酸化激活。AKT通路激活后可通过抑制凋亡机制、影响细胞周期及血管生成等方面影响细胞生命活动[10,20-21]。PTEN通过使AKT通路激活的关键酶去磷酸化而发挥其抑癌作用[13]。吕梦欣等[18]指出在膀胱癌中miR-130b-3p通过抑制PTEN的表达,激活AKT通路及整合素β1/FAK信号通路,诱导凋亡,抑制膀胱癌细胞的增值、迁移和侵袭能力。本研究中PTEN在OSCC组、OVC组、Nm组中的表达依次升高并伴随着pAKT表达的依次下降,PTEN与pAKT呈显著负相关。提示PTEN在OVC和OSCC中的低表达或表达缺失激活了AKT通路,从而促进了肿瘤的发生发展。Chi[22]研究发现miR194通过调控AGK激活AKT通路,抑制口腔鳞状细胞癌的癌细胞增值。Gao等[23]通过对舌癌的研究也发现PTEN可负调控AKT通路诱导舌癌细胞的凋亡。
综上所述,PTEN在口腔疣状癌中低表达,其表达程度与肿瘤恶性程度相关,但具体机制尚待进一步研究,PTEN与pAKT呈负相关,提示OVC中PTEN的低表达导致AKT通路激活,促进了肿瘤的发生发展,但其具体机制还需要进一步研究。
