不同方法提取金丝小枣多酚比较研究
2020-06-05张兆英赵峥桦陈新刘福春王继贵
张兆英,赵峥桦,陈新,刘福春,王继贵
(1.沧州师范学院生命科学学院,河北沧州061001;2.沧州市农林科学院,河北沧州061000)
枣(Ziziphus jujuba Mill.)是我国重要的特产果树,其果实具有较高的营养价值和经济价值[1]。枣果除了含有糖、蛋白质、氨基酸、膳食纤维等营养成分外,还含有大量的活性成分,如黄酮、多酚、皂苷等。具有抗氧化、降血糖血脂、抗肿瘤的功效[2-4]。红枣不仅能鲜食、干食、制作枣醋、枣酒、枣饮料外,也可制作饲料,拓宽枣的利用渠道。张立明等[5]研究发现,枣粉可作为一种高能量饲料原料代替玉米喂养蛋公鸡。解彪等[6]研究发现,日粮枣粉以5%替代玉米在绵羊上应用效果最佳,绵羊生长性能良好。
植物多酚是一类具有抗氧化、抗癌、抗动脉硬化功能的物质,广泛存在于多种植物的不同部位[7-9]。目前研究发现,许多植物中存在着天然酚类物质,它们有天然的抗氧化性,己经成为当前研究的热点[10]。植物多酚可用于食品的保鲜,抑制食品贮藏过程期间发生腐败氧化[11-13]。植物多酚可以作为绿色饲料添加剂在养殖生产上具有良好应用效果[14]。晁娅梅等[15]以育肥猪为研究对象,在基础饲粮中添加400 mg/kg茶多酚,能显著提高育肥猪的净增重和平均日增重。
植物多酚的提取方法较多,主要包括有机溶剂提取、酶辅助提取、超高压及超临界萃取[16-17]、超声辅助提取、快速溶剂萃取[18-19]等。本研究采用有机溶剂浸提法和快速溶剂萃取法提取金丝小枣多酚,获取两种方法的最优提取工艺,并且比较两种方法的优劣,为枣多酚的深入研究和进一步的开发利用提供参考。
1 材料与方法
1.1 材料、仪器与试剂
试验材料为沧州金丝小枣。将金丝小枣清洗干净,切片,于温度60℃下,烘至恒重。烘干的枣片粉碎,过40目筛,获得枣粉,密封干燥保存备用[20]。
GZX-9070MBE型数显电热鼓风干燥箱:上海博讯实业有限公司;HH-6型恒温水浴锅:常州金坛良友仪器有限公司;JYL-C50T型九阳料理机:九阳股份有限公司;AXTD4型低速离心机:上海知信实验仪器技术有限公司;723N型可见分光光度计、FA1004N型电子天平:上海精密科学仪器有限公司;APLE-1000型快速溶剂萃取仪:北京吉天仪器有限公司。
福林-酚试剂、没食子酸(分析纯):南京都莱试剂公司;无水乙醇、碳酸钠(分析纯):天津市北辰方正试剂厂。
1.2 试验设计方案
1.2.1 有机溶剂浸提法
1.2.1.1 单因素试验
影响金丝小枣多酚提取的因素较多,针对有机溶剂浸提法,主要影响因素包括:提取剂浓度、提取时间、料液比、提取温度,因此选择这4个影响因素进行单因素试验,每个影响因素设置6个水平。
1)提取时间
准确称取0.5 g枣粉,用60%的乙醇配成料液比为1 ∶20(g/mL)的溶液,在 60 ℃的下分别提取 60、70、80、90、100、110 min,离心,获得金丝小枣多酚提取液,3 次重复,取平均值,分析提取时间与多酚提取率的关系。
2)乙醇浓度
准确称取0.5 g枣粉,用40%、50%、60%、70%、80%和90%的乙醇配成料液比为1∶20(g/mL)的溶液,在60℃的下提取80 min,离心,获得金丝小枣多酚提取液,3次重复,取平均值,分析乙醇浓度与多酚提取率的关系。
3)料液比
准确称取0.5 g枣粉,用60%的乙醇配成料液比为 1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30、1 ∶35(g/mL)的溶液,放在60℃下提取80 min,离心,获得金丝小枣多酚提取液,3次重复,取平均值,分析料液比与多酚提取率的关系。
4)提取温度
准确称取0.5 g枣粉,用60%的乙醇配成液料比为 1 ∶20(g/mL)的溶液,放在提取温度为 50、55、60、65、70、75 ℃下提取 80 min,离心,获得金丝小枣多酚提取液,3次重复,取平均值,分析提取温度与多酚提取率的关系。
1.2.1.2 正交试验
选取乙醇浓度、提取时间、料液比和提取温度这4个因素,每个因素设定3个水平(见表1)进行L9(34)的正交试验。

表1 有机溶剂浸提法因素水平表Table 1 Factors and levels of organic solvent extraction
1.2.2 快速溶剂萃取法
1.2.2.1 单因素试验
针对快速溶剂萃取法,主要影响因素包括:提取剂浓度、萃取时间、循环次数、萃取温度,因此选择这4个影响因素进行单因素试验,每个影响因素设置6个水平。
1)乙醇浓度
准确称取0.5 g枣粉,放入萃取池中,在溶剂瓶中分别加入40%、50%、60%、70%、80%和90%的乙醇,在10.0 MPa、温度70℃、萃取时间8 min、循环次数2次,3次重复,取平均值,分析乙醇浓度与多酚提取率的关系。
2)萃取时间
准确称取0.5 g枣粉,放入萃取池中,在溶剂瓶中加入60%的乙醇,在10.0 MPa、温度70℃、萃取时间分别为 8、10、12、14、16、18 min,循环次数 2 次,3 次重复,取平均值,分析萃取时间与多酚提取率的关系。
3)循环次数
准确称取0.5 g枣粉,放入萃取池中,在溶剂瓶中加入60%的乙醇,在10.0 MPa、温度70℃、萃取时间8 min,循环次数分别为1次、2次、3次、4次、5次、6次,3次重复,取平均值,分析循环次数与多酚提取率的关系。
4)萃取温度
准确称取0.5 g枣粉,放入萃取池中,在溶剂瓶中加入60%的乙醇,在10.0 MPa、萃取时间8 min,循环次数为 2 次,温度分别为 50、60、70、80、90、100 ℃,3 次重复,取平均值,分析萃取温度与多酚提取率的关系。
1.2.2.2 正交试验
选取了乙醇浓度、萃取时间、循环次数和萃取温度这4个因素,每个因素设定3个水平(见表2)进行L9(34)的正交试验。

表2 快速溶剂萃取法因素与水平Table 2 Factors and levels of rapid solvent extraction
1.3 指标测定
1.3.1 标准曲线测定
以没食子酸为对照品,采用福林-酚法测定多酚提取率[21-22],稍作调整。以没食子酸浓度为横坐标,吸光度值为纵坐标,得到回归方程为:y=5.42x+0.018 6,R2=0.999 2。
1.3.2 金丝小枣多酚提取率测定
取4 mL的提取液,放置于25 mL容量瓶中,加入12 mL 蒸馏水,1 mL 福林-酚试剂,混匀,5 min,加入5 mL10%Na2CO3溶液,混匀后,用蒸馏水定容。40℃避光反应1 h,在760 nm波长处测定吸光度值[23]。

式中:W为多酚提取率,mg/g;C为提取液多酚浓度,mg/mL;V 为提取液体积,mL;m 为枣的质量,g。
2 结果与分析
2.1 有机溶剂浸提法
2.1.1 单因素试验
2.1.1.1 提取时间对金丝小枣多酚提取的影响
提取时间对金丝小枣多酚提取的影响见图1。

图1 提取时间对金丝小枣多酚提取的影响Fig.1 The effect of extraction time on polyphenols extraction
由图1可知:在60 min到90 min时,金丝小枣多酚提取率呈上升趋势;90 min到110 min时,多酚提取率下降。在90 min时枣多酚提取率最高,为8.07 mg/g。提取时间延长,增加了溶剂与提取物接触的时间,有利于枣多酚的溶出,当提取物中多酚全部溶出后,再增加提取时间,多酚与空气中的氧接触时间过长,则会造成不稳定的多酚发生氧化损失。所以,选取90 min作为金丝小枣多酚提取的最佳提取时间。
2.1.1.2 乙醇浓度对金丝小枣多酚提取的影响
乙醇浓度对金丝小枣多酚提取的影响见图2。
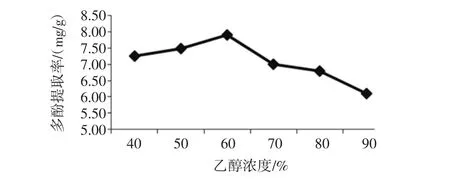
图2 乙醇浓度对金丝小枣多酚提取的影响Fig.2 The effect of ethanol concentration on polyphenols extraction
由图2可知:有机溶剂浸提法中,乙醇浓度为40%至60%时,金丝小枣多酚提取率逐渐上升;60%至90%时,多酚提取率呈现下降的趋势。在乙醇浓度为60%时,金丝小枣多酚提取率最高,此时多酚提取率为7.90 mg/g。说明乙醇浓度为60%时的溶液极性与枣多酚的极性相接近,易于枣多酚的溶出,但是,当乙醇浓度较高时,此时溶液的极性与枣多酚的极性相差较大,导致枣多酚溶出率降低,也有可能是高浓度的乙醇对枣多酚结构有破坏最用,或者高浓度的乙醇溶液易导致蛋白质发生变性,溶解度下降,甚至生成沉淀,细胞壁通透性降低,阻碍了枣多酚的溶出。所以,选取60%作为金丝小枣多酚提取的最佳乙醇浓度。
2.1.1.3 料液比对金丝小枣多酚提取的影响
料液比对金丝小枣多酚提取的影响见图3。

图3 料液比对金丝小枣多酚提取的影响Fig.3 The effect of material to liquid ratio on polyphenols extraction
由图3可知:料液比为1∶10时,金丝小枣多酚提取率为 7.38 mg/g;1 ∶15(g/mL)时为 8.02 mg/g,多酚提取率升高;之后随料液比增加,多酚提取率呈下降趋势,料液比为1∶35(g/mL),多酚提取率下降为5.87 mg/g。当料液比较大时,枣粉中的多酚不能全部溶出,当料液比为1∶15(g/mL)时,枣多酚全部溶出,之后,溶剂体积不断增加,枣多酚的溶出量不会发生变化,因此造成枣多酚的提取率降低。因此,选取1∶15(g/mL)作为金丝小枣多酚提取的最佳料液比。
2.1.1.4 提取温度对金丝小枣多酚提取的影响
提取温度对金丝小枣多酚提取的影响见图4。

图4 提取温度对金丝小枣多酚提取的影响Fig.4 The effect of extraction temperature on polyphenols extraction
由图4可以看出:当温度为50℃至70℃时,金丝小枣多酚提取率呈现升高趋势;75℃时,枣多酚提取率降低。在70℃时,多酚提取率最高为8.77 mg/g。温度升高,溶剂的渗透能增强,能有利于枣多酚从细胞中渗出;在过高的提取温度条件下,枣多酚结构已发生破坏,氧化程度升高,生物学功能降低。所以,选取70℃作为金丝小枣多酚提取的最佳提取温度。
2.1.2 正交试验
有机溶剂浸提法的正交结果见表3。
由表3可以看出:影响有机溶剂浸提法提取金丝小枣多酚的因素主次顺序为C>D>B>A,即:料液比>提取温度>乙醇浓度>提取时间,最佳提取组合为A2B2C2D2,此组合不在正交试验的表格中,因此按此理论组合重新进行3组平行试验,得到金丝小枣多酚的提取率为9.85 mg/g,比正交试验中最佳组合A1B2C2D2的结果高。因此,有机溶剂浸提法提取金丝小枣多酚的最佳提取条件为:提取时间90 min、乙醇浓度60%、料液比 1∶15(g/mL)、提取温度 70℃。
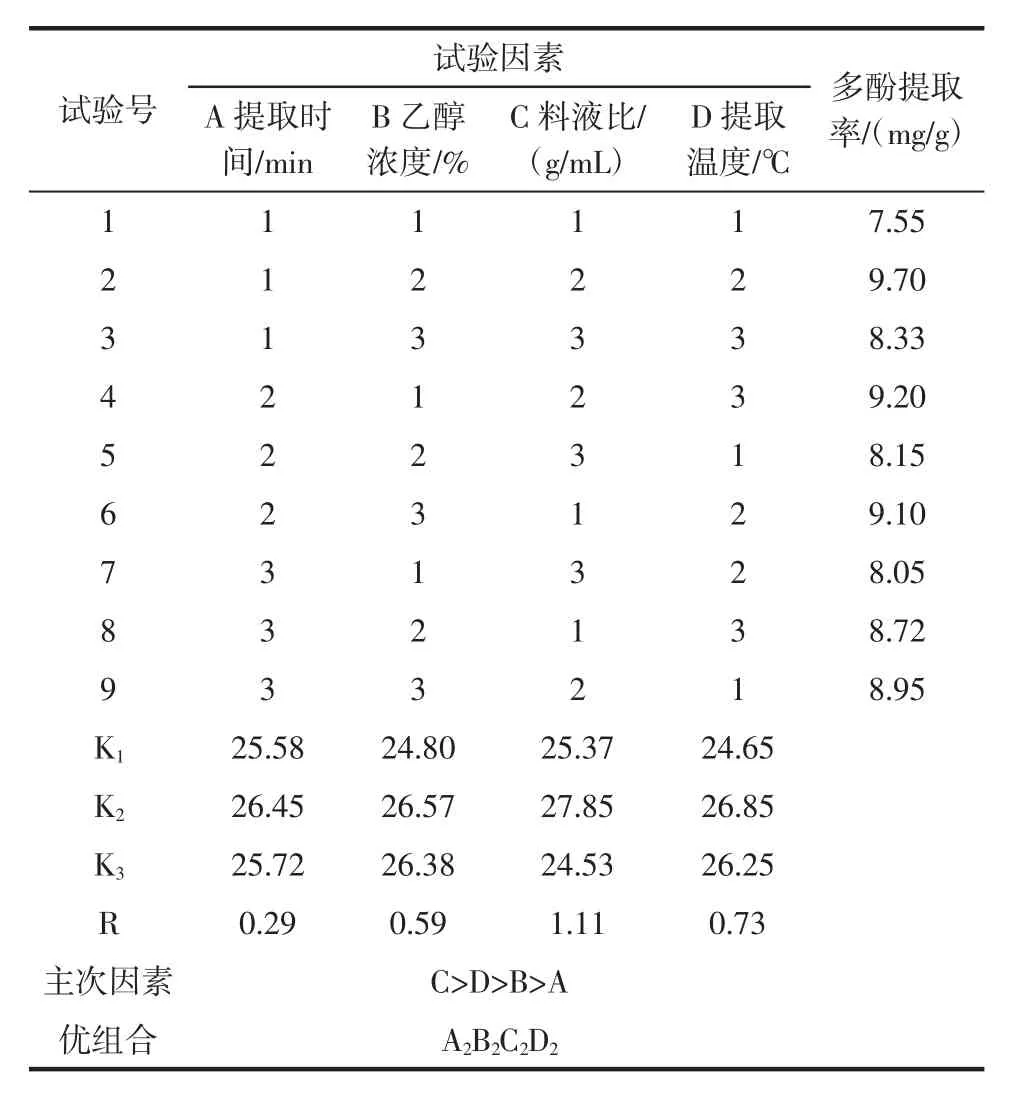
表3 有机溶剂浸提法正交试验结果Table 3 The result of orthogonal test of organic solvent extraction
2.2 快速溶剂萃取法
2.2.1 单因素试验
2.2.1.1 乙醇浓度对金丝小枣多酚提取的影响
乙醇浓度对金丝小枣多酚提取的影响见图5。

图5 乙醇浓度对金丝小枣多酚提取的影响Fig.5 The effect of ethanol concentration on polyphenols extraction
由图5可知:采用快速溶剂萃取法提取金丝小枣多酚时,乙醇浓度为40%到60%时,金丝小枣多酚提取率呈上升趋势;乙醇浓度为60%到90%时,多酚提取率逐渐降低。乙醇浓度为60%时,枣多酚提取率最高为10.05 mg/g。此方法中,乙醇浓度对枣多酚的影响与有机溶剂浸提法相似,枣多酚在乙醇浓度为60%时溶解性最好。因而,选取60%作为金丝小枣多酚提取的最佳乙醇浓度。
2.2.1.2 萃取时间对金丝小枣多酚提取的影响
萃取时间对金丝小枣多酚提取的影响见图6。

图6 萃取时间对金丝小枣多酚提取的影响Fig.6 The effect of extraction time on polyphenols extraction
由图6可以看出:当萃取时间为8 min到14 min时,多酚提取率平缓的上升;在萃取时间为14 min到18 min时,多酚提取率骤然下降。在萃取时间为14 min时,多酚提取率最高为10.76 mg/g。随着时间的延长,样品中待提取物质向溶剂中溶解度增加,快速溶剂萃取法具有快速、高效的特点,提取时间较短,当提取时间为14 min时,枣多酚全部溶出,时间加长,可能会造成枣多酚的分解和氧化。因而,选取14 min作为金丝小枣多酚提取的最佳萃取时间。
2.2.1.3 循环次数对金丝小枣多酚提取的影响
循环次数对金丝小枣多酚提取的影响见图7。

图7 循环次数对金丝小枣多酚提取的影响Fig.7 The effect of cycle number on polyphenols extraction
由图7可以看出:循环次数为1次到3次时,金丝小枣多酚提取率快速的升高;循环次数超过3次,多酚提取率呈下降趋势。在循环3次时,金丝小枣多酚提取率最高,为11.55 mg/g。循环次数增加,能更有效的促进样品中多酚的溶出,当循环次数为3次时,样品中多酚已全部溶出。因而,选取循环3次作为金丝小枣多酚提取的最佳循环次数。
2.2.1.4 萃取温度对金丝小枣多酚提取的影响
萃取温度对金丝小枣多酚提取的影响见图8。
从图8中可以看出:萃取温度为50℃到70℃时,金丝小枣多酚提取率逐渐上升;萃取温度为70℃到100℃时,多酚提取率下降。萃取温度为70℃时,多酚提取率达到最高,为11.70 mg/g。与有机溶剂浸提法相似,当萃取温度过高,枣多酚结构发生破坏,氧化程度增加,细胞膜脂质过氧化程度增加,生物学功能降低。因而,选取70℃作为金丝小枣多酚提取的最佳萃取温度。

图8 萃取温度对金丝小枣多酚提取的影响Fig.8 The effect of extraction temperature on polyphenols extraction
2.2.2 正交试验
快速溶剂萃取法的正交结果见表4。

表4 快速溶剂萃取法正交试验结果Table 4 The result of orthogonal test of rapid solvent extraction
由试验结果可以看出:影响快速溶剂萃取法提取金丝小枣多酚提取率的因素主次顺序为C>D>A>B,即:循环次数>萃取温度>乙醇浓度>萃取时间,最佳提取组合为A3B3C1D1,此组合不在正交试验的表格中,因此按此理论组合重新进行3组平行试验,得到金丝小枣多酚的提取率为10.85 mg/g,比正交试验中最佳组合A3B3C2D1的结果高。因此,快速溶剂萃取法提取金丝小枣多酚的最佳提取条件为:乙醇浓度70%、萃取时间16 min、循环次数2次、萃取温度60℃。
2.3 不同提取方法的比较
2.3.1 提取率的比较
有机溶剂浸提法与快速溶剂萃取法金丝小枣多酚提取率的比较见图9。
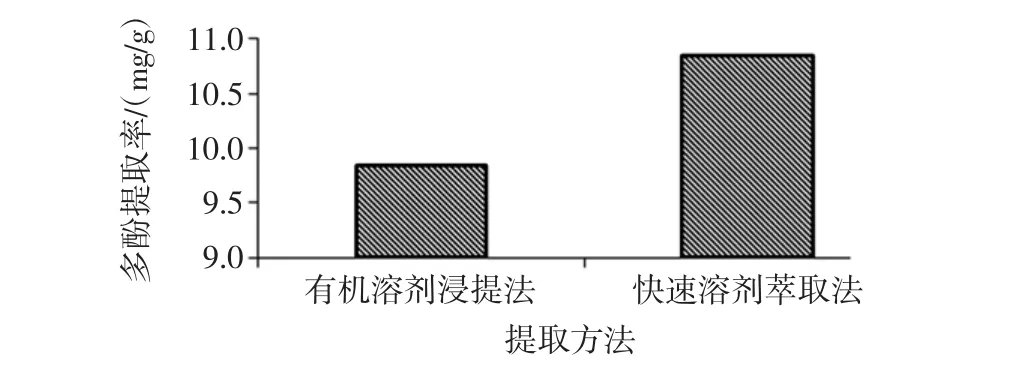
图9 不同提取方法的比较Fig.9 Comparison of different extraction methods
由图9可知:比较分别两种提取方法的最优组合条件下提取多酚,快速溶剂萃取法时,多酚提取率为10.85mg/g;有机溶剂浸提法时,多酚提取率为9.85mg/g;快速溶剂萃取法是有机溶剂浸提法的1.10倍。快速溶剂萃取法提取金丝小枣多酚,其提取率高于有机溶剂浸提法。
2.3.2 提取时间的比较
有机溶剂浸提法与快速溶剂萃取法金丝小枣多酚提取时间的比较见图10。

图10 不同提取方法提取时间的比较Fig.10 Comparison of extraction time of different extraction methods
由图10可以看出:有机溶剂浸提法提取金丝小枣多酚提取时间较长,为90 min,快速溶剂萃取法所用时间较短,为:16 min。
3 结论
采用有机溶剂浸提法和快速溶剂萃取法提取金丝小枣多酚,在单因素试验的基础上,进行正交试验。获得不同提取方法的最佳提取条件。有机溶剂浸提法提取金丝小枣多酚最佳提取条件为:提取时间90 min、乙醇浓度60%、料液比1∶15(g/mL)、提取温度70℃;快速溶剂萃取法最佳提取条件为:乙醇浓度70%、萃取时间16 min、循环次数2次、萃取温度60℃。
在最优提取工艺条件下,提取金丝小枣多酚,有机溶剂浸提法和快速溶剂萃取法提取的多酚提取率分别为9.85、10.85 mg/g。通过结果比较可知:快速溶剂萃取法提取的金丝小枣多酚提取率高于有机溶剂浸提法。快速溶剂萃取法用时明显低于有机溶剂浸提法。
