2株不同序列分型耐黏菌素大肠埃希菌耐药机制分析*
2020-06-01曹星卫肖艳萍钟桥石杭亚萍陈艳慧方雪瑶刘艳华胡龙华南昌大学第二附属医院检验科江西省检验医学重点实验室南昌330006
曹星卫,肖艳萍,钟桥石,杭亚萍,陈艳慧,方雪瑶,刘艳华,胡龙华(南昌大学第二附属医院检验科,江西省检验医学重点实验室,南昌330006)
近年来,革兰阴性杆菌临床分离株多重耐药性严重,尤其耐碳青霉烯类肠杆菌科细菌(carbapenem-resistant Enterobacteriaceae,CRE)上升趋势明显,2017年全国CRE检出率高达9.4%[1]。黏菌素是目前国际上推荐用于治疗多重耐药革兰阴性杆菌感染的“最后一道防线”[2]。随着黏菌素在临床使用量的增加,耐黏菌素肠杆菌科细菌已开始出现。2015年我国学者报道从人和动物分离的肠杆菌科细菌中发现质粒介导的黏菌素耐药基因mcr-1,自此揭开对黏菌素耐药机制的新认识[3]。目前在多个国家和地区人和动物源的分离菌株中发现了该基因,且携带该基因的菌种分布广,肠杆菌科细菌中大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌、产气肠杆菌、阪崎肠杆菌、宋内志贺菌及肠炎沙门菌等均有分离报道[3-4]。本研究就我院临床分离的2株mcr-1阳性大肠埃希菌的耐药特征和传播机制进行研究。
1 材料与方法
1.1菌株来源 收集2017年1—12月南昌大学第二附属医院分离的90株非重复大肠埃希菌,用E-test 法对菌株进行黏菌素药敏初筛试验,共筛出2 株黏菌素耐药菌株,其中1株(编号N408)于2017年1月分离自1名重症监护病区男性患者腹水标本,另1株(编号N433)于2017年2月分离自1名肿瘤科病区男性患者血液标本;质控菌株大肠埃希菌ATCC25922、肺炎克雷伯菌ATCC700603、阴沟肠杆菌029M、耐叠氮钠大肠埃希菌J53以及沙门菌H9812菌株均为本实验室保存。
1.2主要仪器及试剂 Vitek 2 Compact全自动微生物鉴定仪及Vitek MS质谱仪(法国生物梅里埃公司),PCR仪(杭州朗基科学仪器公司),CHEF.DR11型脉冲场电泳系统及普通电泳仪(美国Bio-Rad公司),凝胶成像仪(上海天能公司),ABI 3730XL测序仪(杭州擎科生物公司);2×PCR Master Mix、EB染液、常规琼脂糖、TBE液、琼脂糖凝胶回收试剂盒(上海生工公司),DNA marker(北京天根生化公司),S1酶、XbaⅠ酶及蛋白酶K(日本TaKaRa公司),黏菌素、叠氮钠(北京索莱宝公司),SeaKem Gold Agarose(美国Cambrex公司),药敏纸片(英国Oxoid公司),黏菌素 E-test 药敏条(意大利利飞驰公司)。
1.3菌株鉴定及药物敏感性试验 用Vitek 2 Compact 全自动微生物鉴定仪和Vitek MS质谱仪进行菌种鉴定,用AST-GN16药敏卡进行药敏检测,结果根据2018年美国临床和实验室标准化协会(CLSI)标准[5]进行判断。利用微量肉汤稀释法测定黏菌素的最低抑菌浓度(MIC),大肠埃希菌ATCC25922用于质控,药敏折点参照 EUCAST 7.0版判读标准(敏感:MIC≤2 μg/mL)[6]。
1.4产酶表型确证试验 用Vitek 2 Compact 全自动微生物鉴定仪检测实验菌株是否产ESBLs,肺炎克雷伯菌ATCC700603和大肠埃希菌ATCC25922为ESBLs检测的阳性和阴性质控菌株;根据文献[7]进行三维试验检测AmpC酶:提取酶粗提物于-80 ℃反复冻融,将调成0.5麦氏浊度单位的大肠埃希菌ATCC25922菌液涂布M-H琼脂培养基,将头孢西丁纸片贴在培养基中心,沿纸片边缘向外划线加入酶粗提物,35 ℃孵育过夜,以阴沟肠杆菌029M和大肠埃希菌ATCC25922分别作为AmpC酶阳性和阴性质控菌株。
1.5耐药基因检测 用加热煮沸法[8]提取细菌DNA并作为模板。根据文献[8]和Permer Primer 5.0软件设计引物,序列见表1,由杭州擎科生物公司合成。用PCR检测超广谱β-内酰胺酶(ESBLs)基因(blaTEM、blaSHV、blaCTX-M),AmpC酶基因(blaAAC、blaCIT、blaDHA、blaEBC、blaFOX、blaMOX),质粒介导喹诺酮耐药基因[qnrA、qnrB、qnrS、acc(6′)-Ib-cr]和黏菌素耐药基因mcr-1。PCR反应体系50 μL,其中DNA模板1 μL、上、下游引物(10 μmol/L)各2 μL、ddH2O 20 μL、2×PCR Master Mix 25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,退火(各基因退火温度见表1)30 s,72 ℃ 延伸1 min,35个循环;72 ℃ 10 min。扩增产物经10 g/L琼脂糖凝胶电泳并观察结果。所有扩增阳性产物经切胶纯化后送杭州擎科生物公司采用桑格测序技术进行测序,测序结果经拼接后与GenBank序列进行比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi),确定耐药基因。

表1 PCR引物序列及扩增产物长度
1.6接合试验 参照文献[8]的方法,将2株大肠埃希菌和J53菌株接种在血琼脂平板上,37 ℃过夜培养,分别挑取单菌落接种至5 mL LB培养基,37 ℃ 220 r/min 12 h。分别吸取供体菌(2株大肠埃希菌)200 μL和受体菌(J53)100 μL于4 mL LB培养基中,37 ℃静置24 h。吸取混合菌悬液100 μL均匀涂布于含黏菌素(2 μg/mL)和叠氮钠(200 μg/mL)的LB平板上。供体菌和受体菌同样涂布含抗菌药物LB平板,37 ℃培养过夜,挑取筛选平板上单个菌落,转种血琼脂平板,37 ℃培养过夜,对接合子进行鉴定和药敏试验、表型筛选试验以及后续的耐药基因检测。
1.7多位点序列分型(multilocus sequence typing, MLST) 参照网站(http://mlst.warwick.ae.uk/Mlst/dbs/Ecoli for Ecoli)合成大肠埃希菌7对管家基因引物(adk、fumC、gyrB、icd、mdh、purA、recA),并根据相应条件进行PCR扩增,阳性产物送杭州擎科公司进行测序并拼接,将序列提交至MLST数据库进行比对,获得每个管家基因的等位编号及序列分型(sequence type, ST)。
1.8脉冲场凝胶电泳(pulsed-field gel electrophoresis, PFGE) 将H9812菌株、2株大肠埃希菌菌液与低熔点胶混匀后灌模,蛋白酶K消化2 h,使用XbaI内切酶消化4 h。配制10 g/L SeaKem Gold凝胶,在CHEF.DR11型脉冲场电泳系统上进行PFGE。电泳参数6 V/cm,脉冲时间4~40 s,0.5×TBE电泳缓冲液,电场角度120°,电泳时间19 h。电泳后胶块经EB染色后成像观察。
1.9S1酶切脉冲场凝胶电泳(S1-PFGE) 将H9812菌株、J53、2株大肠埃希菌及接合子分别灌模制胶,用XbaI内切酶酶切H9812后作为marker,S1酶对J53、2株大肠埃希菌及接合子进行酶切;电泳参数同1.8,电泳后胶块经EB染色后成像观察。
2 结果
2.1菌株鉴定及药敏结果 2株菌均为大肠埃希菌。药敏结果显示N408及接合子JN408对除头孢吡肟和碳青霉烯类外的其他β-内酰胺类、喹诺酮类、黏菌素耐药,对氨基糖苷类和替加环素敏感。N433及接合子JN433对大多数β-内酰胺类、替加环素敏感,而对喹诺酮类及黏菌素耐药。见表2。
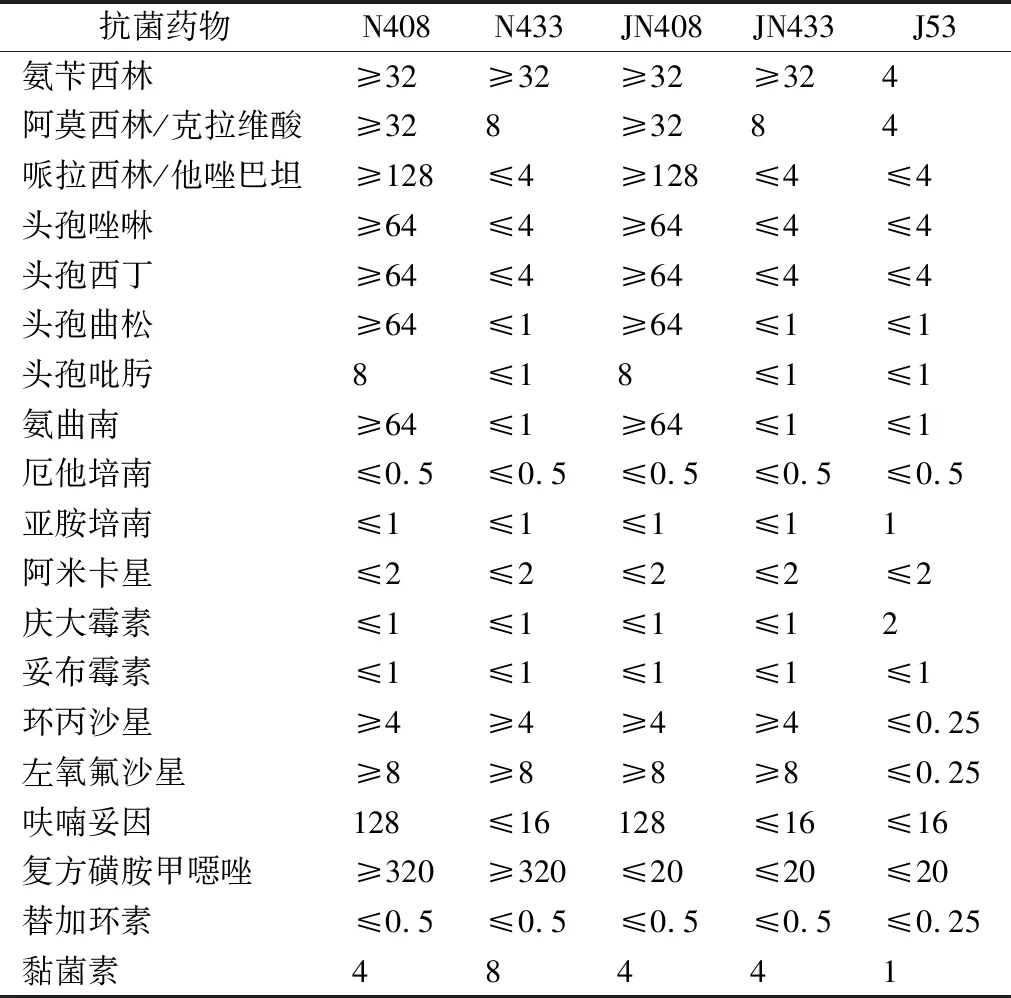
表2 供体菌、受体菌及接合子的药敏试验结果(μg/mL)
2.2产酶表型结果 N408和N433及其接合子检测产ESBLs试验结果均为阴性;N408及其接合子三维试验阳性,N433及其接合子为阴性。
2.3耐药基因结果 PCR扩增及测序比对结果显示N408和JN408均携带mcr-1和blaCIT基因;N433携带mcr-1和blaTEM-1基因,JN433仅携带mcr-1基因,其余基因检测结果均为阴性。见图1。
2.4接合试验结果 接合子JN408和JN433均能在含黏菌素和叠氮钠的平板上生长,表明接合试验成功。2株接合子均对黏菌素耐药,且均检测到mcr-1基因。
2.5MLST结果 N408为ST453型,N433为ST8900型。
2.6PFGE和S1-PFGE结果 PFGE结果显示2株菌条带明显不同,见图2。S1-PFGE结果显示N408含有2个质粒,质粒大小分别为78 000 bp和138 000 bp左右,JN408仅含1个78 000 bp左右的质粒;N433和JN433均含1个33 000 bp左右的质粒,见图3。
3 讨论
本研究发现2株携带mcr-1基因的耐黏菌素大肠埃希菌,为江西地区首次报道。研究报道黏菌素耐药临床分离菌株通常呈现多重耐药性[3]。但本研究的2株菌株对碳青霉烯类药物均敏感,尤其是菌株N433除对氨苄西林、喹诺酮类及黏菌素耐药外,对其余16种检测药物均敏感,表明临床分离黏菌素耐药菌株也可呈现对多种抗菌药物敏感,这同浙江地区报道类似[9]。虽然对黏菌素耐药,但对碳青霉烯类、替加环素等抗菌药物保持敏感性。对于这类菌株感染的患者仍有可选的抗菌药物可供治疗。对2株菌株分别检测ESBLs类、AmpC类、喹诺酮类及黏菌素类等14种耐药基因,检测结果与耐药表型一致,2株菌均检出mcr-1基因,菌株N408同时检出blaCIT基因;而对氨苄西林耐药,对其他β-内酰胺类敏感的菌株N433仅检出窄谱β-内酰胺酶基因blaTEM-1。2株菌接合试验均成功将mcr-1基因转移到受体菌中,表明mrc-1基因可通过质粒在菌种之间水平传播,这与目前研究的黏菌素耐药机制一致[3]。同时提示临床应该加强对此类细菌的监测,防止mcr-1转移至其他耐药菌株间,产生泛耐药菌株。S1-PFGE结果显示接合子JN408和JN433均检测到一个质粒,大小分别约为78 000 bp和33 000 bp,由于未进行Southern blot杂交实验,但接合子菌均仅含1个质粒,可初步推测这2株菌的mcr-1基因位于上述质粒上。其中编号N433菌株中mcr-1位于约33 000 bp大小的质粒上,与黄旭等[10]报道的1例大肠埃希菌中携带mcr-1基因的质粒大小一致。
2株携带mcr-1基因大肠埃希菌ST型分别为ST453和ST8900,与国内外报道的ST156、ST167、ST648、ST10、ST2736等[3,11-13]有所不同,是新发现的携带mcr-1基因不同ST型大肠埃希菌。这可能是导致黏菌素耐药菌株对其他药物敏感性不同于其他黏菌素耐药菌株对多种药物耐药的原因。2株菌的MLST分型和PFGE结果均不同,提示菌株同源性不高,且分属不同的克隆种群,表明2株菌为非克隆传播。查阅2名患者的住院病历,发现感染患者分别入住不同科室,且2个科室分别在不同住院大楼,2名患者住院时间也无交集,患者近期也没有外出旅行史,提示菌株来源不明确,存在散发传播的可能。
