新型冠状病毒核酸检测高循环阈值情况分析*
2020-06-01朱晓燕徐俊驰沈强吴敏娟宋华峰黄丽娜周梅鹤胥萍苏州市第五人民医院检验中心江苏苏州53苏州市疾病预防控制中心江苏苏州5007
朱晓燕,徐俊驰,沈强,吴敏娟,宋华峰,黄丽娜,周梅鹤,胥萍(. 苏州市第五人民医院检验中心,江苏苏州 53;. 苏州市疾病预防控制中心,江苏苏州5007)
新型冠状病毒属于单链RNA病毒,是一种新型β属冠状病毒,其基因组序列约29 000 bp,含有10个基因,可有效编码10个蛋白质[1-2]。2019年12月在湖北省武汉市出现该病毒感染人类引起肺炎病例[3],随着疫情的迅速蔓延和发展,迫切需要对具有临床症状的患者及疑似患者进行有效、快速的诊断和鉴别诊断。新型冠状病毒核酸检测能为新型冠状病毒感染诊断提供病原学证据,但受多种因素影响,检测数据易出现假阴性、假阳性情况。本研究围绕目前医院开展新型冠状病毒核酸检测中常用的RT-PCR法中出现高循环阈值(cycle threshold,Ct值)样本进行初步分析和讨论。
1 材料与方法
1.1样本 2020年2月14日至2月30日苏州市各医院新型冠状病毒核酸检测Ct值≤38的样本24例;样本类型为鼻咽拭子及肛拭子,采样后置于同一病毒采样管中送检。
1.2仪器及试剂 MagNA Pure 96全自动核酸纯化仪、Light Cycle 480实时荧光PCR仪(美国Roche公司),ABI 7500实时荧光PCR仪(美国ABI公司);MagNA Pure 96纯化试剂及其配套系列耗材(美国Roche公司),新型冠状病毒2019-nCoV核酸检测试剂盒(上海伯杰公司)。
1.3方法
1.3.1样本处理及核酸提取 样本核酸纯化处理前于56 ℃灭活30 min[4-5]。从病毒保存管中吸取200 μL样本至MagNA Pure 96处理槽,将处理槽内待检样本置于MagNA Pure 96全自动核酸纯化仪内,根据操作程序,机器自动进行核酸纯化。
1.3.2核酸扩增 按新型冠状病毒2019-nCoV核酸检测试剂盒说明书配制25 μL反应体系,包括核酸扩增反应液12 μL、酶混合液4 μL、ORF1ab/N反应液4 μL,样本核酸5 μL。检测靶点为ORF1ab及N 2个靶标,试剂盒带内参。按照试剂说明书中反应条件设定程序,进行实时荧光RT-PCR反应。分别在Light Cycle 480实时荧光PCR仪、ABI 7500实时荧光PCR仪上进行。
1.3.3结果分析 根据阴性对照的扩增曲线调节起止值,进行分析。根据试剂说明书提供的结果判定标准(见表1),检测结果利用ROC曲线法确定ORF1ab、N参考值Ct值均为38。将Ct值为 33~38的样本定义为高Ct值样本。

表1 结果判定标准
2 实验与结果
2.1试剂盒检出限验证结果 阳性对照(浓度为106~107copies/mL)经1∶10、1∶100、1∶1 000、1∶10 000、1∶100 000、1∶1 000 000 6个梯度稀释,验证结果与试剂盒说明书相符,检出限为103copies/mL,Ct值最低为23.66。
2.2实时荧光RT-PCR检测结果
2.2.1同一样本核酸在同一实验室不同品牌基因扩增仪上检测结果 9例Ct值≤38样本,其中有7例高Ct值样本(33≤Ct值≤38),2例低Ct值样本(Ct值<33)。对9例样本分别在同一实验室ABI 7500扩增仪和Light Cycle 480扩增仪上进行实时荧光PCR,结果7例高Ct值样本有6例同一样本核酸在Light Cycle 480及ABI 7500 2台扩增仪的检测结果不一致,包括ORF1ab基因检测结果不一致4例,N基因不一致4例,其中ORF1ab基因和N基因均不一致2例,见表2;而Ct值<33的核酸样本复检结果一致,Ct值仍<33。
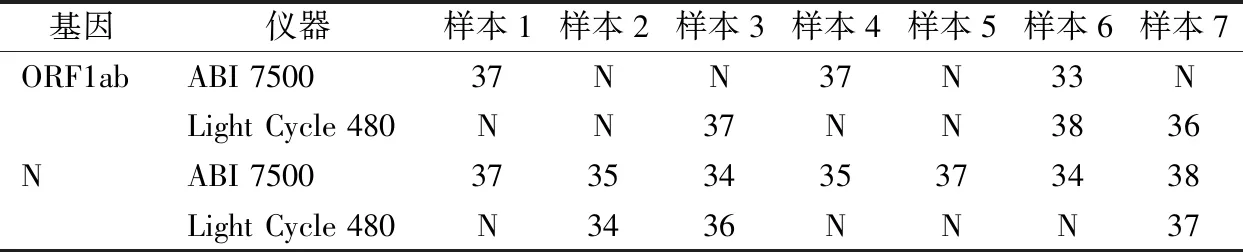
表2 7例高Ct值同一核酸样本在ABI 7500及Light Cycle 480扩增仪检测结果比较
2.2.2ORF1ab基因单靶位高Ct值患者重复采样核酸检测结果 有8例ORF1ab基因单靶位高Ct值样本首次检测Ct值分别为36.51、35.97、35.29、35.41、35.61、36.20、36.48、36.80(见图1)。次日重复采样,同试剂同仪器再次检测,结果双靶标均为阴性(见图2)。
2.2.3高Ct值样本不同实验室相同基因扩增仪复检结果 有7例咽拭子肛拭子混合液样本(其中5例33≤Ct值≤38,2例Ct值<33)在本实验室检测后,送苏州市另一基因扩增实验室相同品牌仪器上检测,结果5例高Ct值的样本不同实验室相同基因扩增仪结果均不一致(见表3);2例低Ct值样本不同实验室阴阳性检测结果一致,Ct值仍<33。
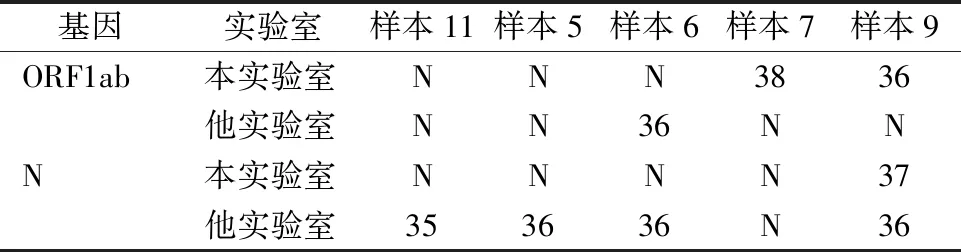
表3 高Ct值同一样本在不同实验室相同基因扩增仪复检结果不一致
3 讨论
本实验自检测新型冠状病毒核酸以来出现以下现象:同一患者重复采样结果不一致;同一检测样本及其核酸在同一实验室不同基因扩增仪上结果不一致;同一样本在不同实验室间相同型号仪器检测结果不一致;同时本实验室针对试剂盒的检出限进行验证,证明所用试剂盒检测灵敏度具备本文中高Ct值样本的检测能力。
针对以上高Ct值样本复检后结果出现不符的现象,笔者分析影响检测结果各环节中的因素。首先,目前新型冠状病毒实验室检测路径未标准化,所用的核酸检测试剂盒研发时间紧迫,尚缺乏足够的评估及大样本的临床验证。其次,不同样本类型对新型冠状病毒的核酸检测结果产生影响,本实验标本为咽拭子及肛拭子病毒采样液,而在最新版诊疗方案中,其确诊所提到的核酸检测样本类型不仅包含呼吸道样本及血液样本,同时在实验室检查中增加“粪便样本中可检测新型冠状病毒核酸[1]”。临床上多数患者咳痰困难,下呼吸道灌洗液样本难以取得,且操作的生物安全风险极大,故呼吸道样本以鼻咽拭子及咽拭子为主,而拭子样本采用目前的RT-PCR试剂盒,据估计阳性检出率只有30%~50%,大量的假阴性结果无法避免,必须多次取样检测或结合其他类型样本检查结果。
有研究发现,分别采集新型冠状病毒疑似病例呼吸道不同类型样本进行核酸检测,咽拭子样本中新型冠状病毒阳性检出率低于深部痰样本,差异有统计学意义;病毒含量的降低可出现同一患者重复采样核酸检测结果不一致的现象。不同呼吸道样本取样材料对新型冠状病毒核酸检测结果也产生影响。有研究在确诊患者中比较了带病毒保存液的植绒拭子样本及无病毒保存液的普通棉签拭子样本中新型冠状病毒核酸检测结果,发现普通棉签拭子的核酸检出率明显低于带病毒保存液的植绒拭子(P<0.05),普通棉签拭子即便检出,其阳性Ct值也显著大于植绒拭子[6]。本实验室所用采样样本为普通棉签拭子和植绒拭子各自取样后置于同一病毒采样管中形成的混合溶液,可能会降低核酸的阳性检出率。目前相关的诊疗方案及实验室检测指南并未提及用于采集鼻咽拭子及咽拭子的拭子种类,但对于呼吸道样本的病毒核酸检测来说,不同的拭子及保存管可能影响核酸检测结果,但相关影响因素尚未见报道。目前我们采用的病毒采样管的保存液为Hanks液,其对于新型冠状病毒RNA保存的稳定性尚无研究,另外采样过程中RNA酶的污染也可导致核酸检测阳性率随着保存时间的延长而降低。因此,本实验室出现当天检测的阳性样本经过4 ℃保存、次日检测出现阴性结果的现象。
至于本实验室出现当天检出阳性样本的核酸,经-20 ℃冻存过夜,次日复溶后再次在另一台核酸扩增仪上进行扩增,高Ct值出现结果不一致的现象,分析原因可能是,RNA病毒经冻融后出现降解。次日检测未同时在2台仪器上检测,在今后的研究中可增加样本量并进行2台仪器同时检测。
针对目前出现的以上关于新型冠状病毒核酸检测的问题及疑惑,仅以核酸检测为金标准,同时在某个阶段配合新型冠状病毒抗原或IgM及IgG抗体;或者采用更灵敏的核酸检测方法,如数字PCR;或通过病毒快速富集仪进行富集,提高病毒浓度,进而增加检测的灵敏度和准确性等措施,可提高新型冠状病毒核酸检测能力,尽可能降低假阴性或假阳性。
