4-羟基他莫昔芬依赖的内含肽调控绿色荧光蛋白功能研究
2019-12-25赵拯浩王步森王玉东朱丹妮董铭心侯利华陈薇
赵拯浩,王步森,王玉东,朱丹妮,董铭心,侯利华,陈薇
军事科学院军事医学研究院生物工程研究所,北京100071
内含肽(intein)是位于宿主蛋白质中的一段插入序列。经典内含肽结构由催化蛋白剪接的N端和C 端剪接结构域以及位于中央的归巢内切酶结构域构成一个马蹄铁状的结构[1],其对应的核苷酸序列嵌合在宿主蛋白对应的核酸序列中,与宿主蛋白基因存在于同一开放读框内,并与宿主蛋白基因进行同步转录和翻译。当翻译形成蛋白质前体后,内含肽从蛋白质前体中切除,从而产生成熟的宿主蛋白[2-3]。在此过程中,内含肽序列被准确切除,而其两侧被称为外显肽(extein)的2 段宿主蛋白质序列则通过正常的肽键连接起来。内含肽在多种环境下形成和清除肽键的能力,使得其发展成为分子生物学强有力的工具,应用于蛋白质修饰、纯化、生物传感器等领域[4-6]。
天然内含肽的自剪接不需要ATP、酶及小分子的参与,但这种自剪接的功能是不利于外部调控的。Liu 等[7]基于天然内含肽结构,开发了一种基于内含肽的分子开关,这个分子开关可将小分子的结合转化成目标蛋白质的激活。这种可以利用小分子4-羟基他莫昔芬(4-hydroxytamoxifen,4-HT)调控的内含肽最早来源于结核分枝杆菌RecA 内含肽结构中的部分序列,在融合了304~551 氨基酸残基的人雌激素受体配体结合域(estrogen receptor-ligand binding domain,ER-LBD)后,得到了含有424 个氨基酸残基的内含肽融合蛋白。为了使这一内含肽融合蛋白在哺乳动物细胞中也能高效应用,Peck 等[8]通过反复诱变和选择,产生了高度依赖4-HT 的具有强剪接活性的内含肽,得到一套低背景、快速剪切、适用哺乳动物细胞的内含肽系统。
目前国外文献报道利用这种分子开关能够实现对包括Cas9[9-10]、增强型绿色荧光蛋白(eGFP)[7]和卡那霉素抗性蛋白[11]在内的多种蛋白的调控作用,国内尚无利用这种分子开关的相关报道。本实验旨在验证小分子调控的内含肽剪接技术在eGFP 上应用的效率,针对eGFP 的结构与功能在其基因上筛选出剪接效率更高的位点,并基于筛选结果,摸索小分子的最适工作条件。
1 材料与方法
1.1 材料
pVax-Intein 质粒由上海生工公司合成;质粒提取试剂盒(Promega,A1223);胶回收试剂盒(TaKaRa,9762);DNA 片段回收试剂盒(TaKaRa,9761);PremixTaq预混液(TaKaRa,RR902);2×Q5 PCR 聚合酶(NEB,M0494S);高保真DNA 组装预混液(NEB,E2621L);六孔细胞培养板(Corning);凝胶成像仪(Clinx Science,GenoSens 1560);超微量分光光度计(GE,NanoVue Plus);PCR 扩增仪(Eppendorf AG 22331 Hamburg);荧光显微镜(BioTek,CY71V);流式细胞仪(BD FACSCantoⅡ);电热恒温培养箱(泰斯特,DH5000BⅡ);恒温振荡器(Crystal,IS-RDV1)。
1.2 扩增内含肽片段与线性化载体pMD-eGFP
根据改构的4-HT 可调控的内含肽与eGFP 基因(GenBank:NC025025.1)序列[8],用Vector NTI 设计PCR 引物(表1)。以Vax-Intein、pMD-eGFP 质粒(实验室保存)为模板进行PCR 扩增(扩增条件:94℃5 min;94℃30 s,56℃30 s,72℃30 s/kb,32 个循环;72℃5 min)。50 μL 扩增体系包括模板10 ng,上、下游引物各0.5 μmol/L,2×Q5热启动PCR 聚合酶25 μL,加22 μL 超纯水补齐50 μL。PCR 结束后4℃保存产物,行1%琼脂糖凝胶电泳,电泳毕,用凝胶成像系统对胶进行观察,对符合预期的条带用胶回收试剂盒回收。
1.3 重组载体pMD-eGFP-Intein 的构建和阳性克隆鉴定
将1.2 中回收的内含肽片段与线性化载体片段引物以摩尔比2∶1 的比例总计3 μL 加入0.25 mL EP 管中,添加NEBuilder 2×Mix 5 μL,去离子水补齐10 μL,混匀后在50℃金属浴上重组反应15 min。反应结束后,立即放入冰中冷却,后放入4℃暂存。将重组质粒转入TOP10 感受态大肠杆菌,菌液涂布于含50 μg/mg 氨苄青霉素的LB固体培养基上,37℃培养过夜,从转化平板中挑取单菌落各4 个,划线培养,并进行菌落PCR,引物为InteinF/R。PCR 反应体系(20 μL)包括模板(菌落),正、反向引物各0.4 μL,PremixTaq预混液10 μL,加水补齐20 μL。扩增条件:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 2 min,32 循环;72℃ 5 min。用1%琼脂糖凝胶电泳检测。从平板上挑取鉴定阳性菌落在5 mL 含氨苄青霉素的LB 培养基中37℃振荡培养14~16 h,提取质粒后测序确定目的序列。
1.4 质粒转染HEK293 细胞系
293 T 细胞以3.5×105~5×105/孔接种至12 孔板,于37℃、5% CO2细胞培养箱中培育14~16 h,使细胞密度达到60%~70%。在1.5 mL 离心管中加入100 μL Opti-MEM 培养基,随后按每孔1 μg质粒、2 μL Turbofect 转染试剂在离心管中配制转染体系,混匀后室温静置15 min,滴加至12 孔板中,轻摇混匀。在实验组中加入4-HT 的DMSO溶液1 μL,终浓度为1 μmol/L,在对照组中加入1 μL DMSO。
1.5 流式细胞术检测细胞荧光强度
转染36 h 后,移除1.4 中的细胞上清,每孔用1 mL PBS 漂洗1 次后加入300 μL 1%胰酶,37℃孵育2 min。用1 mL PBS 将细胞吹打重悬并转移至流式管中,4℃、600 r/min 离心5 min。弃上清,重新用3 mL PBS 重悬细胞,再次4℃、600 r/min 离心5 min,弃上清,用150 μL PBS 重悬细胞,流式上机检测FITC 值。
1.6 统计学处理
采用SPSS 19.0 软件进行数据分析。采用t检验分析比较添加小分子的实验组与对照组的荧光强度,P<0.05 为差异有统计学差异,P<0.01为差异具有统计学显著差异。
1.7 4-HT 最适浓度的探究
质粒转染细胞步骤同1.4。转染细胞后,分别在实验组中添加梯度稀释的4-HT,使4-HT 在培养基中的终浓度分别为16、8、4、2、1、2-1、2-2、2-3、2-4、2-5、2-7、2-9、2-11、2-13、2-15μmol/L。后续检测及统计学处理同1.5 和1.6。
2 结果
2.1 pMD-eGFP-Intein 的构建
eGFP 能够在蓝色光的激发下发出绿色荧光。eGFP 的发光依赖于其紧密的β桶结构,在内含肽替换位点的选取上主要考虑4-HT 容易接触到的β桶的外侧以及β桶两端的无规卷曲区域,期望能够实现内含肽在剪接前因破坏了eGFP 发色团共轭结构而使eGFP 不能发出荧光,而内含肽发生剪接后eGFP 发色团共轭结构得到恢复,可以正常发光,从而实现小分子对eGFP 蛋白功能的调控。由于内含肽的剪接会残留一个半胱氨酸残基,因此选取半胱氨酸以及与半胱氨酸结构相似的丙氨酸、丝氨酸和苏氨酸。在eGFP 蛋白上选取C49、C71、S87、R109、A111、S148、T231 共7个位点插入内含肽。所选取的位点在eGFP 基因组中的位置以及在eGFP 结构上的位置参见图1。在选取的位点处通过反向PCR 对质粒进行线性化,与PCR 得到的内含肽片段进行同源重组,测序分析后,获得序列正确的7 个pMD-eGFP-Intein 质粒。
2.2 内含肽对eGFP 蛋白的调控
293 T 细胞分别转染7 个不同位点嵌入内含肽的重组eGFP 质粒36 h 后,未添加4-HT 的对照组均未检测到显著的绿色荧光,说明内含肽的插入影响了eGFP 的正常结构,导致无法激发绿色荧光。在7 个添加了4-HT 的试验组中,S87、S148、R109 组可见显著的荧光恢复(图2)。在这3 组中,S148 位点插入的eGFP 重组质粒转染后荧光恢复强度最高,S87 次之,R109 最低。其中,R109是文献中已报道的内含肽调节eGFP 发光的剪接位点[7],能够观测到荧光的部分恢复,但恢复效率不高,其他插入位点在荧光显微镜下未见荧光。
转染36 h 后收集细胞,采用流式细胞术定量检测细胞中eGFP 的荧光强度。结果显示(图3),A111、S148、S87、C71、R109 组添加4-HT 后,荧光强度强于未添加4-HT 的对照组,具有统计学差异(P<0.05)。其中S87、S148、R109 组的荧光强度显著强于对照组(P<0.01),这3 组相较于阳性对照,加入4-HT 后荧光强度恢复率分别为31%、9%和5%(图3),S148 组荧光恢复率最高,而R109 组的荧光恢复率较低,这与荧光观测结果相吻合。未加4-HT 的对照组,荧光强度仅为阳性对照组的6%、3%和2%。同时也发现,剪接效率较高的位点,如S87、S148,其本底值(未添加4-HT 的对照组的荧光强度)也会略高。通过比较有/无4-HT 的荧光比值,可以看出S148、S87 的剪切效率分别为R109 的8 倍和2 倍。

图1 pMD-eGFP-Intein 的构建
2.3 4-HT 最适浓度的探究
选择剪接效率最高的S148 位点进行实验,探究该位点对应的4-HT 最适浓度。将12 孔板中4-HT 的浓度从16 μmol/L 梯度稀释至2-15μmol/L,在质粒转染细胞36 h 后流式检测荧光强度,发现S148 位点的内含肽剪接效率是高度剂量依赖的,浓度低于4 μmol/L 时,剪接效率与4-HT 的浓度正相关,最适浓度定为4 μmol/L(图4)。
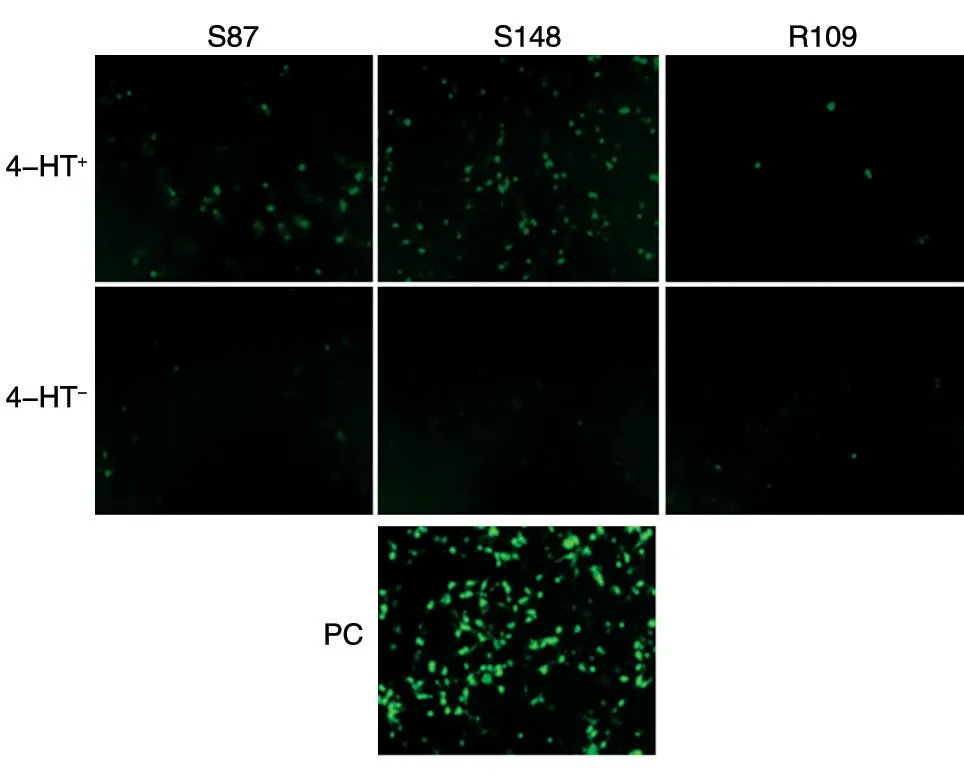
图2 4-HT 调控eGFP 荧光检测结果
3 讨论
小分子依赖的内含肽调控系统是一类非常有吸引力的分子开关,原则上它们可以插入感兴趣的任意蛋白质中,使得蛋白质功能依赖于小分子的激活。与转录和翻译过程的条件控制相比,内含子剪接过程非常快速,因此,在通过激活转录或翻译不能实现的时间尺度上添加小分子效应物后,可以激活积累的预裂蛋白。此外,与更常见的配体诱导转录行为相比,这种翻译后激活取决于添加的小分子的浓度。因此,小分子激活的内含肽技术兼具小分子化学遗传方法的目标特异性与经典遗传学方法的通用普遍性特点。将进化的内含肽蛋白插入活细胞中的多种不相关蛋白质中,证实蛋白质功能的配体依赖性激活是普遍的、迅速的、剂量依赖性的和翻译后修饰的。该过程不需要特定的细胞环境以及辅助因子的参与,甚至可以在体外进行。内含肽因其独特的剪接功能,在蛋白质工程、基因诊断和治疗、转基因植物研究等领域有着广阔的应用前景。

图3 流式细胞术检测荧光强度
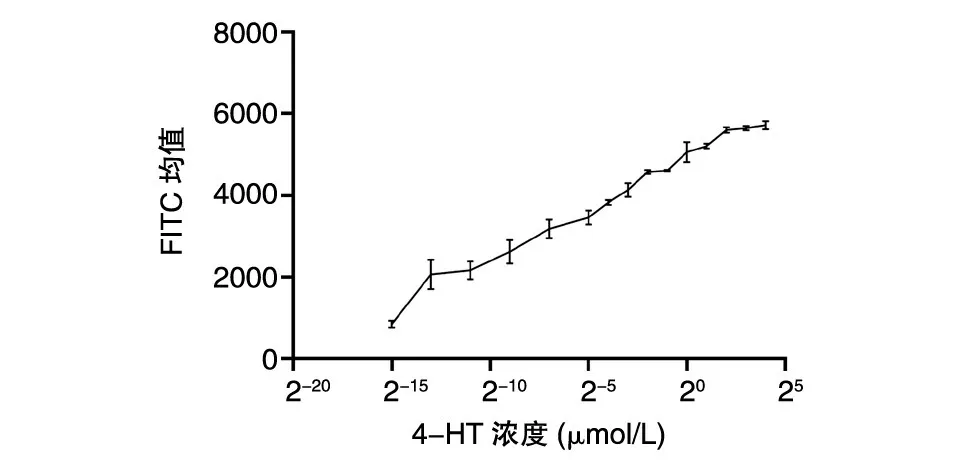
图4 4-HT 浓度对剪接效率的影响
针对内含肽剪接的特点与eGFP 的结构与功能,利用同源重组的方法,我们将小分子调控的内含肽基因分别嵌入eGFP 蛋白中7 个可能的氨基酸位点,得到7 种pMD-eGFP-Intein 重组质粒。在所选取的7 个氨基酸位点中,包括文献报道的R109 在内的3 个插入位点能够实现小分子对eGFP 蛋白功能的调控,新发现的2 个插入位点S87 与S148 的剪接效率分别为9%和31%,远高于文献报道的剪接位点R109(剪接效率5%)。同时我们也发现,在剪接效率较高的位点,本底值相应也略高,这可能是由于在高效率剪接的位点上除了内含肽上受体结合域与4-HT 的碰撞几率更高之外,内含肽自身的N 端与C 端结构域也比较靠近,自剪接的发生概率也会更高一点。
在S148 位点上,探究了4-HT 的最适浓度。发现4-HT 浓度在4 μmol/L 以下时,剪接效率与4-HT 浓度呈正相关,而当4-HT 浓度达到4 μmol/L 时,剪接效率不再增加,这说明在S148 位点上,4-HT 的最适浓度约为4 μmol/L,与文献报道的R109 位点的最适工作浓度为1 μmol/L 存在差异,说明在所选取的不同调控位点上,4-HT 的最适浓度存在差异。由于差异不是很大,所以如果探究内含肽对于其他蛋白的调控,可以先选取1 μmol/L 寻找内含肽的替换位点,然后在调控效果较好的位点上摸索4-HT 工作浓度。
本实验验证了小分子依赖的内含肽剪接技术在eGFP 蛋白上应用的可行性,相较于文献报道的位点得到了剪接效率更高的位点,并摸索了在相应位点上的小分子工作浓度,为后续这项剪接技术的应用打下了良好基础。
