尼帕病毒融合蛋白的真核表达及其特异性血清的制备
2019-12-25刘渝娇李耀辉张冠英范鹏飞迟象阳房婷刘树玲陈旖宋小红于长明
刘渝娇,李耀辉,张冠英,范鹏飞,迟象阳,房婷,刘树玲,陈旖,宋小红,于长明
军事科学院军事医学研究院生物工程研究所,北京100071
尼帕病毒(Nipah virus,NiV)属于副黏病毒科 (Paramyxoviridae)亨尼帕病毒属(Henipavirus),为单股负链RNA病毒,其自然宿主为果蝠,可感染猪、马等哺乳动物以及人类,能够引起严重的神经系统性疾病和呼吸系统性疾病等[1]。尼帕病毒最早出现于1998 年9 月,该次疫情持续至1999 年4 月,最终造成马来西亚霹雳州256 人感染,105人死亡,另有116 万头猪死亡,并蔓延至新加坡一屠宰场,造成11 名工人感染、1 人死亡[2-3]。1999年10 月,研究人员从一名患者脑脊髓液中分离出病毒[2]。不久之后,又从马来西亚果蝠尿液中分离出尼帕病毒,确定了尼帕病毒的自然宿主[3]。随后,在印度、柬埔寨、泰国等国家都曾报道过尼帕疫情,近年来,尼帕病毒感染疫情多次在孟加拉国和印度发生,已造成数百人死亡,死亡率为50%~100%[4]。
NiV 基因组共编码6 个结构蛋白(N,P,M,F,G,L),有黏附蛋白(G)和融合蛋白(F)2 个包膜糖蛋白。其中G 蛋白是以四聚体形式存在的Ⅱ型跨膜蛋白,胞外域包括一个茎状区以及含受体结合区域的头部区;而F 蛋白为Ⅰ型跨膜蛋白,包含546 个氨基酸残基,相对分子质量约67×103,包括2 段七肽重复序列(heptad repeat,HR)和疏水性融合多肽(fusion peptide,Fp)[5],其基因位于病毒基因组6370~8706 nt[6]。在F 蛋白合成过程中,首先合成为不具备活性的前体蛋白F0,F0运输至细胞膜表面后,通过内吞作用回到细胞内部[7-8],然后在酸性核内体中被组织蛋白酶L 或B 分解[9-10],形成F1(C 端)和F2(N 端)2 个有活性的蛋白,F1和F2通过二硫键连接形成有融合功能的融合蛋白,最终在膜表面以三聚体形式存在[11]。尼帕病毒入侵宿主细胞时,通过G 蛋白识别并结合宿主细胞膜表面受体Ephrin B2 和Ephrin B3[12-13],这一过程会激发F 蛋白发生显著的构象重排[14],从一个亚稳定状态重新折叠成为较低的能量状态,从而促进Fp 暴露并插入宿主细胞膜[15]。因此,含有受体结合区的G 蛋白与含有融合肽的F 蛋白经常被作为尼帕病毒结构、入侵机制等研究的主要对象,以及疫苗研制和抗体筛选的重要靶标。
鉴于F 蛋白在病毒入侵过程中扮演着极为重要的角色,表达纯化获得接近天然构象及生物化学性质的F 蛋白以及制备其特异性血清,对于尼帕病毒的疫苗研究、中和抗体的筛选及相关机制探讨至关重要。因此,我们构建了F 蛋白的真核表达质粒,在哺乳动物细胞中表达获得了可溶性F 蛋白(sF),并且验证了纯化得到的蛋白以三聚体的形式存在,且能在体外被胰蛋白酶消化分解为F1和F2蛋白。以该蛋白免疫小鼠,获得了针对尼帕病毒F 蛋白的特异性血清。本研究为后续开展尼帕病毒的蛋白结构、入侵机制、疫苗及中和抗体等相关研究奠定了基础。
1 材料和方法
1.1 材料
4~6 周雌性BALB/c 小鼠购自北京维通利华实验动物技术有限公司;Expi293F 细胞、尼帕病毒G蛋白、抗埃博拉病毒GP 蛋白单克隆抗体由本实验室保存;限制性内切酶XbaⅠ、AgeⅠ,胰蛋白酶购自NEB 公司;去内毒素大提试剂盒购自天根生化有限公司;Expi293 细胞培养基及转染试剂购自ThermoFisher 公司;Strep Trap HP 预装柱购自GE Healthcare 公司;Western 化学发光显色液、30k 15 mL 超滤管购自Millipore 公司;蛋白酶抑制剂购自Promega 公司;山羊抗鼠IgG 二抗(HRP)购自Abcam 公司;抗Strep(HRP)抗体购自Merck Millipore 公司;TMB 单组分显色液、ELISA 终止液购自索莱宝有限公司。
1.2 表达质粒构建
尼帕病毒融合蛋白F 基因(GenBank:NC_002728.1)删除跨膜区和细胞质尾区,仅保留胞外域基因,C 端加上Strep 标签,序列设计完成后由金斯瑞有限公司进行密码子优化并合成,酶切位点为XbaⅠ和AgeⅠ,连接至表达载体pcDNA3.4,得到表达质粒pcDNA-sF。将菌液送至生工生物工程有限公司测序,序列比对确认无误后,振荡培养提质粒pcDNA-sF,在37℃经XbaⅠ/AgeⅠ双酶切1 h 后核酸电泳鉴定。
1.3 融合蛋白F 在哺乳动物细胞中的表达
转染前1 d,接种2×106细胞到30 mL Expi293 表达培养基中,在5% CO2、37℃、120 r/min条件下悬浮培养;转染当天,检测细胞密度达3×106/mL 时,取 80 μL ExpiFectamine293 转染试剂加入1.5 mL MEM 培养基中,取30 μg 表达载体pcDNA-sF 加入1.5 mL MEM 培养基中,分别混匀,室温孵育5 min 后将二者混合,室温孵育25 min 后加入细胞培养瓶中。转染12 h 后,加入150 μL 转染增强剂1 和1.5 mL 转染增强剂2;继续培养84 h,将细胞培养物800 r/min 离心15 min 后再以3000 r/min 离心15 min,收集上清。
1.4 Strep Trap 柱亲和层析纯化蛋白
用0.45 μm 滤膜过滤收集的细胞表达上清,Strep Trap 亲和柱用0.5 mol/L NaOH 再生后,用平衡缓冲液(100 mmol/L Tris-HCl,150 mmol/L NaCl,1 mmol/L EDTA·2Na)平衡后上样,上样结束后再平衡,然后用洗脱液(1 L 平衡液,2.5 mmol/L 脱硫生物素)洗脱,收集洗脱峰。用30k 超滤管对洗脱峰进行超滤浓缩,同时用PBS 溶液进行换液。
1.5 Western 印迹检测蛋白表达及血清特异性
取纯化后的样品,加入含DTT 的4×SDS 上样缓冲液,煮沸10 min,电泳结束后用金斯瑞转膜仪电转移蛋白到PVDF 膜上;转膜后用5%的脱脂奶粉室温封闭1 h,加入抗Strep(HRP)抗体(1∶5000)或免疫小鼠血清(1∶2500)室温孵育1 h;用TBST 洗膜后加入羊抗鼠IgG 二抗(HRP)室温孵育1 h;洗膜后滴加化学发光试剂,在化学发光成像系统中曝光。
1.6 F 蛋白的体外酶解实验
在反应体系中加入1 μg 纯化的sF 蛋白、100 ng 胰蛋白酶,用1×缓冲液补至总体积为10 μL,4℃孵育过夜;次日加入1 μL 10×蛋白酶抑制剂终止反应,取10 μL 消化产物加入4×SDS 上样缓冲液,煮沸10 min,通过Western 印迹分析消化产物成分,一抗为抗Strep(HRP)抗体(1∶5000稀释)。
1.7 HPLC 分析条件
HPLC 分析仪为Waters 2695-2487,凝胶色谱柱为TSKgel G3000SWXL;标准液、样品液上样量均为30 μL,流速1 μL/min,上样时间30 min,柱温25℃,流动相为PBS 缓冲液。
1.8 小鼠免疫
将纯化得到的F 蛋白与弗氏佐剂均匀混合,在每只小鼠腹股沟皮下多点注射20 μg(共6只),在第0、14 和28 d 分别免疫,共免疫3 次;第42 d 时取小鼠尾静脉血,常温静置4 h 后8000 r/min 离心10 min,收集上清。
1.9 ELISA 检测抗血清的特异性结合活性
以1 μg/mL 的浓度包被纯化的sF 蛋白,4℃孵育过夜;用PBST 洗板4 次后用ELISA 封闭液于37℃封闭1 h;再次洗板后首孔加入150 μL 稀释比为1∶100 的小鼠血清,其余孔加入100 μL 稀释液,1∶3 稀释,37℃孵育1 h;洗涤后加入1∶10 000的山羊抗鼠IgG 二抗(HRP),37℃孵育1 h;洗涤后每孔加入100 μL TMB 单组分显色液显色6 min,每孔加入50 μL 终止液终止显色,读取D450nm/D630nm值。
2 结果
2.1 F 蛋白表达质粒的鉴定
pcDNA-sF 质粒设计及鉴定结果见图1。表达质粒pcDNA-sF 经XbaⅠ/AgeⅠ双酶切后得到约6000 bp 的pcDNA3.4 载体条带和约1600 bp 的目的基因条带,说明质粒pcDNA-sF 表达质粒含有目的基因。基因测序结果与原序列一致,没有碱基缺失与突变,表明得到了序列正确并成功克隆的表达质粒。
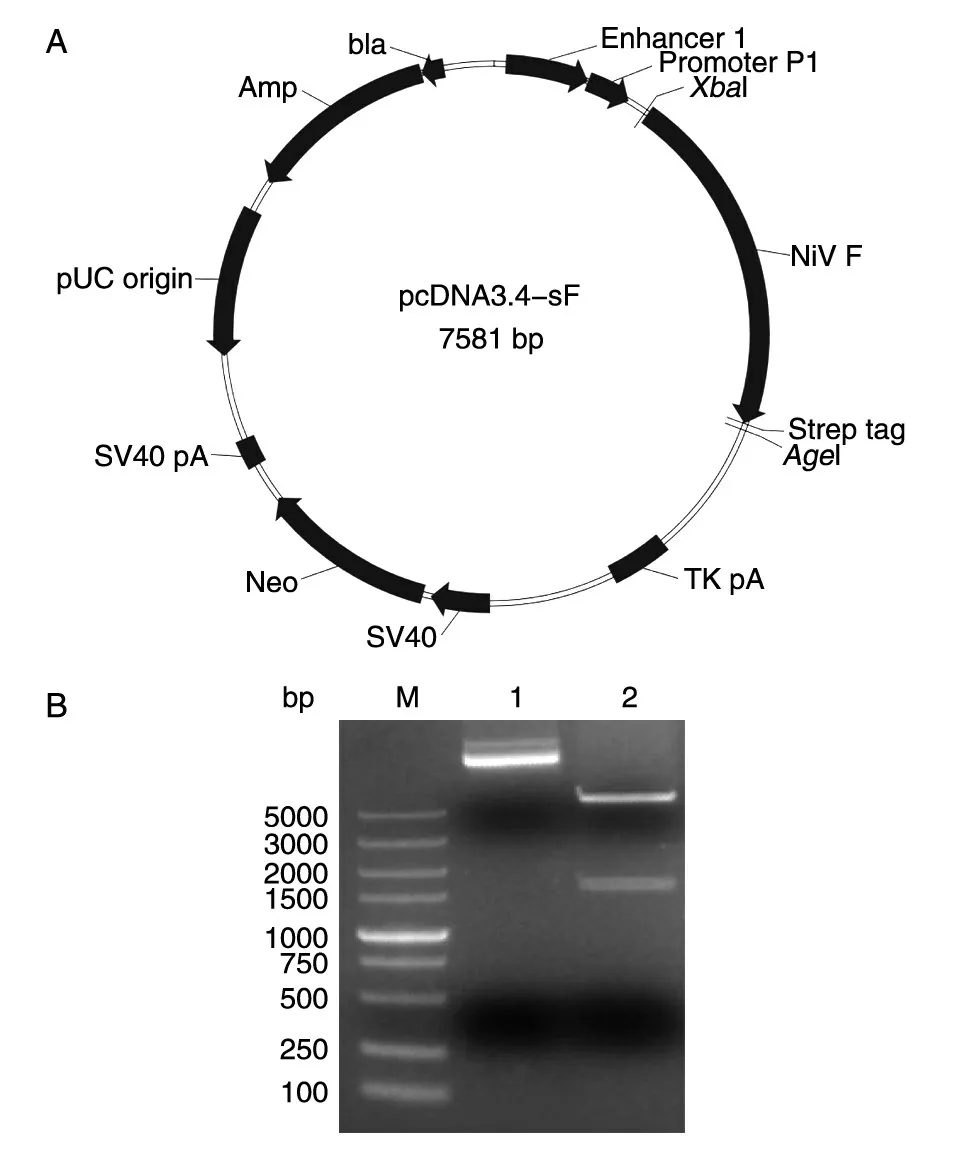
图1 重组质粒pcDNA-sF 的质粒图谱(A)及酶切鉴定(B)
2.2 融合蛋白F 的表达、纯化及鉴定
2.2.1 纯化产物的SDS-PAGE 鉴定 将浓缩换液后的蛋白进行SDS-PAGE 和Western 印迹分析(图2)。SDS-PAGE 结果显示所纯化蛋白相对分子质量约为70×103,稍大于F 蛋白胞外区相对分子质量的理论值61×103,推测是由于F 蛋白上含有5个N 糖基化位点(Asn64、Asn67、Asn99、Asn414、Asn464),使得蛋白质迁移速率减慢;并且结果显示所纯化的蛋白纯度在95%以上。用抗Strep 抗体进行Western 印迹,结果与SDS-PAGE 结果一致,表明表达蛋白含有Strep 标签,说明纯化的蛋白为本研究所设计的蛋白。
2.2.2 胰蛋白酶切鉴定 在sF 蛋白的体外酶解实验中,经胰蛋白酶消化后的sF 蛋白经SDSPAGE 分析分离出2 条大小不一的条带(图3A),与文献报道的F0蛋白经胰蛋白酶消化形成F1和F2蛋白的理论相对分子质量(分别为51×103和19×103)基本一致。进一步用抗Strep 抗体进行Western 印迹,在70×103、51×103左右有明显条带,应为含有Strep 标签的F 蛋白和位于F 蛋白C 端的F1(图3B)。
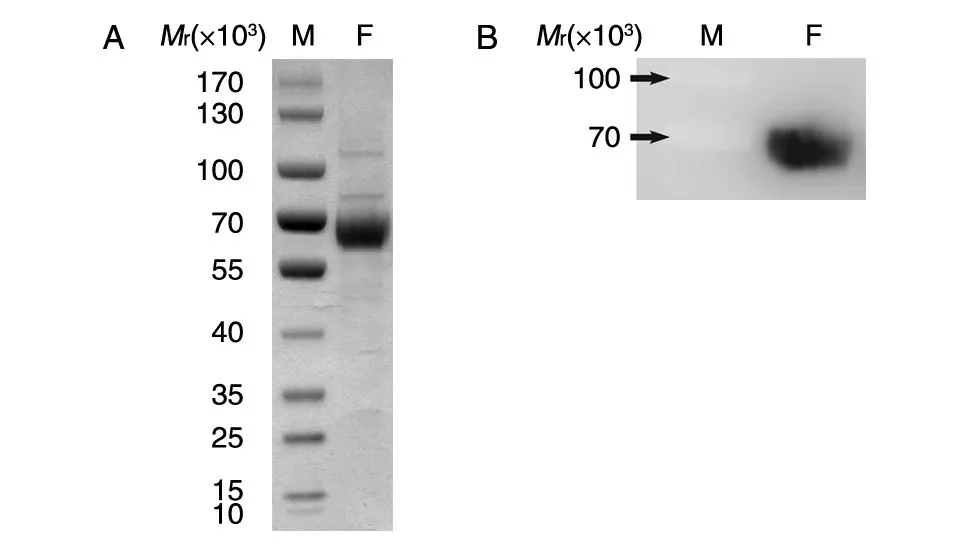
图2 纯化产物的SDS-PAGE 分析(A)与Western 印迹鉴定(B)
图3 sF 蛋白酶解产物的SDS-PAGE(A)与Western 印迹(B)
2.2.3 HPLC 分析 以已知相对分子质量的尼帕病毒G 蛋白(四聚体,约240×103)、抗埃博拉病毒GP 蛋白单克隆抗体(150×103)为对照,HPLC 分析结果显示本实验表达纯化的F 蛋白保留时间(9.722 min)在G 蛋白(8.610 min)和单克隆抗体(11.094 min)之间,说明重组表达的F 蛋白相对分子质量介于150×103和240×103之间。而单体F蛋白胞外区的理论相对分子质量约61×103,提示本实验表达纯化的F 蛋白以三聚体(190×103)形式存在,其结合方式有待于进一步研究。
2.3 融合蛋白F 的特异性血清验证及其结合活性检测
取小鼠血清,通过Western 印迹验证血清对F蛋白的特异性识别能力(图5A),对照抗原为尼帕病毒G 蛋白。结果显示在F 蛋白泳道上有一条相对分子质量约70×103的条带,而对照抗原处没有条带,表明所制备的鼠抗血清能特异性识别尼帕病毒sF 蛋白。通过ELISA 测定小鼠血清中抗F 蛋白的抗体滴度(图5B),结果显示小鼠血清中抗F抗体的滴度在104以上,表明重组表达的sF 有效地激发了小鼠体液免疫反应,制备的血清结合活性良好,可用于后续研究。
图4 HPLC 分析sF 蛋白的相对分子质量
图5 鼠抗F 蛋白特异血清与F 蛋白的特异性结合(A)及其抗体滴度检测(B)
3 讨论
NiV 是一种烈性病原体,对病原的操作必须在生物安全4 级实验室进行,目前尚无获批的疫苗或抗体治疗药物[4]。F 蛋白在病毒入侵过程中至关重要,并且通过其构象重排促进病毒与宿主细胞的膜融合[11],而在免疫系统中体液免疫所产生的主要中和性抗体也依赖于F 蛋白的构象。有研究显示,大多数人源呼吸道合胞病毒(RSV)中和抗体都识别融合前状态也就是未发生构象改变的F 蛋白[16];Stewart-Jones 等的研究证明稳定地处于融合前状态的F 蛋白在小鼠和恒河猴体内能更好地激发体液免疫反应[17]。因此在关于F 蛋白的大多数研究中,都是以前体蛋白F0为主要研究对象,例如Chan 等制备了尼帕病毒可溶性的以三聚体形式存在的F0蛋白,并鉴定了其生物化学性质、构象及免疫原性都接近于天然F 蛋白[18];Dang等则以F0为免疫原免疫小鼠后筛选得到具备广谱中和活性的抗F 蛋白的单克隆抗体,该单抗通过抑制F 蛋白的构象改变而发挥中和作用[4]。制备以三聚体形式存在的F 蛋白用于免疫动物筛选尼帕病毒中和性单抗也是本研究的目的之一。
在蛋白表达系统中,对比原核表达系统,哺乳动物细胞能够准确地完成糖基化、磷酸化及蛋白水解等多种翻译后加工功能,因而表达产物在分子结构、理化特性和生物学功能等方面更接近天然蛋白[19]。而分泌表达相较于胞质内表达,经历了蛋白翻译后加工的整个过程,具有简化蛋白产物的检测与纯化、降低生物处理工艺的复杂性、提高蛋白产物的产量与质量等优势[20]。
本研究在哺乳动物细胞中对NiV 融合蛋白F进行了重组表达,获得了可溶性F 蛋白。该蛋白在自然状态下以三聚体形式存在,与天然状态下F 蛋白的存在方式一致,且能在体外被胰蛋白酶消化分解为F1、F2蛋白,具有与天然F 蛋白相似的生物化学性质;将sF 蛋白免疫小鼠后获得了高效价的特异性血清。这些结果为NiV 入侵机制、疫苗设计、中和抗体筛选及作用机制等后续研究奠定了坚实的基础。
