通过突变甲醇脱氢酶启动子提高甲基营养菌吡咯喹啉醌产量
2019-12-25孙晓宇薄明井杨亚欣张惟材葛欣熊向华
孙晓宇,薄明井,杨亚欣,张惟材,葛欣,熊向华
1.河北大学生命科学学院,河北保定071000;
2.军事科学院军事医学研究院生物工程研究所,北京100071
甲基营养菌(Methylotrophs)是一类能利用甲醇作为惟一碳源和能源生长的革兰阴性细菌。本实验室前期通过对甲基营养菌MP688 多轮诱变筛选获得吡咯喹啉醌(pyrroloquinoline quinone,PQQ)高产菌株J1-1,其甲醇代谢由周质定位的甲醇脱氢酶(methanol dehydrogenase,MDH)负责,氧化生成的产物甲醛进入胞质经H4MPT、RuMP和FaDH-FDH 等途径进一步代谢,为菌体生长及PQQ 的合成提供构造元件和能量,也产生部分副产物,影响PQQ 产量[1]。前期研究发现,J1-1 的甲醇脱氢酶活性与PQQ 产量呈负相关,因而推测通过改造MDH 天然启动子(P0771),下调MDH 转录水平从而降低MDH 活性,有望提高PQQ 产量[2-3]。本研究我们通过P0771定点突变获得了7 个突变启动子,利用lacZ作为报告基因检测突变启动子对其转录水平的影响,筛选出2 个lacZ 酶活水平较天然启动子下降的突变启动子P0771-1、P0771-5 并导入J1-1 替换天然P0771启动子,得到的2 株突变菌株在增菌培养基中MDH 活性下降,PQQ 合成水平高于J1-1,且在生长稳定期(96 h)PQQ 合成水平较起始菌株J1-1 分别提高约9.76%和11.6%。
1 材料与方法
1.1 材料
甲基营养菌J1-1、质粒pCM66-lacZ、自杀质粒pGX 由本实验室保存;大肠杆菌DH5α、λ-pir感受态购自上海唯地生物技术有限公司;快速质粒小提试剂盒购自北京天根生化科技有限公司;限制性内切酶、琼脂糖凝胶DNA 回收纯化试剂盒购自Thermo 公司;DNA marker、2×Basic Assemble Mix 购自北京全式金生物技术有限公司;Mut ExpressⅡFast Mutagenesis Kit V2 试剂盒购自南京诺唯赞生物科技有限公司;PCR 引物(表1)合成及DNA 测序由北京擎科新业生物技术有限公司完成。
增菌培养基:MgSO4·7H2O 0.2 g/L,KH2PO41.4 g/L,(NH4)2SO43.0 g/L,Na2HPO43.0 g/L,CaCl230.0 mg/L,MnCl2·4H2O 5.0 mg/L,ZnSO4·7H2O 5.0 mg/L,CuSO4·5H2O 0.5 mg/L,柠檬酸铁30.0 mg/L。115℃灭菌30 min,使用时添加甲醇至10 mL/L。
1.2 分子生物学操作
突变启动子质粒构建根据Mut Express Ⅱ Fast Mutagenesis Kit V2 试剂盒说明书指导完成。

表1 PCR 引物及序列
1.3 检测突变体的β半乳糖苷酶活性[4]
将突变菌株按1%的接种量接种于5 mL 增菌液体培养基中,相同条件下培养2~3 d 至对数生长期(菌液D600nm为1.0),收取4 mL 菌液,12 000 r/min 离心10 min,弃上清;菌体重悬于500 μL TE 缓冲液(pH7.0),冰水浴超声2 min(超声3 s,间歇3 s)破碎菌体,4℃、12 000 r/min 离心10 min;取超声上清100 μL 于EP 管中,加入0.5 mL Z 缓冲液(60 mmol/L Na2HPO4,40 mmol/L NaH2PO4,10 mmol/L KCl,1 mmol/L MgSO4,50 mmol/L β巯基乙醇,pH7.0),30℃温育10 min;加入150 μL ONPG,30℃温育25 min,加入0.5 mL 1 mol/L Na2CO3溶液终止反应;测定反应液D420nm和D550nm值,按下式计算D600nm值酶单位:
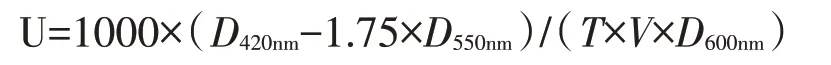
式中,T为反应时间(min),V为所用细胞破碎液体积(mL)。
1.4 甲醇脱氢酶酶活测定[5]
1.4.1 粗酶液的制备 将突变菌株按1%的接种量接种至100 mL 增菌液体培养基中,30℃、200 r/min 振荡培养,12 000 r/min 离心10 min 收集菌体,重悬于1 mL 100 mmol/L Tris-HCl(pH9.0)缓冲液中,冰水浴超声2 min(超声3 s,间歇3 s),4℃、12 000 r/min 离心10 min,上清液用于酶活性检测。
1.4.2 DCIP 法检测MDH 活性 1 mL 反应液包含100 mmol/L Tris-HCl(pH9.0)、15 mmol/L NH4Cl、10 mmol/L 甲醇、50 μmol/L DCIP、100 μL 粗酶液,最后加入0.33 mmol/L PMS 启动反应。根据反应液退色(绿色→黄色)时间可以快速判别样品中酶的活性,按下式计算MDH 的活性。1 个活性单位(U)定义为每分钟还原1 μmol DCIP 所需酶量,在D600nm处DCIP 的摩尔吸光系数ε 为1.9×104L/(mol·cm)。

式中,N为稀释率,V总为酶活测定反应体系的总体积(mL),ΔD600nm为T时间内反应液D600nm的增加值,V酶为反应添加酶液的体积(mL),T为反应时间(min),L为比色皿直径(cm)。
1.5 菌株生长及PQQ 合成水平鉴定
将待测菌接种于含有100 mL 培养基的250 mL 三角瓶中,30℃、200 r/min 振荡培养,每12 h检测一次菌密度和PQQ 产量[6],每组设3 个平行。
2 结果
2.1 P0771突变启动子构建
MP688 全基因组(CP002258)注释结果显示反向mpq_0770基因(编码TruB)和正向mpq_0771基因(编码MDH α亚基)的编码区间隔251 bp(图1),这一段序列我们确定为mpq_0771基因的启动子(P0771),用P0771-XbaⅠ-F 和P0771-BamHⅠ-R 引物对扩增P0771启动子,构建pCM66-P0771-lacZ质粒。前期研究及文献调研结果提示启动子5′端为其调控元件,因而选择启动子5′端25 bp 序列以每5个碱基为一组进行突变(A 与G 互换,T 与C 互换),依次命名为突变启动子P0771-1 至P0771-5。另将预测的P0771启动子-35 区第3 个碱基G 替换成A(P0771-6),第4 个碱基T 替换成A(P0771-7)[7-9]。设计P0771启动子突变引物,利用定点突变试剂盒对pCM66-P0771-lacZ质粒进行定点突变,经测序验证最终获得7 个P0771启动子突变质粒(图2)。
2.2 P0771突变启动子转录水平测定
将pCM66-P0771-lacZ质粒及7 个启动子突变质粒分别电转至J1-1,通过β半乳糖苷酶活测定来分析突变启动子活性。结果如图3 所示,不同的突变位点对P0771启动子活性均有一定的影响,其中P0771-1、P0771-5 突变启动子的活性较天然启动子下降,通过SPSS 软件进行统计学分析,结果显示差异具有显著性(P<0.05,P<0.01)。
2.3 P0771启动子重组质粒的构建
构建含庆大霉素(Gm)筛选抗性和P0771启动子基因的自杀质粒,利用同源重组替换染色体上的P0771启动子,获得重组菌株。mpq_0770基因和mpq_0771基因间隔区长251 bp,且转录方向相反,经启动子软件(SoftBerry)分析发现,正向的P0771启动子和反向的P0770启动子相互重叠(图4)。为防止P0771启动子突变对mpq_0770基因转录产生影响,设计将P0770启动子通过Gm基因和P0771启动子分隔,并将Gm基因作为筛选标记,选取P0770启动子上游1500 bp 作为Up 同源臂,P0771启动子下游1500 bp 作为Down 同源臂,如图5 所示。依此构建自杀型pGX-Up-P0770-Gm-P0771-Down 重组质粒,电转至J1-1,利用同源重组置换天然启动子,得到重组菌株,测序证明基因已成功替换(测序结果略),考察生长及PQQ 产量与起始菌株J1-1 无显著差异(图6、7),说明P0770-Gm-P0771双启动子的置换对菌株生长及PQQ 合成没有影响,为后续P0771突变启动子的替换奠定了基础。
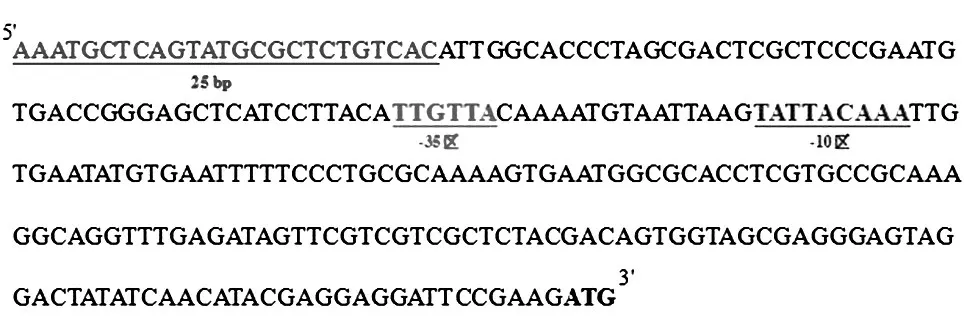
图1 P0771启动子

图2 P0771突变启动子测序鉴定
2.4 P0771启动子突变菌株的MDH 活性、菌体生长及PQQ 合成水平鉴定
将自杀型pGX-Up-P0770-Gm-P0771-Down 重组质粒中的P0771启动子与突变启动子P0771-1 和P0771-5 替换后电转至J1-1,利用同源重组法进行基因替换,分别获得P0771-1/J1-1 和P0771-5/J1-1 突变菌株。在增菌培养基中培养,稳定期(96 h)2 株突变菌株的MDH 活性均明显低于起始菌株J1-1(图8),提示P0771突变启动子通过下调mpq_0771基因转录降低了MDH 活性。如图9 所示,24 h 时2 株突变菌株生长速率均显著高于起始菌株J1-1,到稳定期后三者菌密度无显著差异。在生长过程中2 株突变菌株的PQQ 合成水平均高于起始菌株J1-1,到96 h 时突变菌株P0771-1/J1-1 和P0771-5/J1-1 的PQQ 产量分别为29.36、29.85 mg/mL,与起始菌株J1-1(26.75 mg/mL)相比,分别提高9.76%、11.6%(图10)。
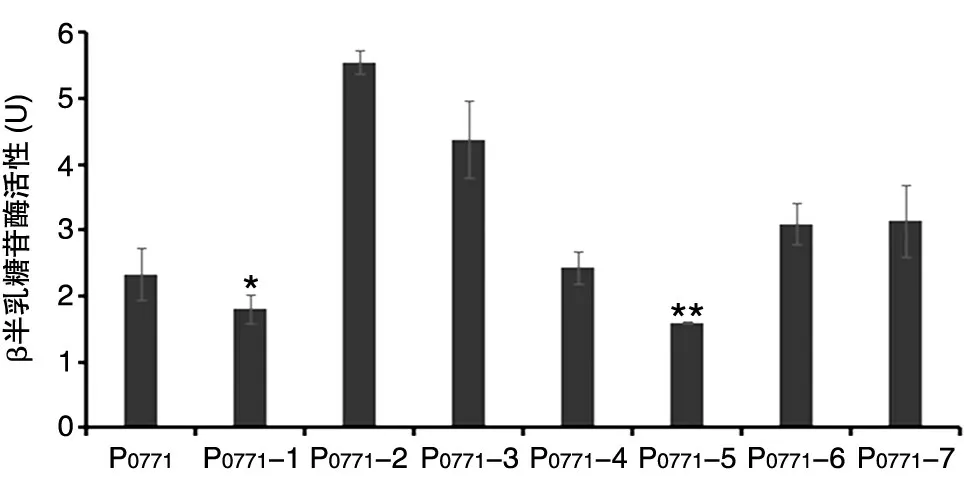
图3 启动子突变株的β半乳糖苷酶活性

图4 P0770和P0771启动子预测

图6 重组菌株在增菌培养基中的生长曲线
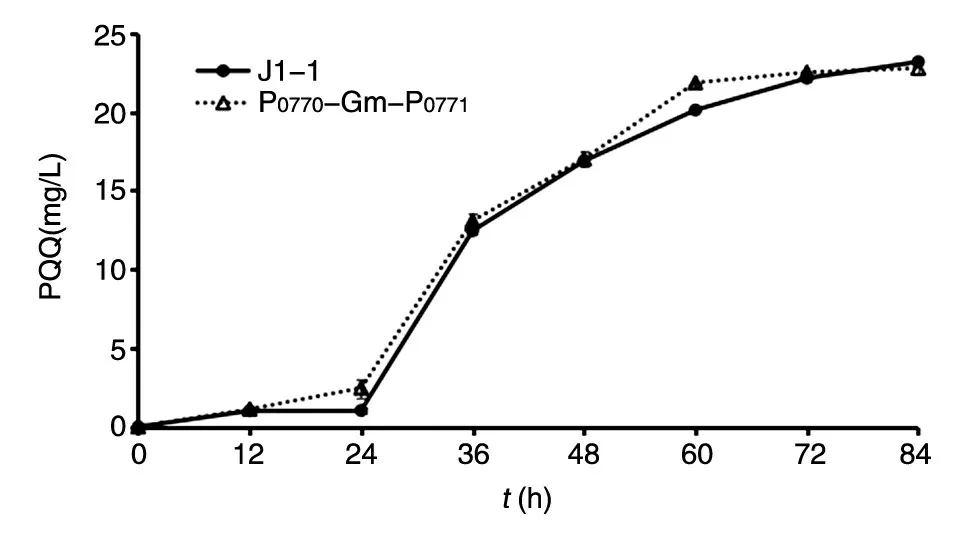
图7 重组菌株在增菌培养基中的PQQ 合成水平
3 讨论
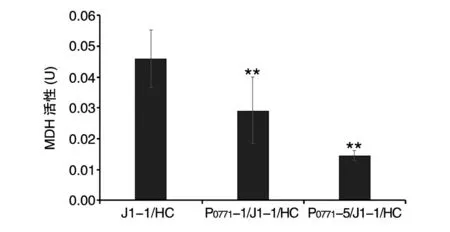
图8 突变菌株的MDH 活性(增菌培养基,96 h)

图9 突变菌株在增菌培养基中的生长曲线

图10 突变菌株在增菌培养基中的PQQ 合成水平
迄今发现,在自然界能够合成PQQ 的生物只有某些革兰阴性细菌,而甲基营养菌是PQQ 合成水平最高的菌属[10-13]。甲基营养菌J1-1 是本研究团队从土壤中分离得到的PQQ 高产菌。甲醇初级氧化生成甲醛作为甲醇代谢途径的第一步,在甲基营养菌J1-1 的分解代谢中至关重要,也是甲醇代谢调控的重要靶点[14-15]。本实验室前期将J1-1 染色体上的MDH 基因mpq_0771敲除,发现敲除菌在甲醇为碳源的培养基中不能生长。前期研究同时还发现J1-1 中MDH 活性与PQQ 合成水平呈负相关,因而进一步推测通过降低MDH 启动子转录活性,可以提高PQQ 的产量。本研究中我们通过对P0771启动子的突变、筛选、鉴定,最终获得2 株较天然启动子转录水平下降的启动子突变菌株P0771-1/J1-1 和P0771-5/J1-1;与J1-1 相比,突变菌株在增菌培养基中MDH 活性均显著低于起始菌株J1-1,且在生长稳定期(96 h)PQQ 合成水平分别提高了约9.76%、11.6%,证明通过降低MDH 基因的转录水平可以有效提高J1-1 的PQQ产量。
