非小细胞肺癌PHLPP的表达与顺铂化疗预后的关系
2019-12-17陈美芳林玲徐有祖吕冬青周超郑海红
陈美芳 林玲 徐有祖 吕冬青 周超 郑海红


[摘要] 目的 观察PHLPP的表达与顺铂化疗预后的关系。 方法 收集2015年3月~2017年3月86例經病理确诊的Ⅳ期非小细胞肺癌患者,PHLPP、P-Akt、P-ERK的表达用免疫组化的方法评估,分析PHLPP的表达与临床病理特征以及顺铂化疗预后的关系。 结果 PHLPP的表达在P-Akt阴性组与阳性组之间差异有统计学意义(P<0.05),在P-ERK阴性组与阳性组之间差异有统计学意义(P<0.05);PHLPP的表达水平与P-Akt、P-ERK的表达呈负相关。单因素分析发现PFS与P-Akt、P-ERK的表达呈负相关,PFS与PHLPP的表达呈正相关,多因素分析发现PHLPP(OR值63.673,95%CI:14.858~272.865,P<0.001)、P-Akt(OR值1.912,95%CI:1.363~4.396,P=0.032)、P-ERK(OR值3.347,95%CI:1.810~6.186,P<0.001)是PFS的独立预测因子。 结论 PHLPP可能通过负向调节Akt及ERK通道调控顺铂化疗预后。
[关键词] 非小细胞肺癌;PHLPP;顺铂;化疗预后
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-9701(2019)29-0032-05
Relationship between expression of PHLPP and prognosis of cisplatin chemotherapy in non-small cell lung cancer
CHEN Meifang1 LIN Ling1 XU Youzu1 LV Dongqing1 ZHOU Chao2 ZHENG Haihong3
1.Department of Respiratory Medicine, the Affiliated Taizhou Hospital of Wenzhou Medical University, Linhai 317000, China; 2.Department of Radiotherapy, the Affiliated Taizhou Hospital of Wenzhou Medical University, Linhai 317000, China; 3.Department of Pathology, the Affiliated Taizhou Hospital of Wenzhou Medical University, Linhai 317000, China
[Abstract] Objective To observe the relationship between the expression of PHLPP and the prognosis of cisplatin chemotherapy. Methods A total of 86 patients with stage Ⅳ non-small cell lung cancer diagnosed by pathology were collected from March 2015 to March 2017. Expression of PHLPP, P-Akt, and P-ERK was assessed by immunohistochemistry. The relationship between the expression of PHLPP and clinicopathological features and the prognosis of cisplatin chemotherapy was analyzed. Results The expression of PHLPP was statistically significantly different between the P-Akt negative group and the positive group(P<0.05). There was a statistically significant difference between the P-ERK negative group and the positive group (P<0.05); the expression level of PHLPP was negatively correlated with the expression of P-Akt and P-ERK. Univariate analysis found that PFS was negatively correlated with the expression of P-Akt and P-ERK. PFS was positively correlated with the expression of PHLPP. Multivariate analysis found that PHLPP (OR value: 63.673, 95%CI: 14.858-272.865, P<0.001), P-Akt (OR value: 1.912, 95%CI: 1.363-4.396, P=0.032), and P-ERK (OR value: 3.347, 95%CI: 1.810-6.186, P<0.001) were independent predictive factors of PFS. Conclusion PHLPP may regulate the prognosis of cisplatin chemotherapy by negatively regulating Akt and ERK channels.
[Key words] Non-small cell lung cancer; PHLPP; Cisplatin; Chemotherapy prognosis
肺癌是世界范圍内最常见的恶性肿瘤之一,其发病率及死亡率呈明显增高趋势,其中非小细胞肺癌(no small cell lung cancer,NSCLC)占所有肺癌的80%[1],多数患者确诊时已处于晚期且预后差[2]。以铂类为基础的化疗是晚期NSCLC的主要治疗手段,然而晚期NSCLC的5年总生存率仍未超过16%[3],对以铂类为基础的化疗药物产生耐药是导致晚期NSCLC患者治疗失败的主要原因。
PH结构域富含亮氨酸重复序列的蛋白磷酸酶(PH domainleucine-rich repeats protein phosphatase,PHLPP)是一个新的丝氨酸/苏氨酸蛋白磷酸酶,具有促进细胞凋亡的作用,已证实其为肿瘤抑制基因的角色[4]。PHLPP能负向调节蛋白激酶B(protin kinase,Akt)及细胞外调节蛋白激酶(extracellular regulated protin kinase,ERK)信号通道,从而抑制肿瘤的增殖、分化,促进肿瘤细胞的死亡[4-5],国内学者体外细胞实验发现,顺铂的治疗能激活Akt及ERK通道而产生耐药[6],从而提示PHLPP可能通过调节Akt和ERK水平调控NSCLC对顺铂化疗的预后。本研究目的在于探索PHLPP在非小细胞肺癌中的表达与顺铂化疗预后的关系。现报道如下。
1 资料与方法
1.1一般资料
收集2015年3月~2017年3月我院病理组织库采集的86例肺癌病例支气管镜活检标本,所有患者ECOG评分0或1分、有足够的基线器官功能、白细胞计数>4×109/L(中性粒细胞绝对值>2×109/L,血小板计数>100×109/L,正常的肝功能,血清肌酐水平<1.4 mg/dL)、无其他严重并发症。患者分期根据AJCC的TNM分期系统(第7版,2009)。所有病例均首次接受含顺铂药物化疗,化疗前均未接受放疗且除外并发感染,包括鳞癌48例,腺癌38例,均属于Ⅳ期患者。男56例,女30例,年龄41~71岁,中位年龄60岁。
1.2 试剂和仪器试剂
PHLPP抗体(abcam公司,编号ab89833),P-AKT抗体(arigo公司,编号ARG56418),P-ERK1/2抗体(arigo公司,编号ARG10568)。主要仪器:低温离心机、组织均浆器、分光光度计、酶标仪、Leica切片机、全自动放免γ计数仪器、Leica显微镜。
1.3 方法
每份标本均用4%多聚甲醛固定,石蜡固定包埋。免疫组化测定采用PowerVision二步法,按试剂盒说明书进行:(1)取石蜡切片烤片后,脱蜡、脱水后;(2)0.3%H2O2,室温15 min(避光),封闭内源性过氧化物酶;(3)切片置入0.01 M(10 mM)柠檬酸缓冲液(pH 6.0)微波修复法修复抗原;(4)正常山羊血清处理,37℃,10~15 min;(5)滴加第一抗体(PHLPP、P-AKT及P-ERK等),放置湿盒内37℃孵育2 h;(6)PBS洗涤后,滴加二抗(GTVision+/HRP),37℃,30 min;(7)PBS洗涤5 min,滴加预备好的显色剂DAB工作液,即于光镜下控制显色。显色完全后,置于蒸馏水中终止显色;(8)流水冲洗,苏木素复染,蓝化;(9)脱水,二甲苯透明,中性树胶封固,显微镜观察。结合细胞阳性着色程度及阳性细胞比率分析各样本的目的蛋白表达水平。
1.4 观察指标
记录每位患者从开始化疗到出现疾病进展的时间,称为无进展生存期(progression-free survival,PFS)。观察各组PHLPP的表达情况;PHLPP表达与非小细胞肺癌临床病理特征的关系;PFS与非小细胞肺癌临床病理特征关系的单因素分析;PFS与非小细胞肺癌临床病理特征关系的多因素分析;PFS曲线的结果分析。
1.5 免疫组化结果
判断标准由一名高年资病理科主任医师与一名高年资病理科主治医师双盲法统计染色结果,主要定位于胞浆内。根据癌巢及正常组织中,计数阳性癌细胞占总癌细胞数的百分比,阳性细胞≥25%为阳性,<25%为阴性。
1.6 统计学分析
采用SPSS22.0统计学软件进行数据分析,计数资料以[n(%)]表示,采用χ2检验。单因素分析采用Log-rank分析,多因素分析采用COX回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 PHLPP的表达情况
在非小细胞肺癌组织中高表达、低表达以及P-Akt阳性、P-ERK阳性的免疫组化图像,见封三图3。计数阳性细胞占总癌细胞≥25%为阳性,<25%为阴性。
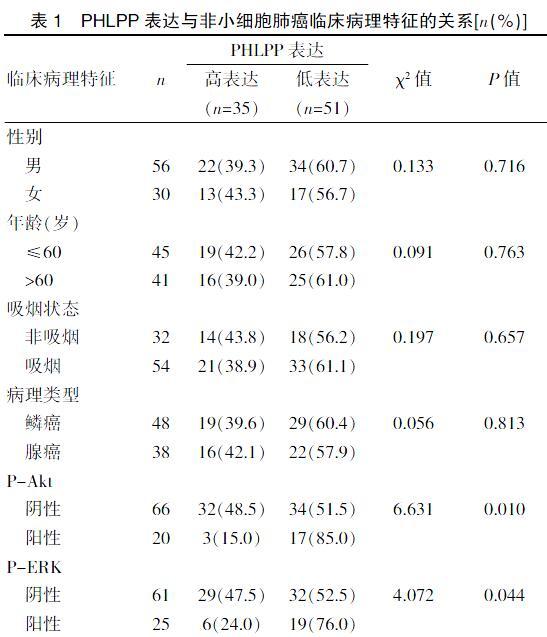
2.2 PHLPP表达与非小细胞肺癌临床病理特征的关系
本研究共对86例经病理证实的晚期NSCLC患者进行评价,男56例(65.12%),女30例(34.88%),中位年龄60岁,所有患者均给予顺铂药物化疗,记录每位患者的PFS。PHLPP、P-Akt、P-ERK在肺癌的表达是通过免疫组化方法进行评估的,对PHLPP的表达与肺癌临床病理特征的关系进行分析,见表1。结果显示PHLPP高表达(2~3分)35例(40.70%),低表达(0~1分)51例(59.30%),PHLPP表达水平在不同年龄、性别、病理类型、有无吸烟史组间比较差异无统计学意义(P>0.05),在P-Akt阴性组与阳性组之间差异有统计学意义(χ2=6.631,P=0.010),在P-ERK阴性组与阳性组之间差异有统计学意义(χ2=4.072,P=0.044),PHLPP的表达水平与P-Akt、P-ERK的表达呈正相关。
2.3 PFS与非小细胞肺癌临床病理特征关系的单因素分析
PFS在不同年龄、性别、病理类型、有无吸烟史组间比较差异无统计学意义(P>0.05)。PFS在P-Akt阴性组与阳性组之间比较差异有统计学意义(χ2=3.293,P=0.001),在P-ERK阴性组与阳性组之间比较差异有统计学意义(χ2=5.139,P<0.001),PFS与P-Akt、P-ERK的表达呈负相关;PFS在PHLPP高表达组与低表达组之间差异有统计学意义(χ2=13.976,P<0.001),且PHLPP表达与PFS呈正相关,见表2。
2.4 PFS与非小细胞肺癌临床病理特征的关系的多因素分析
对单因素分析中有统计学意义的危险因素进行COX回归分析发现,P-Akt:OR=1.912,95%CI:1.363~4.396,P=0.032;P-ERK:OR=3.347,95%CI:1.810~6.186,P<0.001;PHLPP:OR=63.673,95%CI:14.858~272.865,P<0.001。结果提示PHLPP、P-Akt、P-ERK的表达是影响PFS的独立预测因子,见表3。
2.5 PFS曲线的结果分析
PHLPP高表达患者的PFS明显长于PHLPP低表达患者[(8.42±0.94)个月vs (4.72±1.37)个月,P<0.001],差异有统计学意义,见封三图4;P-Akt阴性患者的PFS明显长于P-Akt阳性患者[(6.64±2.13)个月vs(4.90±1.92)个月,P<0.001],差异有统计学意义,见封三图5;P-ERK阴性患者的PFS明显长于P-ERK阳性患者[(6.92±1.76)个月vs (4.57±2.30)个月,P<0.001],差异有统计学意义,见封三图6。
3 讨论
以铂类为基础的化疗是晚期NSCLC的主要治疗手段,化疗药物耐药是治疗失败和导致死亡率上升的主要原因[7]。降低肿瘤细胞对顺铂治疗的耐药率,对于提高晚期NSCLC的生存率至关重要。顺铂主要通过DNA的链内交链和链间交链破坏DNA发挥其抗肿瘤活性[8],而关于顺铂耐药的机制,目前尚不明确。
PHLPP家族中包含三个同工酶,分别是PHLPP1α、PHLPP1β和PHLPP2,具有抑制肿瘤细胞生长与迁移能力,促进细胞凋亡的作用,证实其为肿瘤抑制基因的角色[4]。已有研究证实PHLPP在多种肿瘤组织呈低表达,如胶质瘤[8]、结肠癌[9,10]、前列腺癌[11]、胃癌[12]和胆囊癌[13-14],本研究中PHLPP在肺癌组织中呈低表达,低表达量为59.30%,这与Lv D[15]等报道PHLPP在肺腺癌组织中的表达量明显减少相一致。Gao T等[4]发现PHLPP蛋白可以拮抗细胞内P13K/Akt信号通路,从而成为Akt的负调节物。也有学者在神经细胞和B细胞模型研究中发现,PHLPP1的超表达能抑制ERK的磷酸化,而SiRNA敲除PHLPP1能提高ERK的磷酸化水平,表明PHLPP能负向调节ERK信号通道[15],以上体外细胞实验表明PHLPP能负向调节Akt及ERK通道从而发挥抑制肿瘤的作用[4-5]。本研究中PHLPP表达水平在不同年龄、性别、病理类型、有无吸烟组间比较差异无统计学意义,而与P-Akt以及P-ERK的表达呈负相关,表明PHLPP可能通过负向调节Akt及ERK通道而发挥抗肿瘤的作用,这与前述体外细胞实验的结果相一致。
已有研究证实,Akt和ERK与肿瘤的发生及化疗的预后有关[16-17],并与肺癌的放化疗预后也呈现相关性[18]。国内学者Wang M等研究[6]发现,在A549细胞系中,顺铂治疗能使Akt和ERK产生磷酸化而激活,而阻断Akt和ERK信号通道能增敏A549细胞对顺铂诱导的细胞凋亡,从而证实Akt和ERK通道的活化与肺癌细胞对顺铂的化疗预后有关。本研究统计学分析显示,P-Akt、P-ERK阴性患者比P-Akt、P-ERK阳性患者的PFS明显延长,差异有统计学意义,PFS与P-Akt以及P-ERK的表达呈负相关,这与Wang M等[6]研究结果一致。Xie Y[19]等报道PHLPP高表达预示着EGFR-TKI靶向治疗获得性耐药的时间更长,并提示PHLPP可能通过Akt及ERK通道调控EGFR-TKI的获得性耐药。本研究中封三图4~6的PFS曲线可见PHLPP高表达患者比低表达患者PFS明显延长,差异有统计学意义,表明PHLPP的表达水平与PFS呈正相关,而P-Akt、P-ERK的表达与PFS呈负相关,而COX回归分析发现PHLPP、P-Akt以及P-ERK的表达均是PFS的独立预测因子,可以推测PHLPP可能通过负向调节Akt及ERK通道调控肿瘤细胞对顺铂化疗的预后。
含铂药物化疗是治疗晚期NSCLC的主要手段,而铂类药物耐药是目前面临的主要问题,通过本研究发现PHLPP可能通过Akt及ERK通道调控肿瘤细胞对顺铂的化疗预后,故进一步探索PHLPP基因可能成为肺癌新治疗和改善顺铂耐药的新靶点。
[參考文献]
[1] Travis WD,Brambilla E,Noguchi M,et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J]. Thoracic Society,2011,8(5):381-385.
[2] Ellis PM,Vandermeer R. Delays in the diagnosis of lung cancer[J]. Thorac Dis,2011,3(3):183-188.
[3] Sieqel R,Ward E,Brawley O,et al. The impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J]. CA Cancer Clin,2011,61(4):212-236.
[4] Gao T,Furnari F,Newton AC,et al. PHLPP:A phosphatase that directly dephosphorylates Akt,promotes apoptosis,and suppresses tumor growth[J]. Mol Cell,2005,18(1):13-24.
[5] Li X,Stevens PD,Liu J,et al. PHLPP is a negative regulator of RAF1,which reduces colorectal cancer cell motility and prevents tumor progression in mice[J]. Gastroenterology,2014,146(5):1301-12.e1-10.
[6] Wang M,Liu ZM,Li XC,et al. Activation of ERK1/2 and Akt is associated with cisplatin resistance in human lung cancer cells[J]. Journal of Chemotherapy,2013,25(3):162-169.
[7] Yu J,Zhou J,Xu F,et al. High expression of Aurora-B is correlated with poor prognosis and drug resistance in non-small cell lung cancer[J]. Int J Biol Markers,2018, 33(2):215-221.
[8] Kelland L. The resurgence of platinum-based cancer chemotherapy[J]. Nat Rev Cancer,2010,7(8):573-584.
[9] Molina JR,Agarwal NK,Morales FC,et al. PTEN,NHERF1 and PHLPP from a tumor suppressor network that is diabled in glioblastoma[J]. Oncogene,2012,31(10):1264-1274.
[10] Liu J,Weiss HL,Rychahou P,et al. Loss of PHLPP expression in colon cancer role in proliferation and tumorigenesis[J]. Oncogene,2009,28(7):994-1004.
[11] Li X,Stevens PD,Yang H,et al. The deubiquitination enzyme USP46 functions as a tumor suppressors by controlling PHLPP-dependent attenuation of Akt signaling in colon cancer[J]. Oncogene,2013,32(4):471-478.
[12] Chen M,Prastt CP,Zeeman ME,et al. Identification of PHLPP1 as a tumor suppressor reveals the role of feedback activation in PTEN-mutant prostate cancer progression[J]. Cancer Cell,2011,20(2):173-186.
[13] Wang Z,Shu H,Wang Z,et al. Loss expression of PHLPP1 correlates with lymph node metastasis and exhibits a poor prognosis in patients with gastric cancer[J]. Surg Oncol,2013,108(7):427-432.
[14] Qiu Y,Li X,Yi B,et al. Protein phosphatase PHLPP induces cell apoptosis and exerts anticancer activity by inhibiting survivin phosphorylation and nuclear export in gallbladder cancer[J]. Oncotarget,2015,6(22):19148-19162.
[15] Lv D,Yang H,Wang W,et al. High PHLPP expression is associated with better prognosis in patients with resected lung adenocarcinoma[J]. BMC Cancer,2015,13(10):687-701.
[16] Audrey K,ONeill, Matthew J,et al. Suppression of survival signallingpathwaya by the phosphatase PHLPP[J]. FEBS Journal,2013,280(2):572-583.
[17] McCubrey JA,Steelman LS,Abrams SL,et al. Targeting survival cascades induced by activation of Ras/Raf/MEK/ERK,PI3K/PTEN/Akt/mTOR and Jak/STAT pathways for effective leukemia therapy[J]. Leukemia,2008,4(22):708-722.
[18] Katso R,Okkenhaug K,Ahmadi K,et al. Cellular function of phosphoinositide3-kinases:Implications for development,homeostasis,andcancer[J]. Annu Rev Cell Dev Biol,2001,17(1):615-675.
[19] Xie Y,Lv D,Wang W,et al. High PHLPP1 expression levels predicts longer time of acquired resistance to EGFR tyrosine kinase inhibits in patients with lung adenocarcinoma[J]. Oncotarget,2017,8(35):59000-59007.
[20] David O,Jett J,LeBeau H,et al. Phospho-Akt overexpression in non-small cell lung cancer confers significant stage-independent survival disadvantage[J]. Clinical Cancer Research,2004,10(20):6865-6871.
(收稿日期:2019-06-06)
