江淮地区猪链球菌和肠球菌分离株的鉴定、分型及药物敏感性分析
2019-05-10杨龙斌毛天骄吴华健焦安心魏建忠
杨龙斌,毛天骄,吴华健,焦安心,孙 裴,魏建忠,李 郁
(安徽农业大学动物科技学院,安徽 合肥 230036)
猪链球菌病是猪的一种重要细菌性传染病。能够引起该病的链球菌种型繁多,不同种型之间生物学特性差异显著,不同地区或年限优势种型也呈动态过程[1]。猪链球菌(Streptococcus suis,SS)是引起猪链球菌病的主要病原,根据其荚膜多糖(CPS)抗原的不同,可分为35个血清型,其中1、2、7、9型为主要流行的血清型,且以2型SS(SS2)致病性最强,流行范围最广,危害最严重[2]。胞外因子(EF)、溶菌酶释放蛋白(MRP)、溶血素(SLY)是SS重要的3种毒力因子,分别在逃避宿主免疫应答、诱导上皮细胞和巨噬细胞凋亡、侵入和裂解细胞及导致脑膜炎过程中发挥重要作用[3]。肠球菌先前归类于链球菌科链球菌属,后来发现肠球菌和链球菌的16S rRNA存在明显区别,遂将其列为一个单独的属:肠球菌属[4]。肠球菌一直被认为是一类对机体无害的共栖菌,但近年来的研究证明许多肠球菌也具有致病性,人感染肠球菌的报道已屡见不鲜,动物感染肠球菌的报道也越来越多,且人与动物存在交叉感染的风险[5]。
本研究通过对江淮地区临床病例中196株分离菌的鉴定,分析SS和肠球菌的血清型、毒力基因型、PFGE基因型及药物敏感性,了解江淮地区SS和肠球菌的优势血清型、基因型以及分离菌株之间的联系,为相关疫病防治提供依据。
1 材料与方法
1.1 临床样品与主要实验材料 196株分离菌源自江淮地区猪源临床病例,由安徽农业大学动物传染病研究室分离、命名并保存。肺炎链球菌质控菌株ATCC49619、金黄色葡萄球菌质控菌株ATCC25923购自中国食品药品检定研究院;沙门氏菌标准株H9812由中国疾病预防控制中心惠赠;SS1、2、7、9型标准株由江苏农科院兽医研究所惠赠。胰酪胨大豆酵母浸膏琼脂(TSA-YE)、水解酪蛋白琼脂(M-H,药敏试验专用培养基)购自绍兴天恒生物科技有限公司;2×TaqPCR Master Mix、DL2000 DNA Marker、DNA Marker I、内切酶SmaⅠ、XbaⅠ均购自TaKaRa公司;20种药敏纸片购自杭州天和微生物试剂有限公司;溶菌酶购于Sigma公司;蛋白酶购自德国Merck公司;PFGE级琼脂糖购自美国Bio-Rad公司;SeaKem Gold Agarose购自美国LONZA公司;全自动微生物生化鉴定GPI卡购自法国梅里埃公司。
1.2 引物设计与合成 参考文献[6],针对SS菌株间保守的谷氨酸脱氢酶基因(gdh)设计其种属鉴定引物;针对荚膜多糖基因cps1I(1型)、cps2J(2型)、cps7H(7型)和cps9H(9型)设计鉴定SS血清型引物;针对毒力因子(mrp、ef、sly)设计鉴定SS毒力基因引物(表1)。引物均由金斯瑞生物科技有限公司合成。
1.3 分离菌中SS和肠球菌的鉴定
1.3.1 SS的鉴定参考文献[7]中SS的鉴定方法,将196株分离菌分别接种于含5%血清的TSA培养基及兔鲜血琼脂平板中培养24 h。观察菌落形态及溶血性,并挑取表面光滑湿润、边缘整齐、半透明的细小菌落进行纯化。显微镜下呈单个、成对、链状排列的革兰氏阳性球菌经过氧化氢酶试验检测为阴性,可初步判定为链球菌。采用煮沸法[8]提取SS总DNA,并采用gdh种属鉴定引物进行细菌种属判定。PCR反应条件:94℃5min;94℃1min、55℃1 min、72℃ 1 min,35个循环;72℃ 10 min。PCR产物经琼脂糖凝胶电泳检测。
1.3.2 肠球菌的鉴定采用GPI革兰氏阳性菌鉴定卡进行肠球菌鉴定。在配套的一次性塑料试管中加入3 m L 0.45%NaCl溶液,挑取增殖培养的196株分离菌菌落制备细菌悬液后调整浊度约为0.5麦氏单位。参考仪器使用说明及段达荣等[9]实验流程操作后查看并记录鉴定结果。

表1 本实验用到的引物Table 1 Primers used in this experiment
1.4 SS血清型鉴定及毒力基因检测 采用PCR方法对鉴定为SS阳性的菌株进行1、2、7、9血清型及ef、mrp、sly毒力基因的检测[10]。
1.5 SS和肠球菌PFGE基因型分型 参照文献[11]采用PFGE方法对SS和肠球菌基因型分型。
1.6 SS和肠球菌药物敏感性试验 SS以肺炎链球菌ATCC49619为质控菌株,肠球菌以金黄色葡萄球菌ATCC25923为质控菌株,采用美国临床和实验室标准化委员会(CLSI)推荐的K-B纸片扩散法及判定标准检测并判定SS和肠球菌菌株对20种药物的敏感性。缺少动物源细菌药物敏感性判断标准的药物,参照人用抗菌药敏感性判定标准[12-13]。
2 结果
2.1 分离菌株SS和肠球菌的鉴定结果 采用SSgdh引物,经PCR方法对分离菌株初步鉴定;采用全自动细菌分析仪鉴定肠球菌。结果显示,196株分离菌中,SS 112株,占57.1%,为优势菌株;肠球菌40株,占20.4%;其它球菌44株,占22.5%。在40株肠球菌中,屎肠球菌21株,占52.5%;其次为粪肠球菌7株,占17.5%;铅黄肠球菌、鸟肠球菌各4株,占10.0%;其它肠球菌4株,占10.0%。表明SS是江淮地区猪链球菌病防控的重点,且肠球菌也成为猪细菌性疾病重要的致病菌。
2.2 SS 1、2、7、9血清型鉴定 采用cps引物经PCR方法鉴定SS的血清型。在112株SS中,SS1 9株,占8.0%;SS2 44株,占39.3%;SS7型1株,占0.9%;无SS9型;其余58株未定型,占51.79%。表明在致病性较强的1、2、7、9型SS中,江淮地区以SS2型为优势血清型。
2.3 SSef、mrp、sly毒力基因检测结果 采用毒力基因mrp、ef、sly的引物,经PCR方法鉴定112株SS的毒力基因。结果显示,ef、mrp、sly毒力基因的携带率分别为39.3%、36.6%、56.3%,ef-/mrp-/sly-基因型36株,占 32.1%,其次为ef+/mrp+/sly+基因型25株,占22.3%,优势毒力基因型为ef-/mrp-/sly-,显示江淮地区SS可能存在其它重要的毒力基因。而SS2型ef、mrp、sly毒力基因携带率明显高于整体SS的携带率,分别为75.0%、52.3%、88.6%,ef+/mrp+/sly+基因型19株,占43.2%,为优势毒力基因型,其次为ef+/mrp-/sly+基因型14株,占31.8%(表2)。表明SS2型较其它血清型致病性强可能与其ef、mrp、sly毒力因子携带率高有关。
2.4 SS PFGE基因型分型 SS菌株经蛋白酶K、溶菌酶作用及限制性内切酶消化后进行SS PFGE分型。结果显示,112株SS分为56个PFGE基因型,Ps28(18株,16.1%)和Ps27(14株,12.5%)为其优势PFGE基因型。44株SS2型分为11个PFGE基因型,Ps28(15株,34.1%)和Ps27(13株,29.5%)也是SS2型的优势PFGE基因型(图1)。表明江淮地区SS基因型呈多态性,SS PFGE分型比血清学分型具有更高的区分度。
2.5 肠球菌PFGE基因型分型 40株肠球菌经一系列酶处理后进行肠球菌PFGE分型。结果显示,40株肠球菌分为20个PFGE基因型,Pe12(9株,22.5%)和Pe7(7株,17.5%)为优势PFGE基因型。21株屎肠球菌分为9个PFGE基因型,Pe12(7株,33.3%)和Pe7(6株,28.6%)也为优势PFGE基因型(图2)。表明江淮地区肠球菌基因型多样化,部分菌株源于同一克隆系(如CZ13-2、HF14-11、AQ11-1),亲缘关系密切,且具有高度的相似性,但又位于不同分支,相互之间还存在一定的差异,提示这些菌株可能在传播过程中存在遗传变异。

表2 不同血清型SS的毒力基因型分布Table 2 Distribution of the virulence gene type of Streptococcus suis

图1 SS PFGE基因型聚类树Fig.1 PFGE genotype of the S.suis isolates

图2 肠球菌PFGE基因型聚类树Fig.2 PFGE genotype of Enterococcus
2.6 SS药物敏感性试验结果 用K-B法测定SS药物敏感性,结果显示SS对万古霉素、氨苄西林、阿莫西林、氧氟沙星、头孢拉定的敏感率达50.0%以上,对四环素、磺胺甲基异恶唑、链霉素、强力霉素、庆大霉素、阿奇霉素、复方新诺明耐药率高达85.0%以上,对头孢曲松、头孢噻肟、头孢吡肟、恩诺沙星、替考拉宁耐药趋势明显,耐药率已达到40%左右(表3),耐8种以上药物的96株,占85.7%。表明江淮地区SS耐药现象严重,且耐药谱越来越广。
2.7 肠球菌药物敏感性试验 用K-B法测定肠球菌药物敏感性,结果显示肠球菌对万古霉素、替考拉宁敏感率可达72.0%以上,对链霉素、复方新诺明、磺胺甲基异恶唑、庆大霉素、头孢吡肟、四环素、阿奇霉素、头孢曲松耐药率高达85.0%以上(表4)。40株肠球菌均耐6种以上药物,耐8种以上药物38株,占95.0%,表明江淮地区肠球菌多重耐药现象也很严重。

表3 SS药物敏感性试验结果Table 3 Antibiotics sensitivity of Streptococcus suis
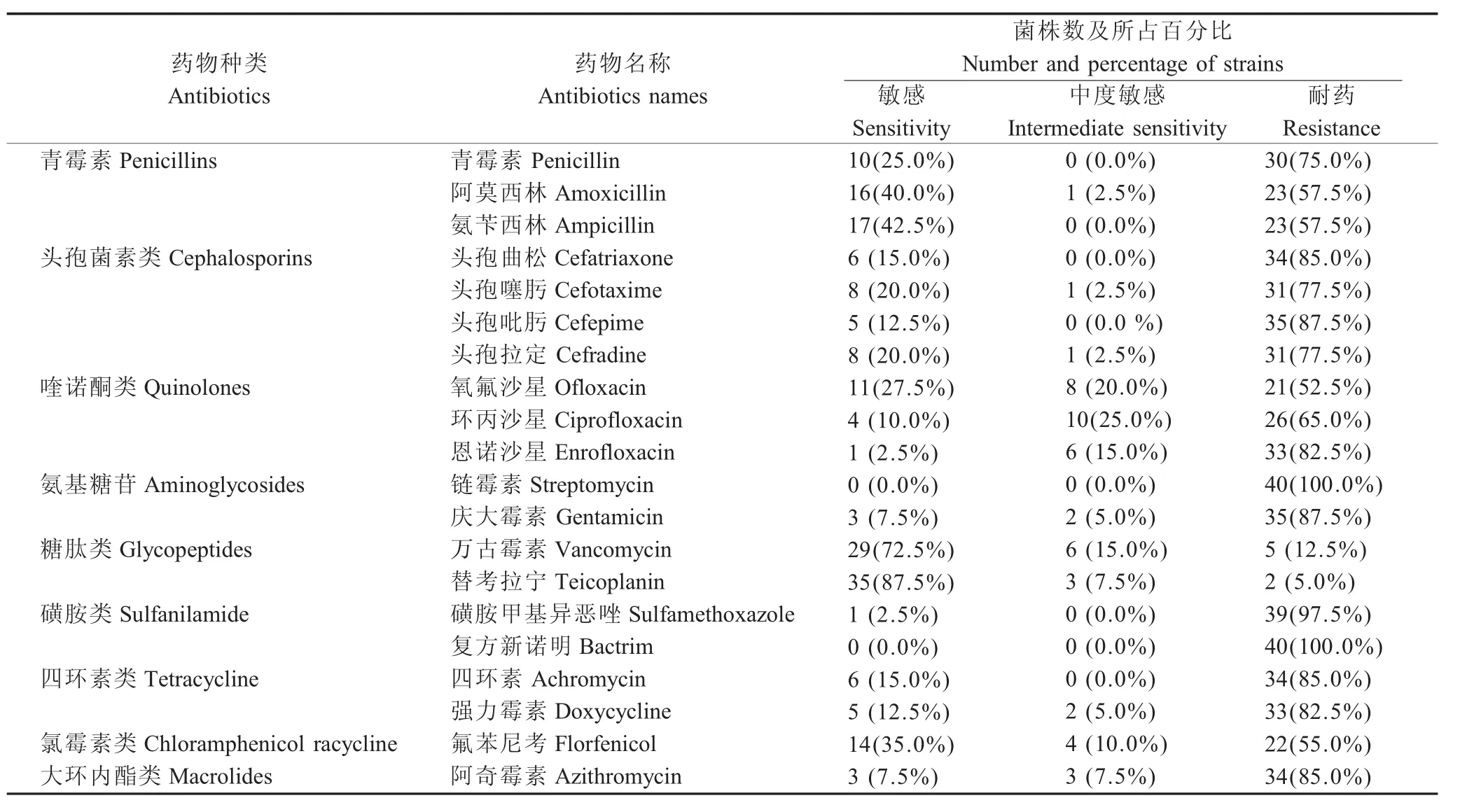
表4 肠球菌药物敏感性试验结果Table 4 Results of antibiotics sensitivity of Enterococcus
3 讨论
目前,在世界范围内SS是猪链球菌病最主要的病原菌。本研究196株分离菌中,SS为优势致病菌,与Wei报道一致[14],表明SS是江淮地区猪链球菌病防控的重点。SS血清型众多,源自不同健康状况猪体的SS优势血清型存在差异,本研究中源自患病猪的SS2型为优势血清型,与Li和Wisselink报道(源自患病猪)一致,而与张纯萍等报道(源自健康猪)不同[15-16]。SS毒力因子分布存在区域性差异,江淮地区ef-/mrp-/sly-为优势毒力基因型,其次为ef+mrp+sly+,与Li和Fittipaldi的报道不同[15,17]。优势毒力基因型ef-/mrp-/sly-的3种毒力基因均为阴性,表明SS存在其它重要的毒力基因。Vecht等将源自患病猪、健康猪、患病人体的180株SS2型进行仔猪感染性试验,结果表明MRP、EF与SS2型的致病性密切相关[18];濮俊毅利用斑马鱼检测mrp+/ef+型和mrp-/ef-型SS2型的致病力,结果表明同时具有MRP、EF毒力因子的SS2型一般为强致病力菌株[19];Wei等对从中国多地区分离的407株SS进行血清型及基因型鉴定,并对其中的SS2型主要毒力基因型进行小鼠感染性试验,结果显示,ef+/mrp+/sly+型SS2型(占54%)一般为高毒力基因型[14]。本研究中,江淮地区SS2型分离株毒力基因ef、mrp、sly的携带率分别为75.0%、52.3%、88.6%,明显高于SS的平均水平(39.3%、36.6%、56.3%),且结合SS2型分离于患病猪的临床特征,表明SS2型较其它血清型致病性强可能与其ef、mrp、sly毒力因子携带率高有关[17]。可见ef+/mrp+/sly+型不仅是我国常见SS2型暴发流行的主要毒力基因型[14],也是江淮地区常见SS2型优势毒力基因型。因此,在江淮地区应重点加强对常见SS2型的防控,尤其在疫苗的选用上应有的放矢。
本研究采用细菌分子分型“金标准”的PFGE法,初步建立了江淮地区常及肠球菌PFGE数据库,对猪链球菌病及肠球菌病的防治具有重要意义。同一PFGE基因型常存在不同血清型、毒力基因型,表明SSPFGE基因型与血清型、毒力基因型无相关性。112株SS分为56个PFGE基因型,40株肠球菌分为20个PFGE基因型,表明SS和肠球菌基因型呈多态性;部分菌株(如 SSHB13-2、HF11-1、HF14-8;肠球菌CZ13-2、HF14-11、AQ11-1)源于同一克隆系,亲源关系密切且具有高度的相似性,但位于不同小分支相互之间存在一定的差异,表明菌株可能在传播过程中存在遗传变异。因此,对SS2型和屎肠球菌优势PFGE基因型的监控,能够更好的为猪链球菌病的溯源和分子流行病学的研究提供科学依据。
近年来,SS耐药现象日益严重,不同地区猪场使用的抗生素药物存在差异,耐药谱不尽相同。对四环素、磺胺甲基异恶唑、链霉素、强力霉素、庆大霉素、阿奇霉素、复方新诺明耐药率达85%以上,与这些抗生素在兽医临床应用时间较长和应用普遍有关。头孢曲松、头孢噻肟、头孢吡肟、恩诺沙星是兽医临床治疗猪链球菌病的常用药,但SS也已经对它们表现明显的耐药趋势,这可能是目前江淮地区猪链球菌病治疗效果不佳的重要原因。40株肠球菌的耐药严重程度明显高于人源肠球菌[20],阿莫西林、氨苄西林是人医临床治疗肠球菌的常用药,在江淮地区猪源肠球菌中已出现50%以上的耐药率,而动物源与人源肠球菌存在交叉感染的风险,应该引起足够的重视,这对养殖业和公共健康均具有重要意义。此外,江淮地区SS和肠球菌均对万古霉素较敏感,这与兽医临床限制使用万古霉素,没有此类抗生素选择压力有关。
