两株草鱼源维氏气单胞菌菌株的主要表型特征及致病力比较
2019-05-10高彩霞曾伟伟王英英李莹莹尹纪元常藕琴石存斌
任 燕,高彩霞,曾伟伟,王 庆,王英英,李莹莹,尹纪元,常藕琴,石存斌
(中国水产科学研究院珠江水产研究所广东省水产动物免疫技术重点实验室/农业部渔用药物创制重点实验室,广东 广州 510380)
草鱼是我国淡水养殖产量最大的品种,2016年全国草鱼养殖产量589.9万吨,约占淡水养殖产量的18.6%。草鱼在养殖过程中易发生草鱼出血病、细菌性败血症、肠炎病、赤皮病、烂鳃病和小瓜虫病等,2016年全国养殖草鱼因病害造成的经济损失高达20亿元[1]。
气单胞菌(Aeromonas)可以引起草鱼等淡水养殖鱼类的细菌性败血症、肠炎病。维氏气单胞菌(A.veronii)又名维罗纳气单胞菌、凡隆气单胞菌和维隆气单胞菌,其普遍存在淡水、海水和污水等环境中[2],对水产养殖的危害重大,引起草鱼[3]、鳙[4]、鲫[5]和团头鲂[6]等大宗淡水鱼类以及罗非鱼[7]、加州鲈[8]、鳜[9]和斑点叉尾鮰[10]等特色淡水鱼类大量死亡,并伴有肠炎、腹水及出血等症状。本研究比较了两株分离自不同省份患病草鱼的A.veronii菌株的游动能力、胞外产物活性、细胞黏附性、靶动物致病力和毒力基因的差异,探究其毒力因子与致病力的关系,为该菌的致病机理及其引起疾病的流行病学调查提供研究基础。
1 材料与方法
1.1 主要实验材料 脑心浸出液培养基(BHI)、大豆酪蛋白琼脂培养基(TSA)购自广东环凯微生物科技有限公司;试验用A.veronii菌株GZ09007、FS12001分别从贵州兴义和广东佛山的患病草鱼分离,由本实验室鉴定保存;鲤上皮瘤细胞系(Epithelioma papulosum cyprinid,EPC)购自ATCC,草鱼肾细胞系(Ctenopharyngodon idellus kidney,CIK)由本实验室建立;绵羊红细胞、兔红细胞购自广州蕊特生物科技有限公司;迪夫快速细胞染色液(Diff-Quick Cell Stain)购自珠海贝索生物技术有限公司;引物、dNTP和TaqDNA聚合酶购自生工生物工程(上海)有限公司;IF-A接种液、GENⅢ微孔板购自美国Biolog公司;实验用草鱼购自广州市花都区某鱼种繁育场。草鱼体质量10±2 g,体长9±1.5 cm。实验前暂养2周,观察摄食活动状态,确认健康后用于后续实验。
1.2 两株细菌形态学观察和微生物自动分析仪鉴定将A.veronii菌株GZ09007、FS12001分别接种 TSA平板,28℃恒温培养24 h,挑取单菌落进行革兰氏染色,在普通光学显微镜下观察菌体形态;制备细菌悬液,3%磷钨酸负染,JEM-100CXⅡ型透射电子显微镜观察细菌形态。用无菌棉签蘸取适量纯培养24 h菌株,接种于IF-A接种液中,充分摇匀后用浊度仪测定读数为95%~98%T,再将接种液加入GENⅢ微孔板中,每孔100μL。将96孔鉴定板28℃培养20 h后,利用Biolog微生物自动分析仪读取两株菌的鉴定结果。
1.3 两株细菌对草鱼致病性试验 将两株细菌分别接种于TSA琼脂平板上,28℃培养24 h,采用0.65%盐水将纯培养菌稀释为1.5×109cfu/m L、1.5×108cfu/m L、1.5×107cfu/m L、1.5×106cfu/m L 的菌悬液。将实验鱼随机各分成4组,每组20尾。分别腹腔注射以上浓度菌液,每尾注射0.1 m L。连续观察14 d并记录鱼的死亡数量及症状,按Reed-Muench氏法计算两株菌的半数致死剂量(LD50)。
1.4 两株细菌的游动能力测定 参照曹青等[11]方法,将细菌在TSA培养基上划线培养12 h,然后用无菌牙签挑取少量菌体,点种到琼脂浓度为0.3%的TSA平板中央,用封口膜将TSA平板周围封口后再将平板正向放置于28℃恒温培养24 h,培养结束后测定菌落边缘到菌落中心的迁移距离,检测两株细菌的游动能力。每株细菌设立3组平行。试验重复3次。
1.5 两株细菌的胞外产物活性检测
1.5.1 溶血活性测定挑取单菌落划线接种于5%绵羊血营养平板上,28℃培养24 h,检测菌株有无溶血活性。同时参照曹青等[11]方法测定溶血效价:取200μL二倍倍比梯度稀释的48 h细菌培养上清的无菌滤液加至48孔细胞培养板中,每孔再加等量的1%不同动物红细胞(绵羊、兔、草鱼、鲫鱼),轻微振荡均匀,28℃放置1 h,再置4℃冰箱过夜,以使50%红细胞溶解的毒素最高稀释度为其溶血效价。以加等量灭菌生理盐水的红细胞作为不溶血对照,以加等量无菌水的红细胞为溶血对照。试验重复3次。
1.5.2 蛋白酶活性检测挑取单菌落划线接种于1.5%脱脂奶TSA平板上,28℃培养24 h,检测菌株有无蛋白酶活性。同时参照罗志飞等[12]的方法测定细菌溶蛋白效价:在1.5%脱脂乳TSA平板上打孔,孔径5mm。每孔加入40μL二倍比稀释的48 h细菌培养上清的无菌滤液,28℃作用24 h,以能够产生溶蛋白圈的最高稀释度作为溶蛋白效价。试验重复3次。
1.5.3 脂肪酶活性检测参照Voanmaele等[13]的方法检测菌株有无脂肪酶活性。试验重复3次。
1.6 两株细菌对CIK和EPC细胞的黏附性测定将已经培养好的CIK细胞和EPC细胞传至6孔细胞培养板(预先放置细胞爬片)中,28℃培养24 h,待细胞长成单层后,用PBS洗涤3次。分别加入1.0m L浓度为1.5×108cfu/m L的菌悬液,每个菌株加3个孔。28℃孵育90 min,PBS洗涤3~4次,除去未黏附的细菌,待盖玻片晾干后,用甲醇∶冰乙酸(3∶1)室温固定5 min,自然干燥,迪夫快速细胞染色液染色(A液染色40 s,水洗后加B液染色20 s),水洗、封片,油镜下随机选择30个细胞,对每个细胞所黏附的细菌计数。计算出每个细胞所黏附的细菌平均数,检测两株细菌对CIK和EPC细胞的黏附性。试验重复3次。
1.7 两株细菌的毒力相关基因检测 参照Mohamed[14]的方法,通过PCR检测气溶素基因(aerA)、细胞毒性肠毒素基因(act)、细胞兴奋性肠毒基因(alt/ast)、脂肪酶基因(lip)、胆固醇酰基转移酶基因(gcaT)、丝氨酸蛋白酶基因(ser)、脱氧核糖核酸酶基因(exu)、弹性蛋白酶基因(ahyB)、鞭毛蛋白结构基因(fla)等毒力相关基因,PCR产物经1%的琼脂糖凝胶电泳检测。
1.8 统计学分析 数据以平均值±标准差(X±SD)表示,用SPSS17.0统计软件进行单因素方差分析(One-Way ANOVA),以LSD方法进行多重检验。
2 结果
2.1 两株细菌形态及微生物自动分析仪鉴定结果两株细菌在TSA平板培养基培养24 h形成圆形、边缘整齐、表面光滑、淡黄色、隆起的菌落。革兰氏染色阴性(图1A、1C);菌体短杆状或弧形、两端钝圆,在透射电镜下可见单鞭毛(图1 B、1D)。通过Biolog微生物自动分析仪鉴定,结果显示菌株GZ09007、FS12001均为A.veronii,其中菌株GZ09007的各项参数PROB=0.869,SIM=0.664,DIST=4.050;菌株FS12001的各项参数PROB=0.962,SIM=0.713,DIST=4.330。
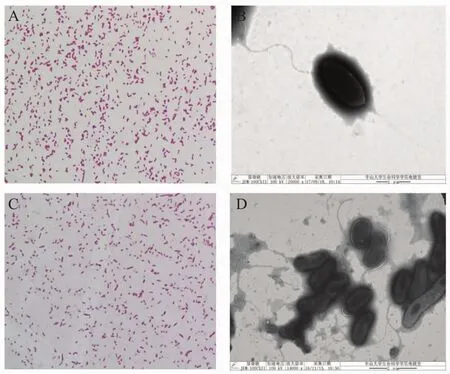
图1 显微镜下两株菌形态观察Fig.1 Them icrographs of A.veronii isolates of GZ09007 and FS12001
2.2 两株细菌对草鱼致病性试验结果 人工感染试验结果显示,菌株GZ09007可造成草鱼发病死亡,1.5×109cfu/m L、1.5×108cfu/m L浓度组草鱼在 24 h内大量死亡,濒死草鱼脱鳞、轻微蚀鳍,腹部至尾鳍红肿出血,解剖鱼体可见肝脏、脾脏等组织器官出血,腹腔有积液,肠粘膜充血。1.5×107cfu/m L浓度组草鱼在感染24 h后出现死亡,1.5×106cfu/m L低剂量组草鱼在感染后14 d内无死亡,GZ09007对草鱼的LD50为5.6×106cfu。而菌株FS12001仅高浓度组草鱼在感染后24 h~48 h出现少量死亡(表1)。表明,菌株GZ09007对草鱼的致病性比FS12001菌株强。

表1 人工感染草鱼试验Table 1 Results of artificial infection to healthy grass carp
2.3 两株细菌的游动能力测定结果 菌株在琼脂浓度为0.3%的TSA平板上游动能力测定,结果显示,两株细菌均具有良好的运动性,28℃培养24 h,菌株 GZ09007的迁移距离为 14±0.5 mm,菌株FS12001的迁移距离为7±0.5 mm(图2)。两株菌株游动能力差异显著(p<0.05)。表明菌株GZ09007的游动能力比FS12001的强。

图2 菌株的游动能力检测Fig.2 Swimming motility of the isolates in the agar plate
2.4 两株细菌的胞外产物活性检测结果
2.4.1 溶血活性28℃培养24 h后,两株细菌均在5%绵羊血琼脂培养基上产生清晰的β-溶血环。菌株GZ09007的48 h培养上清无菌滤液对绵羊、兔、草鱼、异育银鲫血细胞的溶血效价分别为1∶80、1∶40、1∶160、1∶80,FS12001 的溶血效价分别为 1∶40、1∶20、1∶40、1∶40。表明,两株细菌均能够产生溶血素,胞外产物具有溶血活性,并且菌株GZ09007的溶血活性显著高于FS12001菌株(p<0.05)。
2.4.2 蛋白酶活性28℃培养24 h后,菌株均能在1.5%脱脂奶TSA平板上产生清晰的溶蛋白圈,且GZ09007的48 h培养上清无菌滤液的溶蛋白效价为 1∶128,FS12001的溶蛋白效价为 1∶32。表明,两株细菌均能够产生蛋白酶,胞外产物具有蛋白酶活性,且菌株GZ09007的蛋白酶活性显著高于FS12001 菌株(p<0.05)。
2.4.3 脂肪酶活性28℃培养24 h后,在含1%Tween-80的TSA平板上,两株菌落周围均出现白色脂肪沉淀圈。表明两株细菌均能够产生脂肪酶,胞外产物具有脂肪酶活性,但两者差异不显著(p>0.05)。
2.5 两株细菌对CIK和EPC细胞的黏附性测定结果 菌株GZ09007对EPC、CIK细胞黏附能力弱,油镜下仅见少数细胞黏附1~2个细菌,其对二者的黏附性差异不显著(p>0.05)。FS12001对 EPC、CIK细胞均有较强的黏附性,油镜下可见两种细胞平均黏附细菌数分别为15±2个和13±1个,其对二者黏附性差异不显著(p>0.05)(图3、图4)。表明,菌株GZ09007对EPC、CIK细胞无黏附能力,FS12001对EPC、CIK细胞黏附能力强。

图3 菌株对EPC细胞的黏附性(1000×)Fig.3 Adhesion of the isolate GZ09007 and FS12001 to ECP cells(1000×)

图4 菌株对CIK细胞的黏附性(1000×)Fig.4 Adhesion of the isolate GZ09007 and FS12001 to CIK cells(1000×)
2.6 两株细菌的毒力相关基因检测结果 毒力相关基因检测结果显示,菌株GZ09007具有aerA、act、lip、ser、exu、fla毒力相关基因,但未检测到ast、alt、gcaT、ahyB毒力基因;FS12001具有aerA、act、alt、ast、lip、ser、ahyB、exu毒力相关基因,未检测到gcaT、fla毒力基因(图5)。表明,两株细菌均具有aerA、act、lip、ser、exu5个基因,但菌株GZ09007检测到的毒力基因数少于FS12001菌株。
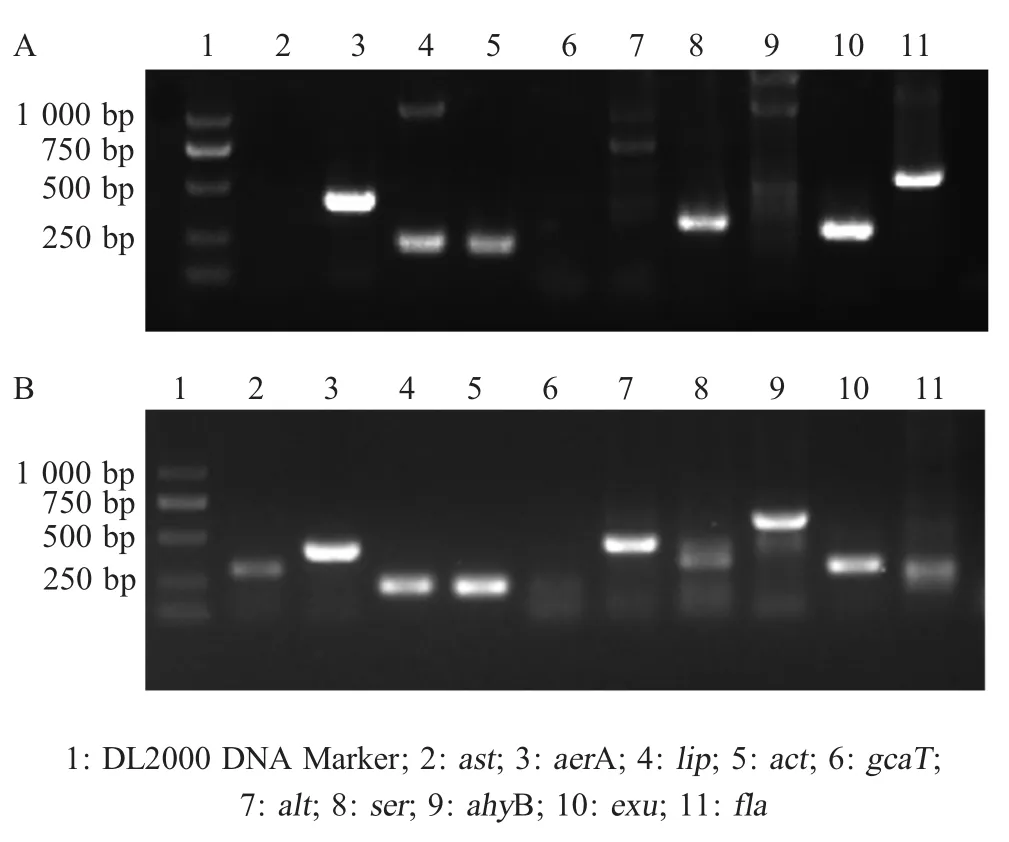
图5 菌株GZ09007(A)和FS12001(B)毒力相关基因PCR检测结果Fig.5 Detections of the virulence related genes in the isolate GZ09007(A)and FS12001(B)by PCR
3 讨论
两株菌的细菌形态无差异,透射电镜下均可见单鞭毛。通过Biolog微生物自动分析仪鉴定,结果显示两株菌均为A.veronii。菌株GZ09007人工感染草鱼可使其腹部至尾鳍红肿出血,腹腔有积液,肠粘膜充血,鳞片易脱落等,对草鱼的LD50为5.6×106cfu,该菌株对异育银鲫、鳙、团头鲂也均有较高的致病性[3]。而菌株FS12001仅高浓度组引起草鱼少量死亡,LD50高于1.5×108cfu。表明,菌株GZ09007为强毒株,菌株FS12001为弱毒株。
溶血素、胞外蛋白酶是气单胞菌的主要毒力因子,在病原菌的致病过程中起到至关重要的作用[10]。罗志飞等研究发现3株嗜水气单胞菌(A.hydrophlia)弱毒株培养上清均不溶血、不溶蛋白,而强毒株具有强溶血活性和溶蛋白活性[12]。本实验中两株细菌的胞外产物均具有溶血活性和胞外蛋白酶活性,但GZ09007的溶血活性、溶蛋白活性均显著高于FS12001,且GZ09007对草鱼的致病力强于FS12001。表明,溶血素和胞外蛋白酶在A.veronii的致病力中发挥重要功能。贺扬等研究发现A.veronii胞外产物也具有脂酶、蛋白酶、卵磷脂酶、DNA酶和溶血活性,且对斑点鮰具有明显的致病性,推测胞外产物在A.veronii入侵、感染甚至致死斑点鮰过程中发挥了重要作用[10]。同时,本研究中的两株细菌均具有脂肪酶活性,而脂肪酶能溶解宿主脂质,为细菌生长提供碳源,在细菌致病性中发挥一定作用。
鞭毛蛋白参与细菌的吸附、侵袭及定植,作为黏附素对宿主的黏附起到重要作用,是细菌的重要毒力因子。与强毒株GZ09007相比,FS12001的运动性弱、对EPC、CIK细胞黏附性强,推测其对草鱼肠上皮细胞有黏附性,有利于其在肠道内的定植,进而引起草鱼肠炎病。菌株FS12001除具有鞭毛外,其外膜蛋白中可能存在其它黏附素,利于黏附宿主细胞和定植。外膜蛋白LamB是A.veroniiTH0426重要的黏附素,能够增强病原菌的黏附能力,其重组表达蛋白具有良好的免疫原性,对鲤的保护率达84.2%[15]。A.hydrophlia外膜蛋白Aha1和OmpW是黏附素,免疫鲤均能够产生抗体,且相对保护率分别达 52%和 71%[16]。菌株 FS12001和GZ09007外膜蛋白的黏附性和免疫原性有待进一步研究。
毒力因子常作为细菌毒力强弱的判断标准之一,aerA、alt和ahp是气单胞菌的主要毒力因子,Li等对不同来源的A.hydrophlia进行分型和毒力特性分析,确定aerA-alt-ahp三基因联合检测法预测A.hydrophlia的毒力[17]。朱若林等扩增鳙源A.veronii10种毒力相关基因,检测到aerA、act、lip、fla、ahyB 5种毒力基因[4]。本研究中菌株GZ09007检测到aerA、act、lip、exu、fla、ser6种毒力相关基因,但未检测到ast、alt、gcaT、ahyB毒力基因;菌株FS12001 检 测 到aerA、act、alt、ast、lip、ser、ahyB、exu8种毒力相关基因,未检测到gcaT、fla毒力基因。有研究表明,菌株的致病力与毒力因子数量存在一定的相关性[12],但本研究的两株菌并未明显表现出这一相关性。在检测的10种毒力相关基因中,菌株GZ09007的毒力因子数量比菌株FS12001少,却对草鱼的致病力强,这可能与检测的毒力因子种类偏少,而菌株致病因子多且复杂,个别毒力因子并不能明显表现出菌株间致病力差别有关。表明,气单胞菌致病机制复杂,涉及到分泌系统、胞外产物、黏附因子、群体感应系统等多种毒力因子,这些毒力因子能够协同致病[18]。
