猪繁殖与呼吸综合征病毒与非典型瘟病毒双重RT-PCR检测方法的建立与应用
2019-05-10杨晓宇李雨濛徐志文
冯 宇,杨晓宇,赵 军,李雨濛,徐志文,2*,朱 玲,2
(1.四川农业大学动物生物技术中心,四川 成都 611130;2.四川动物疫病与人类健康四川省重点实验室,四川 成都 611130)
猪繁殖与呼吸综合征病毒(Porcine respiratory and reproductivesyndrome,PRRSV)具有高变异性的特征[1],其可以导致机体出现免疫缺陷[2],从而继发其它疾病,严重影响养猪业的生产与发展。因此,针对PRRSV建立的分子生物学检测方法不仅需要快速准确,还需要不断更新。
非典型瘟病毒(Atypical porcine pestiviruses,APPV)是被公认最有可能导致仔猪颤抖病的病毒[3-4]。近几年国内部分猪场仔猪颤抖病高达80%的发病率以及超过60%的死亡率使APPV成为研究重点[5],同时有文献指出未观察到明显症状的猪场,也能检出APPV阳性[6],因此必须建立针对APPV的快速、有效的检测方法。
PRRSV和APPV均可以引起病毒血症[3,7],且APPV在母猪血清中检测率达40%[8],而PRRSV血清阳性率从11.1%至95.4%不等[9]。同时APPV与PRRSV均可以在精液中检出[7-8],提示两种病毒均存在垂直传播。若APPV与PRRSV混合感染公/母猪,不仅不利于两种疾病的防控,甚至会加重仔猪患病程度,而本实验室前期研究发现二者存在混合感染。所以为进一步研究APPV与PRRSV混合感染情况和疾病损害关系,本实验建立了同时检测PRRSV和APPV的双重RT-PCR方法,为PRRSV和APPV的早期临床诊断提供了快速检测方法。
1 材料与方法
1.1 病毒和病料样品来源 猪瘟病毒(Classical swine fever virus,CSFV)、乙型脑炎病毒(Japanese encephalitis virus,JEV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、PRRSV和 APPV阳性病料样品均由四川农业大学生物技术中心鉴定保存;73份病料(含颈静脉血53份,精液20份)由本实验室采自四川省遂宁、邛崃、广元等地区猪场。
1.2 主要试剂 TRIzol、TaqPCR Master Mix(2×,blue dye)、pMD19-T 载 体 、 DL2000 DNA Maker、DH5α大肠杆菌感受态细胞、质粒DNA小量纯化试剂盒、DNA胶回收试剂盒均购自生工生物工程(上海)有限公司;Prime Script RT Rragent Kit购自宝生物工程(大连)有限公司。
1.3 引物的设计与合成 根据APPV NS2基因(KU194231)和PRRSV ORF2基因(JX512910.2)序列,利用Primer Blast各设计一对特异性引物(表1)。引物由上海生工生物工程技术服务有限公司合成。

表1 引物序列与产物长度Table 1 Sequences of primers and lengths of PCR products
1.4 病料的处理及病毒核酸的提取 APPV阳性病料样品、PRRSV阳性病料样品分别加入液氮研磨至无块状物,加入适量生理盐水形成研磨液,装入EP管,12 000 r/min离心5 min,取上清放置4℃保存备用;53份颈静脉血12 000 r/min离心5 min,取血清放置4℃保存备用;20份精液加入蛋白酶K和10%SDS混匀,55℃水浴至透明状,12 000 r/min离心5 min,取上清放置4℃保存备用。采用TRI-zol法提取上述病料研磨液、血清和精液中的总RNA。将提取的RNA利用反转录试剂盒反转录为cDNA,4℃保存备用。
1.5 单一RT-PCR的扩增 以上述制备的APPV和PRRSV的cDNA为模板,分别进行各自单一RT-PCR扩增,扩增体系为 25μL:2×PCR MIX Buffer 12.5μL,模板2μL、上下游引物各1μL(浓度为10μmol/L),ddH2O 8.5μL。反应条件:95℃5min;95℃ 30 s、55℃ 30 s、72℃ 30 s,共 30个循环;72℃7 min。扩增产物经1.5%的琼脂糖凝胶电泳检测。
1.6 重组质粒标准品的制备 利用DNA胶回收试剂盒回收1.5的扩增的目的条带,克隆于pMD19-T载体,构建重组质粒pMD-APPV、pMD-PRRSV,分别转化至DH5α克隆菌,选取阳性克隆菌由上海生工生物工程技术服务有限公司测序,将测序正确的样品扩大培养后采用上述质粒小提试剂盒分别提取pMD-APPV和pMD-PRRSV两种重组质粒作为双重RT-PCR的反应模板及质粒标准品。
1.7 双重RT-PCR方法的优化 在单一RT-PCR基础上,采用方阵试验分别对双重RT-PCR反应体系中的退火温度、循环次数、引物浓度、模板量等进行优化,建立最佳反应条件。
1.8 双重RT-PCR的特异性试验 利用已建立的双重RT-PCR,对JEV、CFSV、PEDV的 cDNA进行扩增,同时以无模板的PCR反应体系作为阴性对照,重组质粒pMD-APPV、pMD-PRRSV分别为阳性对照进行检测,扩增产物经1.5%的琼脂糖凝胶电泳分析。
1.9 双重RT-PCR敏感性试验 分别测定pMDAPPV和pMD-PRRSV的浓度,并对其进行10倍倍比稀释(10-1~10-7)。利用建立的双重RT-PCR和单一RT-PCR进行敏感性试验,同时设置阴性对照。
1.10 双重RT-PCR重复性试验 利用建立的双重RT-PCR进行批内批间重复性试验。批间重复试验:在不同时间段分别从阳性克隆菌DH5α中提取出pMD-APPV、pMD-PRRSV两种重组质粒,在同一条件下进行5次重复性试验;批内重复试验:取浓度为分别为 2.17×106拷贝 /μL、3.13×106拷贝 /μL 的pMD-APPV、pMD-PRRSV两种重组质粒在一次试验做5次重复。
1.11 临床应用 利用建立的双重RT-PCR方法对73份病料样品的cDNA进行RT-PCR扩增,同时利用本实验室两种病毒的单一RT-PCR进行检测,产物于1.5%琼脂糖凝胶电泳检测,以验证该方法的实用性。
2 结果
2.1 单一RT-PCR的扩增 APPV和PRRSV单一RT-PCR分别从各自阳性病料样品的cDNA扩增得到约500 bp和200 bp的特异性片段,与预期相符(图1)。经测序后利用NCBIBLAST比较分析显示,APPV的扩增序列为527 bp,与参考株(KU194231.1)的同源性为99%,PRRSV的扩增序列为207 bp,与参考株(JX512910.2)的同源性为99%。表明该单一PCR的扩增是特异的。
2.2 双重RT-PCR反应条件优化结果 通过方阵试验确定最佳双重RT-PCR扩增条件:2×PCR MIX Buffer 12.5μL,APPV-F/R引物、PRRSV-F/R引物(浓度均为10μmol/m L)各为0.9μL,APPV和PRRSV cDNA各2μL为模板,ddH2O 4.9μL,总体系为25μL。PCR扩增条件:95℃ 5 min;95℃ 30 s、56℃ 30 s、 72℃ 30 s,30个循环;72℃ 10 min。
2.3 双重RT-PCR特异性试验结果 采用核酸蛋白仪测定pMD-APPV和pMD-PRRSV两种重组质粒的浓度,经计算分别为2.17×109拷贝/μL、3.13×109拷贝/μL。利用2.2中已建立的双重RT-PCR反应体系对相关病原进行双重RT-PCR特异性实验。结果显示,除两种重组阳性质粒pMD-APPV、pMDPRRSV分别扩增出大小相符的特异性条带外,其余病毒(JEV、CSFV、PEDV)的扩增均未见特异性条带(图2),表明该双重RT-PCR方法的特异性较强。

图1 APPV和PRRSV单一RT-PCR扩增结果Fig.1 The APPV and PRRSV single amplifications by RT-PCR
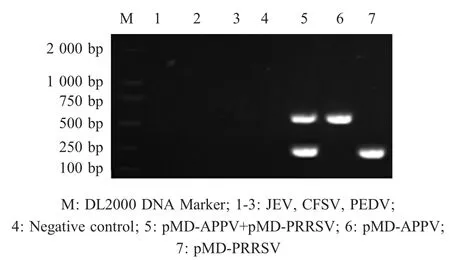
图2 双重RT-PCR的特异性试验Fig.2 Specific assay of the duplex RT-PCR
2.4 双重RT-PCR敏感性试验结果 敏感性试验结果显示能够同时检测APPV和PRRSV的核酸最低检出量为 2.17×104拷贝 /μL、3.13×103拷贝 /μL;单一RT-PCR扩增APPV和PRRSV核酸最低检出量分别为 2.17×105拷贝 /μL、3.13×105拷贝 /μL(图 3)。表明本研究建立的双重RT-PCR方法具有较高的敏感性。

图3 双重RT-PCR的敏感性试验Fig.3 Sensitivity assay of the duplex RT-PCR
2.5 双重RT-PCR重复性试验结果 批间重复试验与批内重复试验结果均显示PCR扩增条带亮度基本一致(图4),表明双重RT-PCR具有良好的重复性。

图4 双重RT-PCR的重复性试验Fig.4 Repeatability assay of the duplex RT-PCR
2.6 双重RT-PCR的临床应用 对73份病料样品的cDNA按照本实验建立的双重RT-PCR方法进行检测,结果显示,在血清中,APPV单一感染率为32.08%(17/53),PRRSV单一感染率为 60.38%(32/53),APPV+PRRSV复合感染率为7.55%(4/53);在精液中,APPV单一感染率为10.00%(2/20),PRRSV单一感染率为25.00%(5/20),APPV+PRRSV复合感染率为5.00%(1/20),表明APPV与PRRSV在血清和精液中均存在混合感染的情况,且混合感染率较高。将该结果与单一RT-PCR的检测结果对比分析,二者符合率为100%,表明本研究建立的方法可用于临床检测。
3 讨论
随着规模化养殖业的迅速发展,动物疫病流行方式也在不断的变化,特别是病原的混合感染也越发严重[10]。APPV与PRRSV虽然从临床症状上容易区分,但带毒公/母猪存在不表现临床症状的特点,尤其是PRRSV可隐性感染母猪长达16个月[8,11],这些带毒猪群的交配势必会影响后代仔猪的健康,特别是APPV与PRRSV混合感染猪群的交配。因此如何快速准确的检测出猪群是否同时存在PRRSV与APPV成为了目前猪场急需解决的技术问题。
作为最具代表性的现代检测和诊断新技术,PCR技术一直被大家广泛使用,并衍生出多重PCR等技术。近年来许多学者针对各种猪病建立了多重PCR检测方法,如PRRSV与猪PEDV双重RT-PCR方法[12]、猪圆环病毒Ⅱ型与PEDV复合PCR方法[13]等,实践表明,这些多重PCR与单一PCR方法相比,不仅极大的缩短了临床混合感染病例的鉴别和诊断时间,还省力、经济,对临床检测和诊断具有极高实用价值。由于PRRSV与APPV均属于RNA病毒,这为建立双重RT-PCR提供了便利。
目前不乏检测PRRSV与其它病毒的双重RT-PCR方法,但能够同时检测APPV和PRRSV鲜有报道,尤其是国内对APPV的报道更少[5]。本研究以APPV保守区NS2基因为模板、PRRSV保守区ORF2基因为模板设计了两对特异性的引物,并通过对PCR扩增条件的优化,在国内首次建立了针对这两种病毒的双重RT-PCR方法。实验结果表明该方法具有较强的特异性高敏感性和良好的重复性;临床应用表明该方法也适用于大规模的病毒检测。
采用已建立的双重RT-PCR方法对四川遂宁、邛崃、广元等猪场采集的73份病料样品进行检测,结果显示,APPV与PRRSV在四川省猪场广泛存在,猪场仍需加强对APPV与PRRSV相关疾病的防控。疫苗一直是防控PRRSV的重要手段[14],而PRRSV高检出率或因PRRSV的高变异性,易造成现有疫苗免疫失败;而对于APPV,国内外尚未有报道APPV相关疾病的防控方法,淘汰阳性猪或是防控该病的最佳方式。PRRSV无论在血清还是精液中的检出率均高于APPV,提示PRRSV仍是猪场应重点防制的病毒之一。同时APPV的血液和精液检出率与Gatto等[8]的研究相符,分别为20%~30%和5%~10%,提示APPV与PRRSV一样存在垂直传播,且结果显示在血清和精液中均检测到两种病毒,这可能会增加后代仔猪发病的几率,影响仔猪健康,阻碍养猪业的发展。但由于APPV与PRRSV的相互影响机制和生物学关系尚不清楚,对于是否影响带毒猪的健康,以及如何影响后代仔猪健康需进一步的研究。同时基于样品数量少的因素,带APPV与PRRSV的猪在四川地区的整体比例和流行情况也仍需进一步研究。
本研究建立的检测PRRSV和APPV双重RT-PCR方法,具有方便快捷、灵敏准确的特点,能够快速高效检测出APPV与PRRSV,为这两种病毒病早期临床诊断提供了技术支持,对这两种病混合感染的进一步研究及生物学关系有重要意义。
