猪圆环病毒3型Taq Man-MGB荧光定量PCR方法的建立及应用
2019-05-10李晓菲孙爱荣葛晓杰王彩宏魏笑笑秦立廷
李晓菲,陈 婷,孙爱荣,葛晓杰,黄 艳,徐 婷,王彩宏,魏笑笑,秦立廷
(山东新希望六和集团有限公司,山东 青岛 266000)
猪圆环病毒(Porcine circovirus,PCV)是一种无囊膜的单股环状DNA病毒,也是目前发现的最小的动物病毒[1-2]。2016年之前PCV仅有两个血清型,即PCV1和PCV2[3-4]。2016年美国报导出现一种新的圆环病毒血清型-PCV3,该病毒能引起猪的皮炎肾病综合征、繁殖障碍及心脏和多系统的炎症反应[5]。目前PCV3病毒尚未分离成功,致病性也未进行深入研究。2016年至2017年,我国已有13个省份(安徽、福建、河北、河南、山东、广东、湖北、湖南、江苏、江西、辽宁、沈阳和浙江)和一个直辖市(重庆)的猪场相继检测到 PCV3的存在[5]。目前,PCV3在我国猪群中的发病情况及流行情况并不清楚。因此建立一种快速、准确的PCV3实验室诊断方法对于进一步了解PCV3在我国猪群中的流行情况具有重要意义。本研究建立一种可以快速、准确地检测PCV3的TaqMan-MGB荧光定量PCR方法,为PCV3的流行病学调查以及检测诊断PCV3提供准确、可靠的技术工具。
1 材料与方法
1.1 病毒、临床样品与主要试剂 猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪轮状病毒(RV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、猪伪狂病病毒(PRV)和猪圆环病毒2型(PCV2)等病毒基因组均由新希望六和动保中心青岛中心实验室制备保存。47份疑似PCV3感染病料(包括血清、棉拭子和肠道等组织样品),由新希望六和动保中心青岛中心实验室在山东、河北等地的养猪场采集;PCV3阳性样品为本实验室鉴定并保存。DNA/RNA核酸共提试剂盒购自Invitrogen公司;DNA Marker和RNase-free water购自 TaKaRa公司;2×EasyTaqPCR SuperMix购自北京全式金生物技术有限公司;质粒提取试剂盒和DNA胶回收试剂盒均购自AxyGen公司。
1.2 引物探针设计与合成 参照GeneBank中PCV3病毒株基因序列(KT869077)进行比对分析,根据其保守区域设计特异性引物(QPCV3-F/R)和Taq-Man-MGB荧光探针(PCV3-Probe)(表1),探针5'端标记FAM,3'端标记MGB。引物和探针均由英潍捷基(上海)贸易有限公司合成。
1.3 重组质粒标准品制备 用Invitrogen核酸提取试剂盒提取PCV3阳性临床样品的DNA,以其为模板,利用引物QPCV3-F/R扩增目的基因,将PCV3目的片段经回收纯化后克隆至pMD19-T,将鉴定为阳性的质粒进行浓度检测,换算成拷贝数,以其作为质粒标准品,-20℃保存备用。
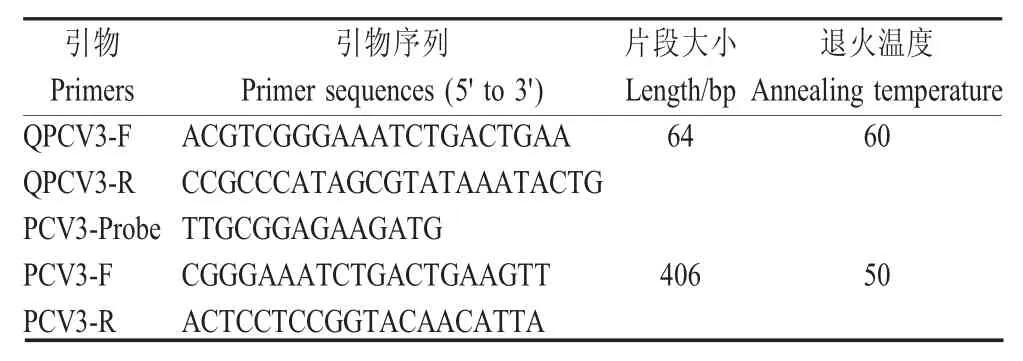
表1 引物探针序列信息Table 1 Primers and probe sequences information
1.4 反应条件的优化及标准曲线的建立 通过温度梯度PCR在不同退火温度下(52℃、54℃、56℃、58℃、60℃、62℃和65℃)进行荧光定量反应以确定引物的最适退火温度,采用矩阵法对探针浓度(1.25μmol/L、2.5μmol/L、5.0μmol/L、10.0μmol/L、20.0μmol/L)和引物浓度(1.25μmol/L、2.5μmol/L、5.0μmol/L、10.0μmol/L、20.0μmol/L)进行优化,最终获得最适合的探针引物浓度配比,确定反应体系。将1.3中制备的标准品10倍倍比稀释(10-1~10-9),利用优化后的条件对稀释后的标准品进行荧光定量PCR反应,以获得标准曲线。
1.5 特异性试验 利用建立的荧光定量PCR方法对本实验室保存的CSFV、PEDV、TGEV、RV和PRRSV的cDNA以及 PCV3、PPV、PRV和 PCV2的DNA进行PCR扩增,以验证该方法的特异性。同时设无模板为阴性对照,PCV3阳性DNA为阳性对照。
1.6 敏感性试验 将PCV3标准品质粒连续10倍倍比稀释后为模板,利用本实验室前期建立的常规PCR方法[6]和本研究建立的荧光定量PCR检测。扩增产物经凝胶电泳后观察结果,比较两种检测方法的敏感性。
1.7 重复性试验 利用该荧光定量检测方法对5个稀释度的质粒模板进行检测,每种浓度的模板重复检测4次,根据Ct值计算批次内变异系数;同时以这些质粒为模板,在4个不同的时间进行批间重复性试验,根据Ct值计算批次间变异系数,验证该检测方法的重复性。
1.8 对临床样品的检测 对收集的疑似PCV3感染的临床样品,利用本实验建立的荧光定量PCR检测和常规PCR[6]分别进行检测,比较分析结果。
同时对检测出PCV3阳性的样品进行其它猪病病原(CSFV、PRRSV、PRV、PEDV、TGEV、RV和PCV2)的检测[7-10],分析混合感染情况。
2 结果
2.1 反应条件优化结果 优化后的荧光定量PCR反应体系为 25μL:12.5μL 2×Premix ExTaq(Probe qPCR), 10 μL RNase-free water, 0.5 μL Probe(10 μmol/L),0.5 μL Primer F(10 μmol/L),0.5 μL Primer R(10μmol/L),1μL质粒标准品。反应条件为:95℃ 5 min;94℃ 15 s、60℃ 45 s,40个循环。
2.2 荧光定量PCR标准曲线的建立 测定质粒标准品浓度,换算拷贝数为4.78×1010拷贝/μL,然后对其进行10倍连续倍比稀释,对4.78×101~4.78×109拷贝/μL的质粒标准品进行荧光定量PCR反应,获得标准曲线(图1),结果显示标准曲线线性关系良好,表明建立的该方法可用于临床样品的检测。
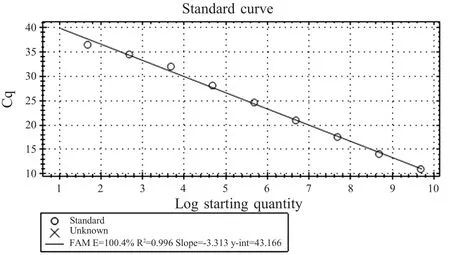
图1 PCV3荧光定量PCR标准曲线Fig.1 The standard curve of PCV3 real time PCR
2.3 特异性试验 利用所建立的荧光定量PCR方法对 CSFV、PRRSV、PEDV、TGEV、RV、PPV、PRV和PCV2等病毒的cDNA或者DNA进行特异性检测,结果显示,其对PCV3的检测结果为阳性,其它病原及阴性对照均为阴性(图2),该方法与其它猪病病毒无交叉反应,表明该方法具有良好的特异性。
2.4 敏感性试验 利用常规PCR方法[6]和荧光定量PCR方法对倍比稀释的标准质粒进行检测,结果显示两种方法检测最低限分别为4.78×103拷贝/μL(图3A)和 4.78×101拷贝 /μL(图 3B),PCV3 荧光定量方法比常规PCR方法敏感100倍。表明本研究建立的方法敏感性较高。

图2 PCV3荧光定量PCR特异性试验Fig.2 The specificity test of the PCV3 real time PCR

图3 PCV3常规PCR敏感性试验Fig.3 The sensitivity test of the PCV3 conventional PCR
2.5 重复性试验 用5种浓度的质粒标准品(4.78×107拷贝 /μL~4.78×101拷贝 /μL)分别进行批次内和批次间的重复性试验。结果显示,批内和批间重复性实验的变异系数均小于2.3%(表2),表明该方法具有良好的重复性与稳定性。
2.6 临床样品检测结果 分别利用建立的荧光定量PCR和常规PCR方法对47份临床样品进行检测,结果显示,荧光定量PCR方法阳性检出率为21.3%,常规PCR方法为14.9%(表3)。表明荧光定量方法具有更高的敏感性,更适用于PCV3的临床检测,尤其是感染早期病毒含量较低时可用于临床检测和流行病学调查。
47份可疑临床样品中检测到10份PCV3阳性样品,对这10份样品进行其它猪病病原检测,结果显示,10份PCV3阳性样品均为混合感染:其中PRRSV和PCV3共感染10份;PRRSV,PCV2和PCV3共感染4份;PRRSV,PEDV和PCV3共感染2份。表明临床上PCV3多与其它疾病混合感染,应给予高度重视。

表2 PCV3荧光定量PCR重复性试验结果Table 2 The reproducibility test of the PCV3 real time PCR
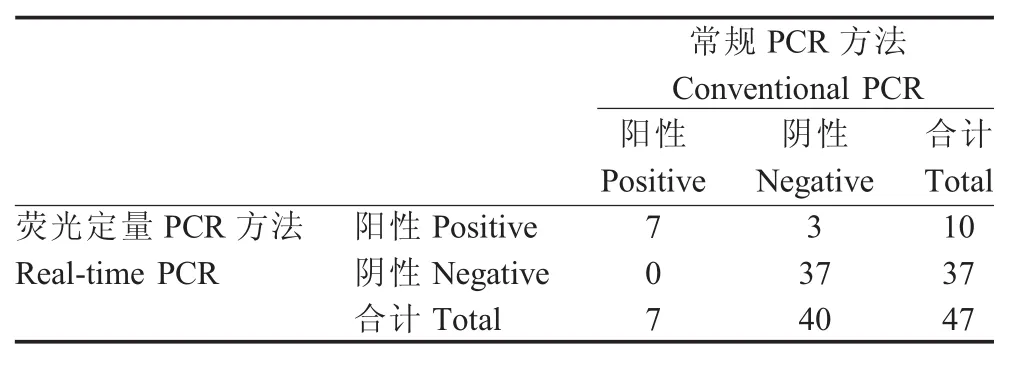
表3 临床样品检测结果Table 3 Detection of clinical samples by the PCV3 real time PCR
3 讨论
目前,针对PCV3的研究进展较少。为了进一步了解PCV3在我国猪群中的发病及流行情况,本研究根据GenBank中PCV3基因序列设计引物和探针,建立了一种特异性检测PCV3的TaqMan-MGB荧光定量方法。该方法的建立为PCV3的实验室诊断及流行病学调查提供了快速、准确的检测手段。
徐朋丽等建立了一种PCV3常规PCR检测方法,敏感性良好,最低可以检测62个拷贝数的模板DNA[11]。Chen等建立了一种基于SYBR的PCV3荧光定量方法,最低可以检测173个拷贝数的模板DNA[12]。TaqMan荧光定量PCR方法相对于常规PCR和SYBR荧光定量PCR具有更高的特异性和敏感性,同时能够减少假阳性结果。Wang等建立了一种TaqMan荧光定量PCR方法用于PCV3检测,该方法最低可以检测到100个拷贝数的模板,扩增效率为95.7%[13]。而本研究所建立的TaqMan PCV3荧光定量检测方法相对于上述检测方法具有更高的敏感性,最低可以检测47个拷贝数的模板DNA,扩增效率接近100%,更适用于PCV3感染早期的病原检测。
应用本实验建立的检测方法对本实验室2017年收集的47份可疑临床样品的检测结果显示,PCV3阳性样品数为10份,阳性检出率约为21.3%。Li等研究中发现PCV3/PRRSV混合感染率为62.5%,PCV3/PCV2混合感染率为45.8%[14]。因此,本研究进一步分析检测到的10份PCV3阳性样品的混合感染情况,发现10份PCV3阳性样品均为混合感染,其 中 PRRSV/PCV3、PRRSV/PCV2/PCV3、PRRSV/PEDV/PCV3的混合感染率分别为100%、40%和20%。本研究中10份PCV3阳性样品均同时存在PRRSV的感染,PRRSV感染与PCV3感染之间有是否某种联系还需进一步研究。Palinski等从具有PDNS症状的母猪及其流产胎儿体内均检测到PCV3病原,间接证实该病毒可以垂直传播[6]。利用本研究所建立的PCV3荧光定量检测方法,在新生腹泻仔猪肠道中检测到PCV3核酸的存在,进一步证实了PCV3垂直传播的可能性。另外,Ku等利用PCR方法从猪精液中检测到PCV3核酸,揭示该病毒也可以通过精液传播[15]。
目前,针对PCV3的研究尚处于起步阶段,PCV3病毒尚未分离成功,PCV3单独感染以及与其它病原共感染的致病力均有待于进一步研究。本研究所建立的PCV3TaqMan-MGB荧光定量检测方法,为PCV3的快速检测及其流行病学调查提供了快速、简便和可靠的技术工具。
