仙人掌多糖发酵提取工艺优化及其抗炎功效研究
2018-12-26,,,,*,,,
, ,,,*,, ,
(1.北京工商大学理学院,植物资源研究与开发重点实验室,北京 100083;2.北京工商大学,食品营养与人类健康高精尖创新中心,北京 100083)
仙人掌(OpuntiadilleniiHaw)属仙人掌科仙人掌属植物,是热带及亚热带植物,多生长于美洲及墨西哥干旱荒漠或者是半荒漠地区,其中以墨西哥分布最多。我国主要分布在广西、江西、广东、福建、海南等地。仙人掌用途广泛,如食用、做观赏植物、药用等。赵学敏所著的《本草纲目拾遗》中记载,仙人掌可作为药用植物,其具有清热解毒、安神利尿、行气活血、消肿止痛、健脾止泻的功效,可内服,亦可外用治疗疾病。
仙人掌内丰富的仙人掌多糖(Opuntiadilleniipolysaccharide,ODP)是其有诸多功效的主要原因之一。ODP主要从仙人掌的果实和茎里提取而来,极性大分子化合物葡萄糖、鼠李糖和阿拉伯糖是其主要组成物质。目前,ODP的抗氧化、抗炎抑菌、免疫、降血糖血脂、抗肿瘤、护肝[1-10]等多种功效都已被证实。除上述的药理功能,ODP还可防脱发[11],治疗神经退行性疾病药物[12],促进小鼠腹腔巨噬细胞的吞噬功能[13]。如今,仙人掌应用愈加广泛,如:市面上已有仙人掌制的果蔬汁、保健品和面粉制品出售。
传统的提取多糖的方法如包含水提、碱提、酸提、苯酚提取、微波辅助提取、超声辅助提取和酶提等方法[14],存在多糖提取率低,纯度不高,原料浪费严重,且影响对多糖进行结构分析和功效鉴定等问题[15]。本实验采用微生物法提取多糖,是利用微生物在生长过程中,会利用其他营养物质进行生长,但并不利用多糖对植物多糖进行去杂纯化,反应条件温和且能耗少。此外,因新鲜仙人掌肥厚的肉质茎含有丰富的蛋白质、矿物质、纤维素和维生素C等,同时含有丰富的SOD、黄酮类及多糖等活性功能成分[16],所以本实验采用新鲜的仙人掌叶片来进行试验。本文研究将从以下两个方面进行:一是用乳酸菌、酵母菌发酵新鲜仙人掌来探究ODP提取工艺;二是用发酵得到的多糖液做抗炎实验,探究ODP的抗炎活性。
1 材料与方法
1.1 材料与仪器
新鲜仙人掌 生长期为3~8个月,云南白药集团公司;硫酸、苯酚、葡萄糖(均为国产分析纯) 北京化工厂;乳酸菌 北京川秀科技有限公司;酵母菌 中国科学院微生物所;Hacat细胞 中国检验检疫科学研究院 中德化妆品研究所 细胞毒理实验室;水、过滤超纯水 实验室制备。
BS2202S 型电子天平、A2492型电子天平 北京赛多利斯仪器系统有限公司;HR2195搅拌机匀浆机 飞利浦有限公司;YZB-苏(锡)1132-2004低速大容量离心机 无锡市瑞江分析仪器有限公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限公司;DSHZ-300恒温水浴振荡器 江苏省太仓市实验设备厂;电热恒温水浴锅 北京长安科学仪器厂;WJ-80A-ⅡCO2培养箱 上海圣科;细胞培养瓶、板,冻存管 美国Corning/Costar;ABI7300型荧光定量PCR仪 美国应用生物系统公司;SW-CJ-1D超净工作台 上海启前电子科技有限公司;Enduro水平电泳仪 美国Labnet公司;Sigma 1-14微型离心机 德国Sigma;Sigma3-30K高速台式冷冻离心机 德国Sigma;GeneAmp PCR System 9700 PCR仪 美国ABI应用生物系统公司。
1.2 实验方法
1.2.1 ODP提取工艺 新鲜仙人掌茎洗净、去刺、去皮后切碎,用匀浆机匀浆2 min,再进行高压灭菌(120 ℃,30 min),在超净台将加入4 mL菌液加入100 mL仙人掌匀浆液中后用封口膜封口,于空气摇床(180 r/min)培养,而后离心(20000 r/min,10 min)取上清,用旋蒸仪将上清液浓缩至原体积的1/3,再以3倍体积95%乙醇醇沉12 h,再一次离心(20000 r/min,10 min),取沉淀热水(60 ℃)溶解得粗多糖液。
1.2.2 ODP含量测定 标准曲线绘制:参照苯酚硫酸法[17],结果显示在0~120 μg/mL浓度范围内,葡萄糖与A490呈良好的线性关系,以吸光度对多糖浓度C进行线性回归,得到回归方程:y=0.0151x+0.0042(R2=0.9996),y表示吸光度值A490,x表示仙人掌多糖的浓度,μg/mL。
ODP样品含量测定:取两只带塞试管,分别吸取1 mL待测液和1 mL去离子水,再分别依次添加0.5 mL 5%苯酚,摇匀后加入2.5 mL浓硫酸,盖上试管盖,再充分摇匀,静置5 min后,置于水浴锅中沸水浴1 h,测定吸光值A490。并根据回归方程计算ODP浓度。
ODP得率(%)=所得的ODP浓度×仙人掌多糖液体积/仙人掌的质量×100
老师要钻研教材,读懂教材,寻找读写结合点,设计写话梯度,给学生一个抓手,让学生写有所仿,创能有法,实现省时高效的写作训练。
1.2.3 乳酸菌发酵法的单因素实验
1.2.3.1 时间对多糖得率的影响 将提取的液料比固定为20∶1 (mL/g),温度固定为35 ℃,pH固定为7,选取5个时间梯度5、6、7、8、9 h,作为探究乳酸菌发酵提取时间的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.3.2 液料比对多糖得率的影响 将提取时间固定为7 h,pH固定为7,温度固定为35 ℃,选取5个液料比梯度10∶1、15∶1、20∶1、25∶1、30∶1 (mL/g),作为探究乳酸菌发酵提取液料比的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.3.3 pH对多糖得率的影响 将提取的液料比固定为20∶1 (mL/g),温度固定为35 ℃,时间固定为7 h,选取5个pH梯度为3、4、5、6、7,作为探究乳酸菌发酵提取pH的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
按以上实验所得的最佳单因素条件进行实验,计算最大的仙人掌多糖得率。
1.2.4 酵母菌发酵法的单因素实验
1.2.4.1 时间对多糖得率的影响 将提取的液料比固定为20∶1 (mL/g),发酵温度固定为28 ℃,pH固定为5.5,选取5个时间梯度24、36、48、60、72 h作为探究黄酒酵母发酵提取时间的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.4.2 液料比对多糖得率的影响 将提取时间固定为48 h,pH固定为5.5,温度固定为28 ℃,选取5个液料比梯度10∶1、15∶1、20∶1、25∶1、30∶1 (mL/g),作为探究黄酒酵母发酵提取液料比的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.4.3 pH对多糖得率的影响 将提取的液料比固定为25∶1 (mL/g),温度固定为28 ℃,时间固定为48 h,选取5个pH梯度3、4、5、6、7作为探究黄酒酵母发酵提取pH的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.5 细胞培养 冻存人表皮永生化细胞(Hacat细胞)从-80 ℃的冰箱中取出后,迅速37 ℃水浴,轻微震动1~2 min使其彻底融化。1000 r/min离心10 min,弃上清。加1 mL细胞培养液(Dulbecco’s Modified Eagle’s medium,DMEM),转移到10 cm2培养瓶中,置于37 ℃ 5% CO2环境中培养。细胞生长到90%融合时,动作轻柔地用2 mL磷酸盐缓冲液(pH7.4)洗两次。加200 μL 0.25%胰酶后,放入CO2培养箱中消化5 min,在观察确认细胞已从培养瓶壁上脱落后,加2 mL的完全培养液终止消化,800 r/min离心l0 min,去上清液,加入4 mL培养液,计数后,以5×105密度接种于10 cm2培养瓶。
1.2.6 MTT法测定Hacat细胞毒性实验 选取对数生长期状态良好的Hacat细胞。用0.25%胰蛋白酶将Hacat细胞消化,1500 r/min离心1 min后重悬于含有10%胎牛血清的DMEM培养基中,计数;用96孔培养板接种细胞,并设置空白对照,边缘孔用无菌磷酸盐缓冲液(PBS)填充,在5% CO2,37 ℃环境中培养12 h;按照各自终浓度分别加入ODP,细胞对照组是未做处理的组,每组设3个复孔,培养44 h后,加入5 g/L的MTT溶液,继续在37 ℃,5% CO2环境中培养4 h后终止培养;吸除孔内液体,用PBS洗涤1次,加入DMSO溶解结晶;M3读板仪测定各孔吸光度值A570。分别用0.5、1、2、2.5、5 mg/mL ODP处理Hacat细胞。
Hacat细胞存活率(%)=(测定孔吸光度值- 空白对照组吸光度值)/(细胞对照组吸光度值-空白对照组吸光度值)×100
1.2.7 ODP处理时间对炎症细胞因子IL-6、IL-8基因表达的影响 将消化后的细胞(消化方法参照1.2.5),以2×106/孔的密度接种6孔板内,以0.5 mg/mL的ODP处理细胞不同时间(0、0.5、1、1.5、2 h)。提取细胞总RNA,荧光定量分析处理对炎症细胞因子在转录水平表达的影响,内参基因定为β-actin。
1.2.8 炎症细胞因子IL-6、IL-8基因在转录水平表达量的测定
1.2.8.1 细胞总RNA提取与检测 总RNA提取及琼脂糖凝胶电泳检测RNA,参照文献[18-19] 。
1.2.8.2 cDNA第一链合成 使用TINAGEN Fast QuantRTKit(With gDNase)FastQuant cDNA 第一链合成试剂盒(去基因组)进行cDNA第一条链合成反应。将得到的cDNA中加1000 μL ddH2O,稀释混匀,-20 ℃保存。
1.2.8.3 引物及探针的设计和合成 根据NCBI发布的IL-6、IL-8等基因的序列,用PrimerExpress软件设计特异性引物,同时设计管家基因β-actin的特异性引物。基因引物序列见表1。

表1 Real-Time PCR引物序列Table 1 Primer sequences for Real-Time PCR
1.2.8.4 实时荧光定量PCR 以cDNA为模板,反应体系为20 μL,其中PrimeScriptRTEnzyme MIX 10.4 μL,ddH2O 7.6 μL,正向、反向引物各0.5 μL,cDNA模板1 μL,使用ABI7300荧光定量PCR仪扩增实验样本,扩增条件为95 ℃ 2 min预变性,然后按95 ℃ 15 s,57 ℃ 20 s,72 ℃ 30 s,做42个循环,在72 ℃收集荧光信号。
1.3 数据处理
实验中每个处理重复三次,用SPSS 25.0软件进行数据的显著性分析,应用Origin 9.0软件作图。
2 结果与分析
2.1 乳酸菌发酵提取多糖单因素实验
2.1.1 时间对得率的影响 按照方法1.2.3.1探究不同发酵时间对ODP得率的影响,结果见图1,随着时间增加,得率显著性增加(p<0.05),7 h时最大为0.25%,而后得率变化不显著(p>0.05)。这是由于提取时间短时,ODP溶出不完全,乳酸菌生长还处于迟缓期或对数期,而提取时间长,乳酸菌会随着时间的增长而逐渐衰亡,从而失去活性,为了减少能耗,选取7 h为乳酸菌发酵提取的最佳时间。
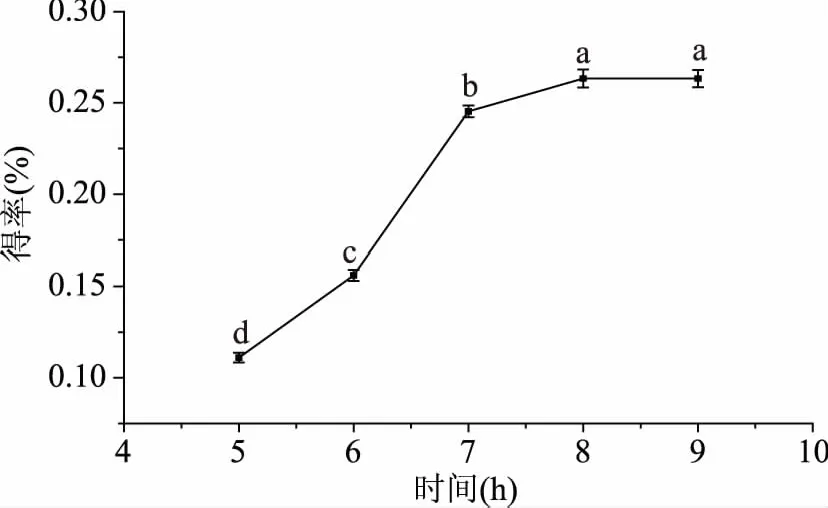
图1 提取时间对ODP得率的影响Fig.1 Effect of time on the ODP yield注:图中不同小写字母表示差异显著(p<0.05),相同字母表示差异不显著(p>0.05),图2~图6同。
2.1.2 液料比对得率的影响 按照方法1.2.3.2 探究不同液料比对ODP提取的影响,结果见图2,随着液料比的增加,ODP得率显著性增加(p<0.05),当液料比为20∶1 mL/g增加为25∶1 mL/g时,得率不显著增加达到最大值0.23%(p>0.05),随后得率显著性下降(p<0.05)。这是因为在一定范围内,增加提取液体积可以增加溶剂与提取物质的接触面积,使多糖得以较多溶出,但继续增加提取液体积会使多糖达到饱和[20]。因此,乳酸菌发酵提取的最佳提取液料比为25∶1 mL/g。
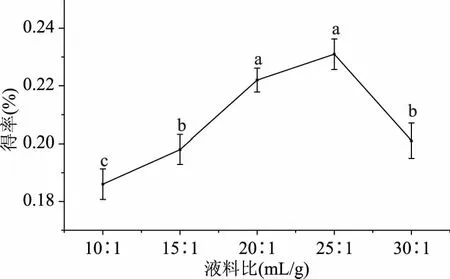
图2 提取液料比对ODP得率的影响Fig.2 Effect of liquid-to-material ratio on the ODP yield
2.1.3 pH对得率的影响 按照方法1.2.3.3探究不同pH对ODP提取的影响,结果见图3,随着pH升高,ODP得率显著增加(p<0.05),在pH=5时得率达到了最大值0.28%,pH在5~6时得率不显著降低(p>0.05),超过6之后,得率显著降低(p<0.05)。这是因为乳酸菌适宜在弱酸情况下生长,随着pH的降低,菌体生长受到抑制[21]。因此,选取5作为乳酸菌发酵提取的最佳pH。

图3 提取pH对ODP得率的影响Fig.3 Effect of pH on the ODP yield
以温度为35 ℃,时间为7 h,pH为5,液料比为25∶1 mL/g为试验条件,提取ODP,所得的ODP得率为0.26%。经过工艺优化的热水浸提法得到的得率最高为0.12%[22],乳酸菌发酵的ODP得率比热水浸提法的得率高出0.14%。
2.2 酵母提取多糖的单因素实验
2.2.1 时间对得率的影响 按照方法1.2.4.1探究不同发酵时间对ODP提取的影响,结果见图4,在24~48 h这段时间内,随着时间的增加,得率显著性增加(p<0.05),48 h时得率最大为0.51%,而后得率变化不显著(p>0.05)。这是由于提取时间短时,ODP溶出不完全,黄酒酵母生长还处于迟缓期或对数期,而提取时间长黄酒酵母会随着时间的增长而逐渐衰亡,从而失去活性,为了减少能耗,选取为48 h为黄酒酵母发酵提取的最佳时间。
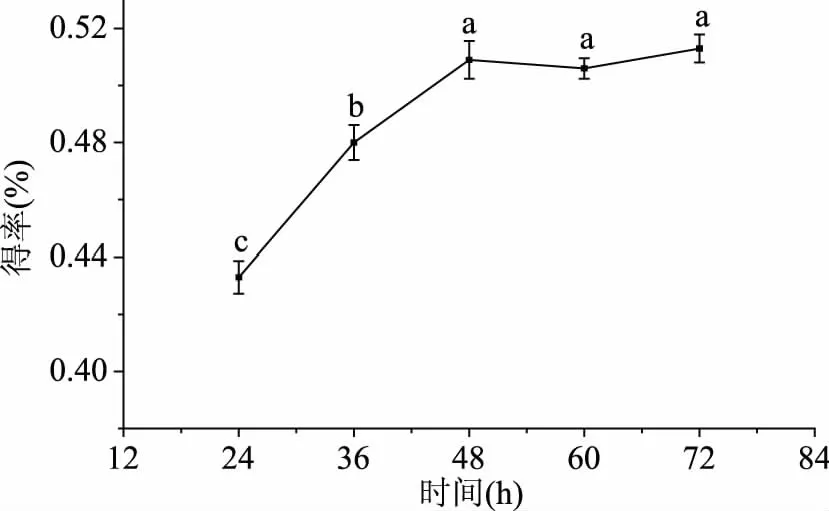
图4 提取时间对ODP得率的影响Fig.4 Effect of time on the ODP yield
2.2.2 液料比对得率的影响 按照方法1.2.4.2探究不同液料比对ODP提取的影响,结果见图5,随着液料比的增加,ODP得率发生显著性变化,当液料比达到20∶1 mL/g,ODP出现降低,当液料比达到25∶1 mL/g,得率升高到最大为0.48%,随后得率显著下降(p<0.05)。这是因为在一定范围内,随着液料比的增大,提取液体积变大,提取的损耗增加,在液料比20∶1 mL/g时损耗增大量大于提取率的增大量,当提取液体积继续增大时,损耗比提取得率的增加量小,但当达到某一提取液体积时,多糖溶出会达到饱和从而使ODP得率下降。因此,取25∶1 mL/g为黄酒酵母发酵提取最佳液料比。
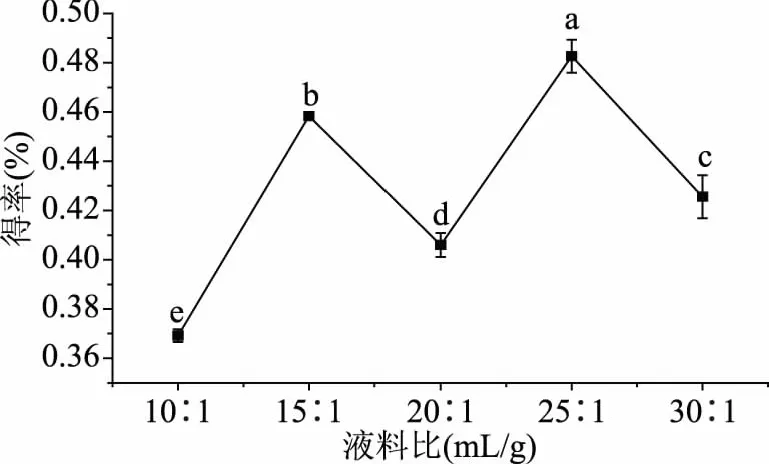
图5 料液比对ODP得率的影响Fig.5 Effect of liquid-to-material ratio on the ODP yield
2.2.3 pH对得率的影响 按照方法1.2.4.3探究不同pH对ODP提取的影响,结果见图6,在pH=3时ODP得率最高0.53%,随着pH的增加得率显著降低(p<0.05)。黄酒酵母适应偏酸性环境,但不适应强酸。因此,黄酒酵母发酵提取最佳pH为3。

图6 提取pH对ODP得率的影响Fig.6 Effect of pH on the ODP yield
经过工艺优化的热水浸提法得到的得率最高为0.12%[22],经本实验所得的黄酒酵母发酵的工艺条件为温度28 ℃,时间48 h,液料比25∶1 mL/g,pH为3,得率能达到0.53%,比热水浸提法得率到了4倍。
2.3 MTT法测定Hacat细胞毒性
如图7所示,以未加任何ODP的细胞作空白对照,当ODP浓度高达2 mg/mL时,细胞增殖活力依然超过90%,说明ODP对细胞几乎无毒性。且当ODP浓度减小,细胞增殖活力反而增加,ODP浓度为0.5 mg/mL时,细胞存活率高达109.07%,说明低浓度ODP对HacaT有增殖作用。

图7 ODP浓度对Hacat细胞存活率的影响Fig.7 Cell viability with different polysaccharide of Opuntia dillenii(Ker-Gawl.)Haw
2.4 ODP处理时间对炎症细胞因子IL-6、IL-8基因表达的影响
考察时间效应,用ODP处理Hacat细胞,2 h内炎症因子类基因(IL-6、IL-8)表达量产生了不同的变化。
促炎症因子IL-6是一种在炎症和免疫反应中具有多种功能细胞因子,可以促进炎症反应中花生四烯酸的释放,刺激T细胞活化和增殖,提高B细胞中免疫球蛋白的生成,并且诱导急性期反应蛋白的产生[23]。ODP添加时间对促炎症因子IL-6表达量的影响如图8所示,可看出15 min内基因表达量出现降低,15~30 min时间内IL-6表达量平缓升高,而在30~90 min时间内,表达量发生了显著的提高(p<0.01),此后又缓慢下降,在2 h的表达量与60 min时的表达量差不多,但是显著高于初始值(p>0.05)。整体来看,30 min后的促进作用是ODP对IL-6基因表达量的主要影响。ODP对IL-6基因表达量的影响作用,可验证ODP可能是通过促进IL-6基因的表达从而影响花生四烯酸的代谢而起到抗炎作用的。

图8 ODP处理不同时间对IL-6表达量影响Fig.8 Influence of treatment time by ODP on IL-6 expression注:*:与初始值(作用时间为0 min)相比,差异显著(p<0.05);**:与初始值相比,差异极显著(p<0.01);图9同。
IL-8在许多炎症反应中具有聚集和激活淋巴细胞、白细胞和血管内皮细胞的功能,可因局部产生的IL-8直接作用于表皮细胞,促进慢性炎症的发展[24]。ODP添加时间对的其表达量的影响如图9所示,IL-8基因的表达量在15 min内迅速下降,显著低于初始值(p<0.01),并在之后的15 min内继续缓慢下降,在30~90 min这段时间内在保持显著小于初始值的范围内缓慢上升(p<0.05),而之后到2 h之间,其又缓慢下降。整体来看,在0~15 min内ODP迅速抑制IL-8的表达,并在2 h的时间内ODP始终保持抑制IL-8的表达,这是ODP对IL-8基因作用的主要体现。大量的中性粒细胞因IL-8表达的增高而向炎症区域聚集,从而释放炎症介质加重炎症反应。IL-8的表达因受到ODP作用而受到抑制,间接地炎症的发生和发展就受到抑制。
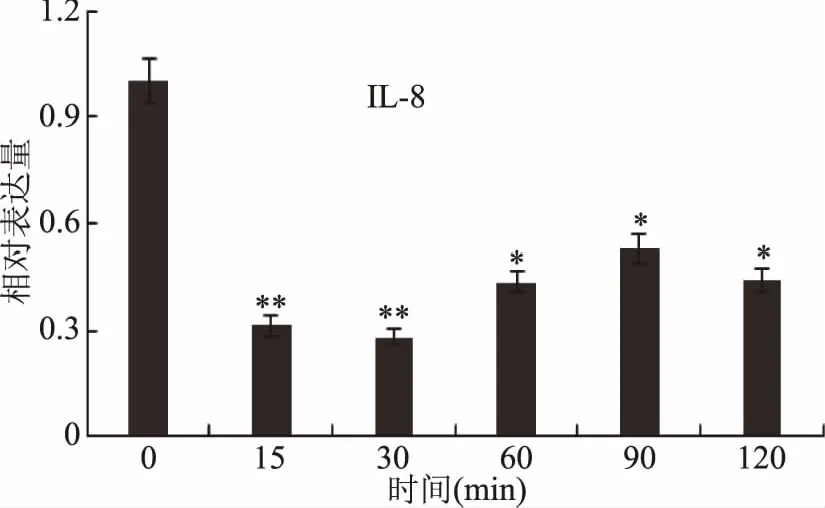
图9 ODP处理不同时间对IL-8表达量影响Fig.9 Influence of different training time by ODP on IL-8 expression
3 结论
在本课题的研究中,采用乳酸菌与黄酒酵母对用微生物法提取多糖进行了初步探索。结果显示,同样直接使用新鲜的仙人掌汁进行提取,采用乳酸菌发酵最适提取工艺:发酵时间7 h、液料比25∶1 (mL/g)、pH为5,此工艺下多糖得率为0.26%。黄酒酵母发酵最适提取工艺:发酵时间48 h、液料比25∶1 (mL/g)、pH为3,此工艺下多糖得率为0.53%,黄酒酵母发酵所得ODP得率远远高于乳酸菌,因此选取黄酒酵母作为发酵菌种提取ODP会更有优势。本课题也探究了ODP抗炎能力,结果显示ODP通过抑制IL-8的表达,促进IL-6的表达来抑制炎症的发生和发展,为研究仙人掌的抗炎效果提供理论依据。
