福建养殖仿刺参抗氧化多肽的酶解工艺优化及其对过氧化氢诱导的血管内皮细胞EA.hy926损伤的保护作用
2018-12-26,,,,,,,,*
,,,, , ,,,*
(1.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建厦门 361013; 2.福建省海洋生物资源开发利用协同创新中心,福建厦门 361013; 3.华侨大学生物化工学院,福建厦门 361021; 4.宁德师范学院生物系,福建宁德 352100)

抗氧化多肽具有减缓或防止生物大分子过氧化以及清除体内自由基的功效,其活性与特定氨基酸组成、序列排布和空间构象密切相关[6-7]。利用蛋白酶水解有利于大分子蛋白质中抗氧化氨基酸的暴露,同时蛋白来源、蛋白酶类型、水解程度和预处理工艺等因素亦决定了酶解多肽的抗氧化活性[8-9]。研究发现,海参体壁酶解多肽具有显著的体外抗氧化活性[10-12],然而目前尚未有对养殖刺参,特别是南方新兴规模化养殖刺参的酶解多肽工艺优化及抗氧化活性研究。
因此,本研究以福建养殖仿刺参(Apostichopusjaponicus)体壁为原料,选择水解度、体外DPPH自由基清除率为评价指标,从6种蛋白酶中筛选出制备仿刺参抗氧化多肽的最适蛋白水解酶;以单因素法、Box Behnken响应面设计法优化酶解工艺;测定仿刺参酶解多肽的体外抗氧化活性;进一步探讨仿刺参抗氧化多肽对H2O2诱导人脐静脉内皮细胞EA.hy926氧化应激损伤的保护效应,以期为仿刺参营养价值开发与商业增值转化提供理论参考。
1 材料与方法
1.1 材料与仪器
仿刺参(Apostichopusjaponicus) 重量在200~300 g之间,福建省宁德市霞浦县利丰达水产有限公司;DMEM液体培养基、胎牛血清、杜氏磷酸盐缓冲液(D-PBS)、青-链霉素、胰酶细胞消化液 美国Hyclone公司;DMSO、MTS、HAT培养基添加剂 美国Sigma公司;中性蛋白酶(5万U/g)、碱性蛋白酶(5万U/g)、风味蛋白酶(2万U/g)、木瓜蛋白酶(8万U/g)、动物蛋白水解酶(10万U/g) 南宁庞博生物工程有限公司;胃蛋白酶(1200 U/g) 国药集团化学试剂有限公司;其他化学试剂(分析纯) 国药集团化学试剂有限公司;色谱柱OHpak SB-802.5HQ(8.0 mm×300 mm,6 μm) 日本昭和电工集团;人脐静脉内皮细胞株EA.hy926 用含10%胎牛血清、1%青-链霉素、2% HAT添加剂的DMEM培养基在37 ℃、5% CO2、100%饱和湿度条件下培养,细胞铺满培养瓶底70%~80%时,用1 mL胰酶细胞消化液消化1 min左右,按1∶3传代培养 中国科学院细胞库;总抗氧化能力(T-AOC)检测试剂盒(FRAP法)微板法、抑制与产生超氧阴离子自由基测定试剂盒(比色法)、羟自由基测试试剂盒、细胞丙二醛(MDA)测定试剂盒(微板法)、总超氧化物歧化酶(SOD)测定试剂盒(WST-1 法) 南京建成生物工程研究所;研磨玻璃珠 德国Qiagen公司。
台式多功能切肉机TJ-85 广东乐创电器有限公司;恒温水浴锅HH-6 常州国华电器有限公司;台式离心机5810R 德国Eppendorf公司;凝胶色谱仪ELEOS System 美国Wyatt公司;生物安全柜AC2-4S1 新加坡ESCO公司;CO2培养箱Galaxy 170S 德国Eppendorf公司;倒置显微镜和照相系统DMi8 德国Leica公司;酶标仪InfiniteM200 瑞士TECAN公司;组织破碎仪TissueLyser II 德国Qiagen公司。
1.2 实验方法
1.2.1 仿刺参的预处理 新鲜仿刺参去泥、去除内脏,蒸馏水洗净体壁,过水煮沸5 min,滤纸沥干表体水分后切块,绞肉机搅碎,真空包装,实验前-20 ℃保存。
1.2.2 最适酶类型的选择 酶解前,将真空包装原料置流水至解冻。在固定料液比1∶20 g/mL和加酶量5000 U/g底物条件下,选择各蛋白酶说明书最适酶解温度、pH进行酶解(中性蛋白酶:50 ℃、pH7.5;胃蛋白酶:40 ℃、pH2;碱性蛋白酶:50 ℃、pH8;风味蛋白酶:50 ℃、pH7;木瓜蛋白酶:50 ℃、pH7;动物蛋白水解酶:50 ℃、pH7.5),在酶解20、40、60、120、180、240、300、360 min时移取酶解液,酶解完成后,将酶解液放置于100 ℃水浴锅中,灭酶10 min。10000 r/min离心10 min,取上清液分别测定各酶解液的水解度、体外DPPH自由基清除率,选取酶解6 h酶解液,测定相对分子质量分布情况,综合评价筛选出最适用蛋白酶。
1.2.3 指标测定
1.2.3.1 水解度的测定 水解度的测定参照文献[13]操作,采用比色法测定游离氨基酸态氮质量浓度[14],采用微量凯氏定氮法测定总氮质量[15],按照公式(1)计算。

式(1)
式(1)中:N2为仿刺参蛋白酶解后溶液中游离总氨基态氮质量(g);N1为仿刺参蛋白酶解前溶液中游离总氨基态氮质量(g);N0为仿刺参蛋白中总氮质量(g)。
1.2.3.2 体外DPPH自由基清除率测定 体外DPPH自由基清除率的测定参照文献[10]操作,按照公式(2)计算:

式(2)
1.2.3.3 相对分子质量分布的测定 移取样品溶于流动相中,用流动相定容至50 mL,经0.22 μm孔径滤膜过滤后,进样20 μL,样品流经凝胶色谱柱进行分离纯化,再流经激光检测器(LS)和示差检测器(DRI)中进行检测。进样条件:色谱柱OHpak SB-802.5HQ(8.0 mm×300 mm,6 μm);流速0.500 mL/min;流动相NaNO3(0.2 mol/L的硝酸钠溶液过0.22微米孔径滤膜并超声波脱气15 min);柱温25 ℃,检测波长220 nm。
1.2.4 单因素实验
1.2.4.1 加酶量对酶解效果的影响 根据酶类型筛选结果,选用动物蛋白水解酶在料液比(1∶20)、酶解2 h、酶解温度50 ℃、pH7.5条件下,探讨加酶量(1000、3000、5000、7000、9000、11000、13000 U/g)对酶解产物的水解度体外清除DPPH自由基能力的影响。
1.2.4.2 酶解温度对酶解效果的影响 选用动物蛋白水解酶在料液比(1∶20)、酶解2 h、加酶量5000 U/g、pH7.5条件下,探讨酶解温度(30、40、50、60、70 ℃)对酶解产物的水解度与体外清除DPPH自由基能力的影响。
1.2.4.3 pH对酶解效果的影响 选用动物蛋白水解酶在料液比(1∶20)、酶解2 h、加酶量5000 U/g、温度50 ℃条件下,探讨pH(5.5、6.5、7.5、8.5、9.5)对酶解产物的水解度与体外清除DPPH自由基能力的影响。
1.2.5 响应面试验 使用Design Expert软件进行Box-Behnken试验设计,以单因素试验结果为基础,以温度(A)、加酶量(B)和pH(C)为自变量,以体外清除DPPH自由基率为响应值,设计3因素3水平实验,确定酶解工艺最佳条件。实验因素及其水平的取值见表1。

表1 响应面试验因素水平表Table 1 Factors and levels table for respond surface methodology
1.2.6 酶解多肽体外抗氧化活性的测定 根据1.2.5响应面法获得的酶解优化工艺制备仿刺参多肽,灭酶后10000 r/min离心10 min,取上清液冻干,获得仿刺参体壁酶解多肽(Apostichopusjaponicusbody wall enzymolysis polypeptide,AJEP)冻干粉。采用DPPH法、Fenton法、黄嘌呤法、FRAP法,分别按照文献[10]、羟自由基测试试剂盒、超氧阴离子自由基测定试剂盒、总抗氧化能力(T-AOC)检测试剂盒说明书操作,按照公式(3~6)计算仿刺参酶解多肽的体外抗氧化活性。
DPPH自由基清除率(%)
式(3)
式(4)
超氧阴离子自由基清除率(%)
式(5)
式(6)
1.2.7 H2O2氧化应激损伤EA.hy926细胞模型的建立 取对数生长期的EA hy.926细胞,以2.5×104/mL细胞数接种于96孔板,每孔200 μL,在37 ℃、5% CO2条件下培养16~24 h贴壁后,弃原培养基,按梯度加入用DMEM培养基配制的H2O2溶液(50、100、150、200、300、400、500、600、700、800、900 μmol/L),设空白对照组。培养4 h后,小心吸去孔内液体,加入100 μL MTS应用液,培养2 h后,用酶标仪(490 nm)测定各孔吸光值。按照公式(7)计算细胞抑制率,使用Graphpad prism 6.0软件非线性回归分析,计算获得H2O2诱导EA.hy926氧化应激产生50%损伤的半抑制浓度IC50。

式(7)
1.2.8 抗氧化多肽对H2O2诱导血管内皮细胞氧化损伤的保护作用 称取一定量AJEP,使用DMEM培养基配制成不同浓度梯度的酶解多肽(低剂量组:0.05 mg/mL、中剂量组:0.5 mg/mL、高剂量组:5 mg/mL)。采用1.2.7方法,接种细胞贴壁后,弃原培养基,按梯度加入样品组,设空白对照组、H2O2组。不同组处理情况为:空白对照组:原DMEM培养基;样品组:低剂量组:0.05 mg/mL AJEP,中剂量组:0.5 mg/mL AJEP,高剂量组:5 mg/mL AJEP;H2O2组:0.05 mg/mL AJEP+200 μmol/L H2O2,0.5 mg/mL AJEP+200 μmol/L H2O2,5 mg/mL AJEP+200 μmol/L H2O2。预处理24 h后,加入用DMEM培养基配制的H2O2(半数抑制浓度)处理4 h,小心吸去孔内液体,加入100 μL MTS应用液,培养2 h后,检测各孔吸光值。按照公式(8)计算细胞存活率。

式(8)
1.2.9 细胞氧化及抗氧化水平测定 取对数生长期的EA hy.926细胞,以2.5×104/mL细胞数接种于60 mm培养皿,每皿4 mL,分组及处理如1.2.8所述,终止培养后,弃原培养基后用D-PBS清洗2次,用细胞刮刀刮下细胞,D-PBS清洗2次,离心、弃上清,4 ℃进行细胞破碎,离心、取上清液,分别按照细胞丙二醛(MDA)测定试剂盒、总超氧化物歧化酶(SOD)测定试剂盒说明书操作,按照公式(9~10)计算MDA和SOD含量。

式(9)

式(10)
1.3 统计学分析

2 结果与分析
2.1 最适蛋白酶类型的筛选
采用中性蛋白酶、胃蛋白酶、碱性蛋白酶、风味蛋白酶、木瓜蛋白酶、动物蛋白水解酶等6种酶在相同的初始底物浓度、酶浓度、各自适合的酶解温度、pH条件下对仿刺参体壁进行酶解,水解度、体外DPPH自由基清除率结果见图1~图2,选取6 h酶解液测定其相对分子质量分布情况,结果见表2。不同酶的活性部位和底物特异性不同,水解能力存在差异。由图1可知,随着时间增加,动物蛋白水解酶、风味蛋白酶酶解液水解度逐渐大于其余酶类型,说明这两种酶与仿刺参可酶解肽键结合能力较好,具有较强的水解仿刺参蛋白的能力。酶解初始,仿刺参表面可溶性蛋白较易扩散到溶液中与酶接触,肽键不断水解,游离氨基酸、寡肽含量增多,水解度迅速增大;随着反应进行,可酶解肽键浓度下降,产物浓度增加对酶解反应起反馈抑制作用,水解速率趋缓,水解度趋于平衡。由图1可知,6种酶酶解液水解速率均在初始60 min内增速较快,之后随时间延长、水解度增加而减缓,在反应进行240 min之后,水解度趋于稳定。

图1 仿刺参酶解过程中不同种类酶酶解产物水解度的变化Fig.1 Change of hydrolysis degree of hydrolysates of Apostichopus japonicus by different enzymes during enzymolysis
不同蛋白酶与底物的作用位点不同,酶解产物的肽链结构不同,功能活性亦不同。由图2可知,在考察时间内中性蛋白酶和动物蛋白水解酶酶解产物对DPPH自由基清除活性均大于其余酶类型,说明中性蛋白酶和动物蛋白水解酶对仿刺参蛋白具有较好的抗氧化活性酶切位点与特异性。6种蛋白酶的酶解产物体外DPPH自由基清除率均随酶解时间的延长而增加,在最初的60 min内迅速增加,后随时间延长而增速变缓,于酶解120 min后趋于平稳。

图2 仿刺参酶解过程中不同种类酶酶解产物体外DPPH自由基清除率的变化Fig.2 Change of DPPH free radical scavenging abilities in vitro of hydrolysates of Apostichopus japonicusby different enzymes during enzymolysis
酶解产物的功能活性与其氨基酸组成有直接关系,近年来研究发现,特定功能活性肽多是小分子多肽[16]。由表2可知,不同蛋白酶酶解产物相对分子质量分布存在差异,风味蛋白酶、动物蛋白水解酶酶解产物中相对分子质量小于1000 Da的组分占比明显高于其余4种酶解物,含量分别为95.64%和90.13%,说明风味蛋白酶、动物蛋白酶酶解产物中2~6个氨基酸组成的小分子多肽比例较高,这两种酶有较好的水解仿刺参蛋白制备小分子多肽或氨基酸的能力。风味蛋白酶酶解产物中100~300 Da组分含量最高,占比为62.78%,说明风味蛋白酶酶解物中游离氨基酸、二肽较多;动物蛋白水解酶酶解产物中300~600 Da组分占比最高,占比为45.81%,说明动物蛋白水解酶酶解物中小分子短肽较多。

表2 仿刺参酶解过程不同酶解产物分子量分布Table 2 Relative molecular weight distribution of different enzymatic hydrolysates of Apostichopus japonicus
综上可知,与其余5种蛋白酶相比,动物蛋白水解酶能较好地水解仿刺参体壁,酶解120 min时,其产物的体外DPPH自由基清除活性较高且趋于稳定,其中相对分子质量小于1000 Da的小分子多肽含量达90.13%,因此,选择动物蛋白水解酶作为最适蛋白酶,进一步优化酶解工艺。
2.2 单因素实验结果
2.2.1 温度对酶解效果的影响 由图3可知,在30~70 ℃范围内,酶解产物的水解度和体外DPPH自由基清除率随着温度的递增呈现先升后降的趋势。当温度在30~50 ℃时,水解度和清除率随着温度递增而迅速增加;当温度在50~70 ℃时,水解度和清除率随着温度递增而迅速递减。温度对酶活力具有激活效应和失活效应,当温度低于最适温度时,随着温度升高,酶促反应加快;当温度高于最适温度,酶分子结构发生改变,酶活丧失,反应速度下降。考虑到实际生产成本等因素,最适温度选择50 ℃。

图3 温度对酶解产物水解度和体外DPPH自由基清除率的影响 Fig.3 Effects of temperatures on the hydrolysis degree and DPPH radical scavenging rate of the enzymatic hydrolysates in vitro
2.2.2 加酶量对酶解效果的影响 由图4可知,酶解产物的水解度和体外DPPH自由基清除率随着加酶量的增加而增加。当加酶量在1000~7000 U/g时,水解度和清除率随着加酶量的增加而迅速增加;当加酶量在7000~13000 U/g时,水解度和DPPH自由基清除率增速渐缓,趋于极限。考虑到实际生产成本等因素,最适加酶量选择7000 U/g。

图4 加酶量对酶解产物水解度和体外DPPH自由基清除率的影响 Fig.4 Effects of enzyme dosage on the hydrolysis degree and DPPH radical scavenging rate of the enzymatic hydrolysates in vitro
2.2.3 pH对酶解效果的影响 由图5可知,酶解产物的水解度和体外DPPH自由基清除率随着pH的递增呈现先升后降的趋势。当pH在5.5~7.5时,水解度和体外DPPH自由基随着pH的增加而增加;当pH在7.5~9.5时,水解度和体外DPPH自由基随着pH的增加而减少。pH是酶促反应的重要影响因素,过高或过低将使酶活性结构发生不可逆转的变化,同时改变底物解离程度,进而影响酶与底物结合,使酶解效率下降。因此,选择最适pH为7.5。

图5 pH对酶解产物水解度和体外DPPH自由基清除率的影响 Fig.5 Effect of pH on the hydrolysis degree and DPPH radical scavenging rate of the enzymatic hydrolysates in vitro
2.3 响应面优化试验结果
2.3.1 响应面模型的建立和显著性检验 以温度(A)、加酶量(B)和pH(C)为试验因素,以体外DPPH自由基清除率为响应值,进行三因素三水平的响应面分析试验,试验设计和结果分析见表3。
利用Design Expert 8.0软件对表3进行二次多元回归拟合,得到DPPH清除率对温度、加酶量和pH的二次多项回归方程:

表3 响应面试验设计及结果Table 3 Design and results of response surface experiment
R1=68.25+0.90A+0.31B+0.16C+2.500E-0.05AB-0.13AC-0.082BC-3.29A2-0.62B2-1.63C2。
回归模型方差分析(表4)表明,建立的回归模型p值(0.0018)<0.01,极显著;失拟项p值(0.9375)>0.05,不显著,表明模型和试验值拟合度良好。通过对p值的检验可见,对结果的影响大小为A>B>C,即温度>加酶量>pH,二次项A2、C2对响应值DPPH清除率的影响极显著(p<0.01),一次项A对响应值DPPH清除率的影响显著(p<0.05),其余项影响不显著(p>0.05),说明响应面主效应显著,各因素之间交互作用较小。模型R2为0.9385,调整后R2为0.8595,Rsn2=9.816,说明该模型具有较好的预测作用。由上述分析可知,该模型很好地反映了DPPH清除率和酶解温度、加酶量、pH之间的关系,可以使用此模型对动物蛋白水解酶制备仿刺参抗氧化多肽的酶解工艺进行优化分析和预测。

表4 方差分析结果Table 4 Variance analysis results
2.3.2 响应面交互作用分析 等高线图和3D响应面可以直观地展现酶解温度、加酶量、pH之间的交互关系。从图6中各个等高线可直观发现,温度的变化对DPPH清除率的影响明显高于加酶量。温度和pH的等高线形状趋于圆形,表明其交互作用较弱,而pH的变化对DPPH清除率的影响明显高于加酶量。
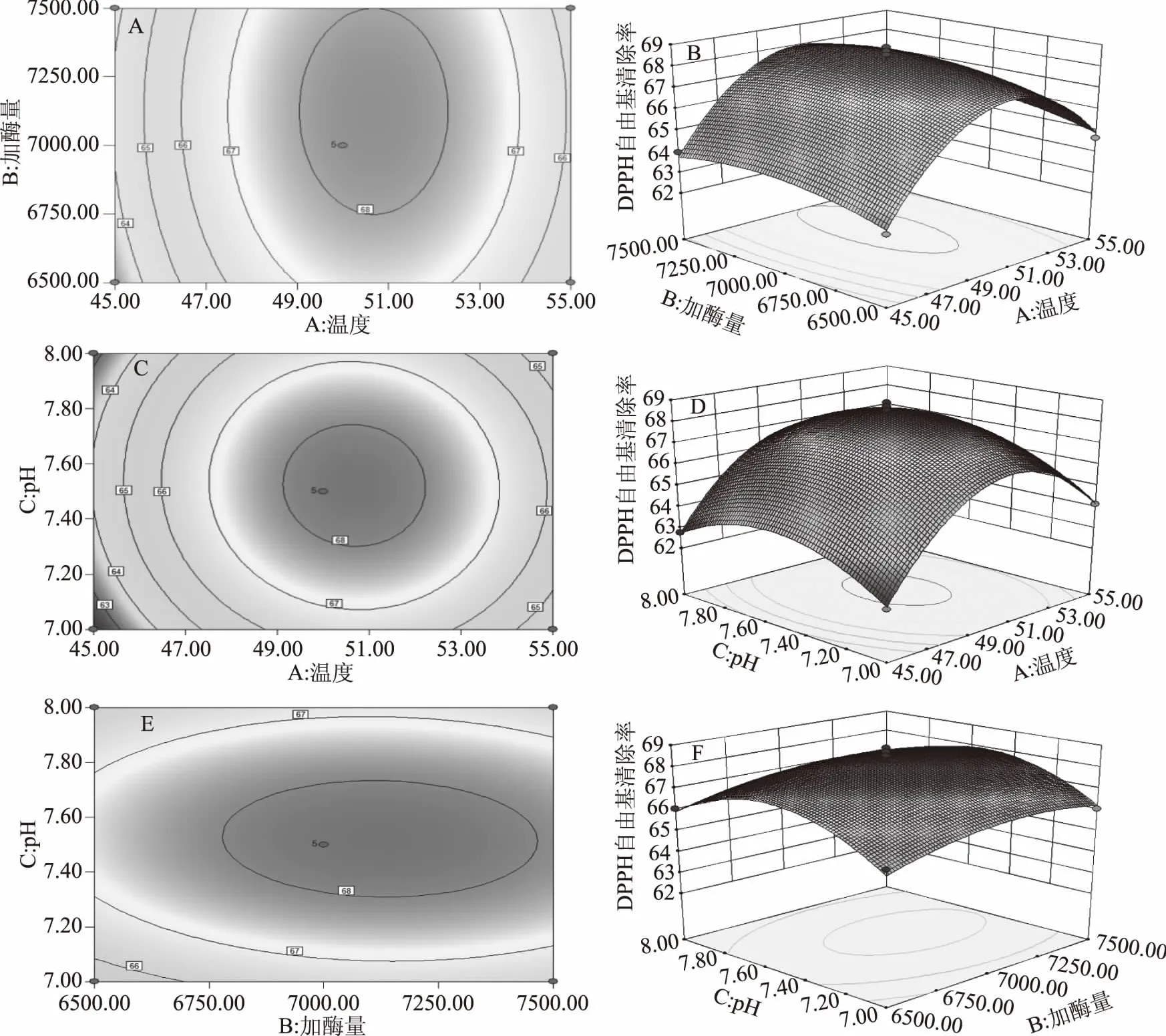
图6 两因素之间的交互作用对DPPH自由基清除率的影响Fig.6 Effect of two factors intercction on DPPH radical scavenging rate
通过Design Expert 8.0软件对回归方程的分析,得到各因素最佳条件为:温度50.68 ℃、加酶量7123.19 U/g、pH7.52,此模型下,响应值为68.35。考虑到实际情况,结合表3进行调整后的最佳条件为:温度50 ℃、加酶量7000 U/g、pH7.5。
2.3.3 最优条件的确定和验证 为了验证模型的准确性,以酶解温度50 ℃、加酶量7000 U/g、pH7.5,反复试验3次,得到响应值为68.81%,与模型预测值68.35%相对误差为1%,表明回归模型可以很好地预测动物蛋白水解酶制备仿刺参多肽的酶解工艺参数。
2.4 仿刺参酶解多肽的体外抗氧化活性

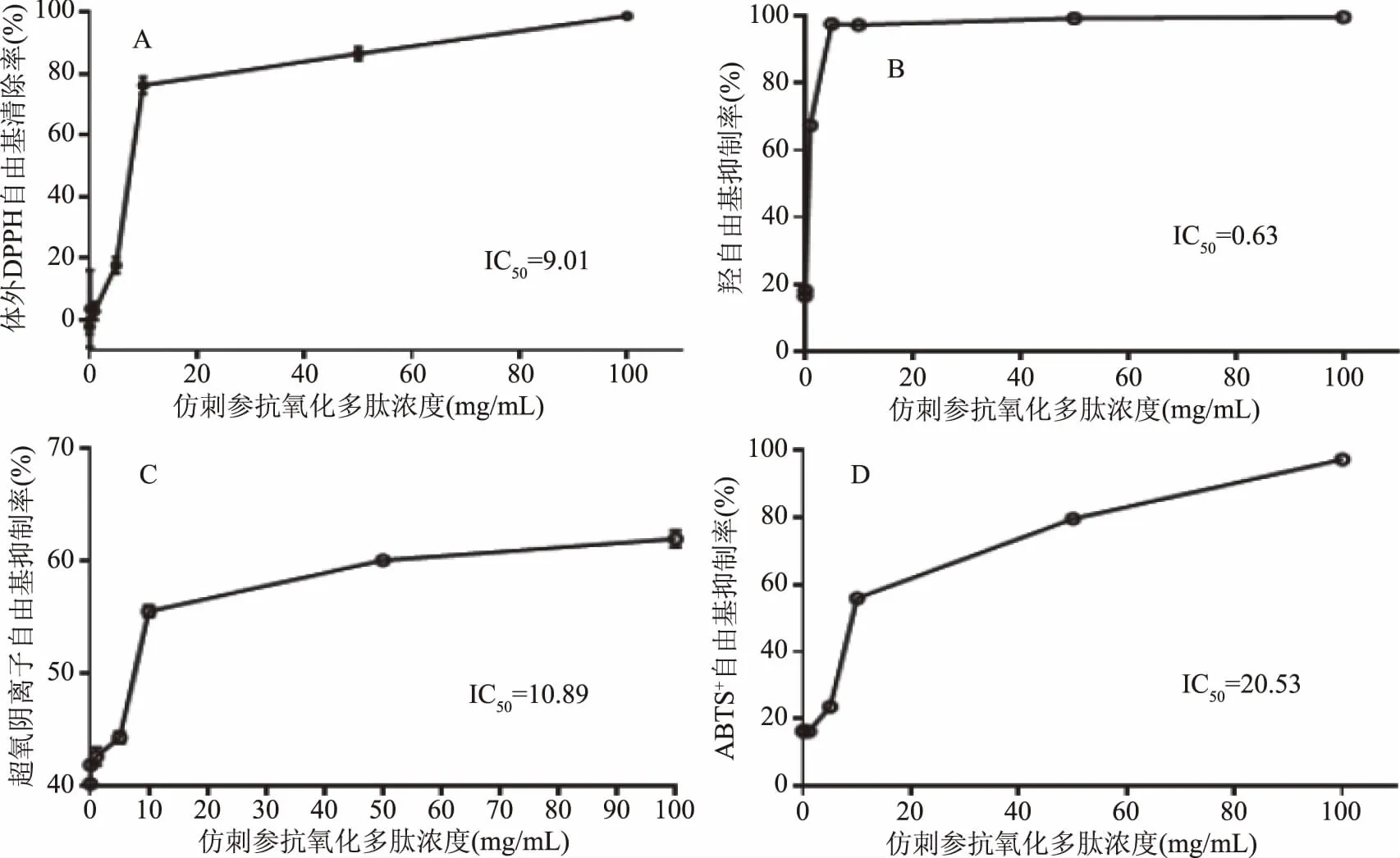
图7 仿刺参体壁酶解多肽的体外抗氧化活性 Fig.7 Antioxidant activities of enzymolysis polypeptide of A.japonicus in vitro
2.5 仿刺参抗氧化多肽对H2O2诱导的人脐静脉内皮细胞EA.hy926损伤的保护作用
2.5.1 H2O2对EA.hy926细胞活性的影响 采用0~900 μmol/L的H2O2构建EA.hy926氧化应激模型,以细胞抑制率作为细胞损伤评价指标。结果由图8可知,H2O2浓度在0~150 μmol/L时,随着剂量的升高,其对内皮细胞活力抑制作用增强,H2O2对细胞损伤相对缓和;浓度在150~900 μmol/L时,细胞抑制率快速升高,呈现显著剂量-效应关系,H2O2对细胞损伤及反应更加强烈。若细胞抑制率过高,说明细胞损伤严重、难以逆转,若细胞抑制率过低,说明细胞损伤不够,均不利于开展损伤保护研究,因此选择对细胞造成半数抑制率的浓度作为造模理想浓度。根据Graphpad软件计算获得H2O2的半数抑制浓度(IC50)值约为185.90 μmol/L,考虑到实际操作情况,选取200 μmol/L H2O2浓度建立损伤模型。
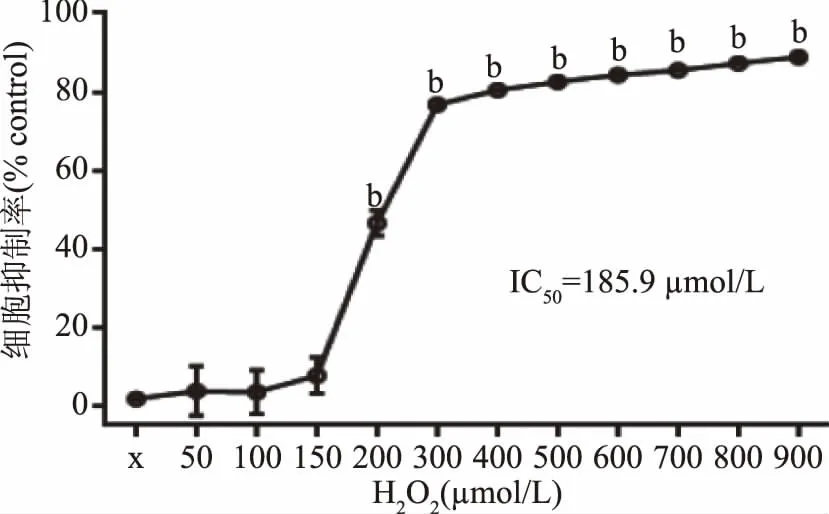
图8 过氧化氢(H2O2)对人脐静脉内皮细胞EA.hy926活性的影响(n=3)Fig.8 Effect of different concentrations of H2O2 on EA.hy926(n=3)注:a表示与空白对照组相比差异显著(p<0.05),b表示与空白对照组相比差异极显著(p<0.01)。
2.5.2 抗氧化多肽对EA.hy926细胞氧化应激损伤的保护作用 由表5可知,人脐静脉内皮细胞EA.hy926中加入不同剂量浓度的仿刺参多肽AJEP,培养24 h后,与空白对照组相比,低、中、高剂量组细胞存活率均在90%以上,说明AJEP对EA.hy926细胞无明显毒副作用。而后选择200 μmol/L H2O2处理4 h,与空白对照组比较,H2O2组细胞存活率差异极显著(p<0.01),为42.75%±1.27%,说明氧化应激损伤模型成功可靠。以低、中、高剂量AJEP处理EA.hy926细胞24 h后,200 μmol/L H2O2处理4 h后,与H2O2组相比,在0.05~5 mg/mL 浓度范围内,随着浓度的增加,AJEP对EA.hy926细胞的保护率明显增加,死亡数量下降,中、高剂量组细胞存活率分别为57.33%±4.27%(p<0.05)和85.56%±2.23%(p<0.01),均在50%以上,说明中、高浓度仿刺参抗氧化多肽对H2O2诱导人脐静脉内皮细胞的氧化应激损伤具有显著保护效应。

表5 仿刺参抗氧化多肽对人血管内皮细胞氧化损伤的保护作用(n=3)Table 5 Effect of enzymolysis polypeptide of A.japonicuson EA.hy926 cells viability injured by H2O2(n=3)
2.5.3 抗氧化多肽对EA.hy926细胞氧化应激损伤MDA含量、SOD活性的影响 以MDA含量和SOD活性作为EA.hy926细胞氧化应激水平的氧化和抗氧化检测指标。由表6可知,与空白对照组比较,H2O2诱导的氧化应激损伤EA.hy926细胞中MDA含量显著升高(p<0.05),SOD活性极显著降低(p<0.01);而经过仿刺参酶解抗氧化多肽预处理的EA.hy926细胞中,随着AJEP浓度提高,MDA含量降低,SOD活性增强,呈剂量-效应关系;与H2O2损伤组比较,中剂量AJEP组SOD活性极显著升高(p<0.01),而MDA含量差异不显著(p>0.05),高剂量AJEP组MDA含量显著降低、SOD活性显著升高(p<0.05)。

表6 仿刺参抗氧化多肽对人血管内皮细胞氧化损伤的MDA、SOD的影响(n=3)Table 6 Effect of enzymolysis polypeptide ofA.japonicus on MDA and SOD expression in EA.hy926 cells injured by H2O2(n=3)
3 结论

