白藜芦醇对晚期糖基化终末产物诱导INS-1细胞损伤的保护作用及机制
2018-12-26,,,,,*
,, , ,,*
(1.江汉大学武汉生物医学研究院,湖北武汉 430056; 2.太和医院临床营养科,湖北十堰 442008)
晚期糖基化终末产物(Advanced glycation end products,AGEs)是在持续的高血糖状态下,高糖与蛋白质通过非酶促反应形成稳定的不可逆的终末产物[1-2]。AGEs在组织器官内,尤其是血管内皮、上皮细胞处逐渐蓄积,进而诱导一系列炎症和氧化应激等级联反应[3-4],因而在糖尿病及其并发症,如糖尿病肾病、动脉粥样硬化和糖尿病视网膜病变的发生发展中起着重要作用[5-8]。新近研究表明,AGEs还可直接诱导胰岛β细胞凋亡,并导致胰岛β细胞合成胰岛素功能障碍[9]。因此,深入研究AGEs对胰岛β细胞损伤的作用机制,以及开发有效的干预保护药物,对临床防治糖尿病及其并发症的发生发展均具有重要意义。
白藜芦醇(Resveratrol,RSV)是一种多酚类化合物,主要存在于花生、葡萄、虎杖、桑椹等植物中,最早于1924年被发现[10-11],随着人们对RSV的深入研究发现,RSV具有抗氧化、抗炎、抗衰老和免疫调节等多种药理作用[12]。然而,目前关于RSV对AGEs的干预研究主要集中在血管内皮、上皮细胞上[13-14],对胰岛β细胞损伤的保护作用未见文献报道。因此,研究RSV对INS-1细胞AGEs损伤的保护作用及机制,对防治糖尿病具有重要意义。
本实验以大鼠胰岛素瘤细胞INS-1为研究对象,通过体外合成糖化血清(Glycated serum,GS),并使用含有AGEs的GS构建INS-1细胞损伤模型[15],观察不同剂量RSV对AGEs损伤的胰岛细胞的保护作用,并初步探讨其抗氧化应激作用机制。
1 材料与方法
1.1 材料与仪器
大鼠胰岛素瘤细胞(INS-1) 上海博谷生物科技有限公司;RPMI-1640培养基、胎牛血清(Fetal bovine serum,FBS)、0.25%胰蛋白酶消化液、磷酸缓冲盐溶液(PBS)、青链霉素溶液 Gibco公司;超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、还原性谷胱甘肽(Glutathione,GSH)检测试剂盒和丙二醛(Malondialdehyde,MDA)检测试剂盒 南京建成生物工程研究所;Mouse AGEs ELISA Kit检测试剂盒 武汉贝茵莱生物科技有限公司;TNF-α检测试剂盒 美国Biosource公司;BCA蛋白浓度检测试剂盒 武汉博士德生物工程有限公司;一氧化氮(Nitric oxide,NO)检测试剂盒 碧云天生物技术研究所;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)、2,7-二氯荧光黄双乙酸盐(2,7-Dichlorodi-hydrofluorescein diacetate,DCFH-DA)荧光探针、二甲基亚砜(Dimethyl sulfoxide,DMSO)、白藜芦醇(Resveratrol,RSV) Sigma公司;牛血清白蛋白(Bovine albumin,BSA) Biosharp生物科技公司;D-葡萄糖 上海生工生物工程股份有限公司进口分装;RPMI-1640完全培养基(包含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)。
Heraguard ECO型超净工作台、371型CO2培养箱、Multi skan FC型全波长酶标仪、Multiskan Spectrum型荧光酶标仪、Heraeus Multifuge X1R型台式离心机、PICO 17型离心机、240 VAC型微孔板振荡器 Thermo Scientific公司;Nikon Ts 2型倒置显微镜 尼康映像仪器销售有限公司;TDZ4-WS型台式低速离心机 湖南赫西仪器装备有限公司;UP-250型超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 GS的制备及AGEs浓度测定 GS的制备参考Zhu等[15]的方法稍加修改,即4.5 g的D-葡萄糖溶解于50 mL胎牛血清中,旋涡器下混合均匀,混合液澄清且无可见固态物质表示完全溶解。0.22 μm微孔滤膜过滤除菌,37 ℃恒温避光孵育3周。孵育结束后,用pH=7.4的PBS进行透析,薄层色谱法[16]验证D-葡萄糖被完全去除后,再次用0.22 μm微孔滤膜过滤除菌,分装成5 mL/支,-20 ℃保存,此为GS。
ELISA试剂盒检测GS中AGEs的含量(注意将受试GS调整至试剂盒检测浓度范围),严格按照AGEs试剂盒说明书上的步骤进行操作,以标准品的浓度为横坐标,A值为纵坐标,先绘制出标准曲线,再用标准品的浓度与A值计算出标准曲线的回归方程式,最后将样品的A值代入方程式,还原稀释倍数,计算出GS中AGEs的浓度。
1.2.2 INS-1细胞培养及分组 INS-1细胞用RPMI-1640完全培养基培养,其中含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素,置于5% CO2、37 ℃恒温培养箱中孵育48 h,倒置显微镜下观察细胞生长情况,细胞融合度(贴壁细胞占整个培养瓶面积的比例)达到80%~90%时,以1∶2~1∶3比例传代。
1.2.2.1 细胞造模实验 实验共分为4组,分别加入不同浓度的GS(0、5%、10%、20%),MTT法检测细胞增殖率,确定后续实验中最适GS的浓度。
1.2.2.2 受试物剂量摸索实验 实验共分为9个组,分别加入不同浓度的RSV(0、3.125、6.25、12.5、25、50、100、200、400 μmol/L),MTT法检测细胞增殖率,确定后续实验中RSV的使用浓度范围。
1.2.2.3 最终受试物保护功能实验 实验共分为5个组,分别为对照组、20% GS模型组、20% GS+25 μmol/L RSV组、20% GS+50 μmol/L RSV组、20% GS+100 μmol/L RSV组,MTT法检测细胞增殖率,探讨RSV对AGEs损伤INS-1细胞的保护作用。
1.2.3 INS-1细胞增殖率的测定 INS-1细胞增殖率测定采用MTT法。细胞培养48 h,融合度达到80%~90%时,0.25%胰蛋白酶消化,室温下,1000 r/min离心5 min,1640完全培养液重悬细胞,并将密度调整约为1×105个/mL,取100 μL/孔接种至96孔板中,5% CO2、37 ℃培养箱中孵育24 h,然后按实验分组分别加入20% GS、20% GS+25 μmol/L RSV、20% GS+50 μmol/L RSV和20% GS+100 μmol/L RSV,150 μL/孔,每组设置6个复孔,同时设立无药对照孔和无细胞空白孔,培养箱中继续孵育48 h。处理结束后,倒置显微镜下观察细胞形态并拍照,然后加入15 μL的无菌MTT(5 mg/mL)溶液,置于培养箱中继续培养4 h。处理结束后小心吸弃上清,每孔加入150 μL DMSO,室温下,微孔板振荡器充分振荡使紫色结晶完全溶解,酶标仪570 nm波长检测吸光度值(A),计算细胞增殖率(%)=(A样品组-A空白组)/(A对照组-A空白组)×100
1.2.4 细胞裂解液中SOD酶活力和GSH含量的测定 INS-1细胞接种、分组给药和孵育时间与上述1.2.3一致。处理结束后,收集细胞培养液上清-20 ℃保存,然后用无菌PBS洗涤3次,0.25%胰蛋白酶消化后,室温下,1000 r/min离心5 min,弃上清加适量的PBS重新悬浮细胞,冰浴下,超声破碎细胞,超声条件为:20 KHz,持续5 s,间隔10 s,重复三次。4 ℃,12000 r/min离心15 min,取上清,严格按照SOD和GSH试剂盒说明书上的操作步骤,测定各组细胞中SOD活力和GSH含量,每组做三个重复,同时使用BCA法测定总蛋白浓度。
1.2.5 细胞培养液中NO含量的测定 取1.2.4收集到的细胞培养液,4 ℃,1000 r/min离心10 min,离心后取上清,然后严格按照NO试剂盒说明书上的操作步骤,测定各组细胞培养液中NO的含量,每组做六个重复。
1.2.6 细胞中ROS含量的测定 INS-1细胞接种、分组给药和孵育时间与上述1.2.3一致。吸弃细胞上清,PBS漂洗,加入终浓度为100 μmol/L的DCFH-DA,继续将细胞置于培养箱孵育30 min。弃上清,PBS漂洗3次,充分除去残余的DCFH-DA。PBS收集细胞,荧光酶标仪测定各组吸光度值,测定条件:激发波长485 nm,发射波长538 nm。每组做三个重复。
1.2.7 细胞裂解液中MDA含量的测定 INS-1细胞处理与1.2.4中完全一致。然后严格按照MDA试剂盒说明书上的操作步骤,测定各组细胞中MDA含量,每组做三个重复,同时使用BCA法测定总蛋白浓度。
1.2.8 细胞培养液中TNF-α含量的测定 取1.2.4收集到的细胞培养液,4 ℃,1000 r/min离心10 min,离心后取上清,然后严格按照TNF-α试剂盒说明书上的操作步骤,测定各组细胞培养液中TNF-α的含量,每组做六个重复。
1.3 统计学分析
所有数据均采用SPSS 18.0软件进行统计分析,各组间比较采用单因素方差分析(One Way ANOVA),以p<0.05表示差异有统计学意义,用GraphPad Prism 5作图,结果用实验的平均值±标准差表示。
2 结果与分析
2.1 GS中AGEs浓度的分析
ELISA试剂盒检测GS中AGEs的含量,以标准品的浓度为纵坐标,A值为横坐标,先绘制出标准曲线,再用标准品的浓度与A值计算出标准曲线的回归方程式:y=110.8x2+1045x-42.61(如图1所示),最后将样品的A值代入方程式,计算出GS中AGEs的浓度,计算得出GS中AGEs的浓度为(47.80±0.18) μg/mL。

图1 计算GS中AGEs含量的标准曲线方程Fig.1 Standard curve equction for calculating AGEs content in GS
2.2 GS对INS-1细胞增殖率的影响
GS对INS-1细胞增值率的影响实验结果如图2所示,与对照组相比,用5%、10%、20%的GS处理INS-细胞后,细胞增殖率均极显著降低(p<0.01),表明GS能明显抑制INS-1细胞增殖。其中20% GS对INS-1细胞增殖率抑制最明显,因此,在后续的实验中,采取20% GS来建立细胞损伤模型。

图2 GS对INS-1细胞增殖率的影响Fig.2 Effect of GS on proliferation rate of INS-1 cells 注:与对照组相比,**p<0.01表示极显著差异,图3同。
2.3 RSV对INS-1细胞增殖率的影响
RSV对INS-1细胞增殖率的影响如图3所示,与对照组比较,25、50和100 μmol/L的RSV处理组细胞存活率极显著升高(p<0.01),表明RSV能显著提高INS-1细胞的增殖。200和400 μmol/L的RSV处理组细胞增殖率极显著降低(p<0.01),表明高浓度的RSV对INS-1细胞具有明显的毒性作用。因此后续将使用25、50和100 μmol/L的RSV在GS损伤细胞模型中进行实验。

图3 RSV对INS-1细胞增殖率的影响Fig.3 Effect of RSV on proliferation rate of INS-1 cells
2.4 RSV对AGEs损伤INS-1细胞生长的影响
2.4.1 对INS-1细胞增殖率的影响 实验结果如图4所示,与对照组相比,20% GS模型组细胞增殖率极显著降低(p<0.01);与20% GS模型组相比,RSV(25 μmol/L)组INS-1细胞增殖率极显著升高(p<0.01);RSV(50 μmol/L)组INS-1细胞增殖率显著升高(p<0.05);RSV(100 μmol/L)组INS-1细胞增殖率无显著差异(p>0.05)。因此,后续将使用25和50 μmol/L的RSV进一步进行RSV的保护作用及机制研究。
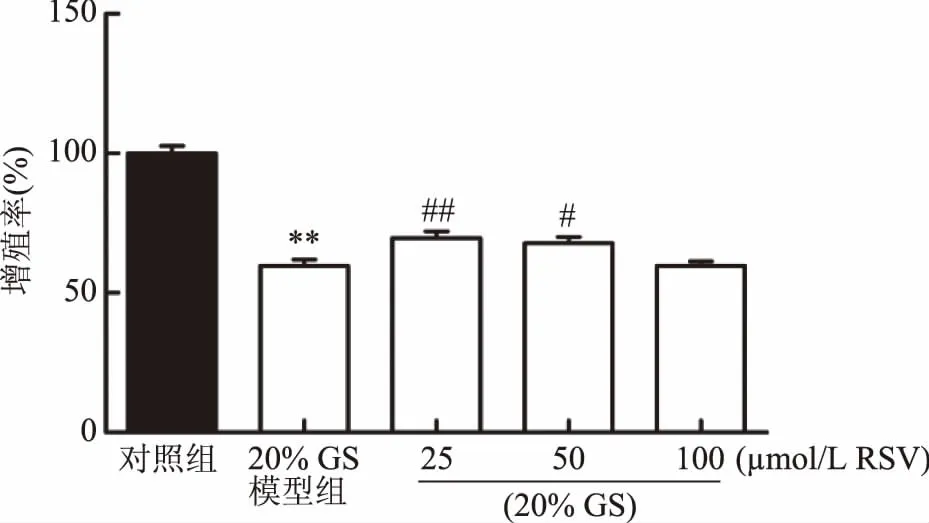
图4 RSV对GS损伤INS-1细胞增殖率的影响Fig.4 Effect of RSV on proliferation rate of GS injured INS-1 cells注:与对照组相比,*p<0.05表示显著差异,**p<0.01表示极显著差异;与20% GS模型组相比,#p<0.05表示显著差异,##p<0.01表示极显著差异;图6~图8同。
2.4.2 INS-1细胞的生长形态的变化 RSV对AGEs损伤INS-1细胞的生长情况如图5所示,对照组细胞生长形状规则,多呈梭型,紧贴在培养板壁上;20% GS模型组视野中细胞数目明显减少,细胞处于半贴壁状态,多呈椭圆形;与20% GS模型组比,25和50 μmol/L的RSV组细胞数目明显增多,细胞贴壁情况也较好,大部分呈梭型,少部分呈椭圆形。

图5 光学显微镜下观察INS-1细胞的生长形态(100×)Fig.5 Growth morphology of INS-1 cells under optical microscope(100×)
2.5 RSV对AGEs诱导的INS-1细胞SOD活性和GSH含量的影响
RSV对AGEs诱导INS-1细胞氧化应激反应的影响实验结果如图6所示,与对照组相比,20% GS模型组细胞的SOD活性和GSH含量极显著降低(p<0.01);与20% GS模型组相比,25和50 μmol/L的RSV组细胞的SOD活性和GSH含量极显著升高(p<0.01)。

图6 RSV对AGEs诱导的INS-1细胞SOD活性和GSH含量的影响Fig.6 Effects of RSV on SOD activities and GSH content in INS-1 cells induced by AGEs
2.6 RSV对AGEs诱导INS-1细胞NO、ROS和MDA含量的影响
RSV对AGEs诱导INS-1细胞产生有害自由基的保护作用实验结果如图7所示,与对照组相比,20% GS模型组细胞培养液中的NO和细胞内的ROS、MDA含量显著升高(p<0.05);与20% GS模型组相比,25和50 μmol/L的RSV组细胞培养液中的NO含量极显著降低(p<0.01),50 μmol/L的RSV组细胞内的ROS含量显著降低(p<0.05),25 μmol/L的RSV组细胞内的ROS含量有下降趋势,但无显著差异(p>0.05),25 μmol/L的RSV组细胞的MDA含量显著降低(p<0.05),50 μmol/L的RSV组细胞的MDA含量有降低趋势,但无显著差异(p>0.05)。
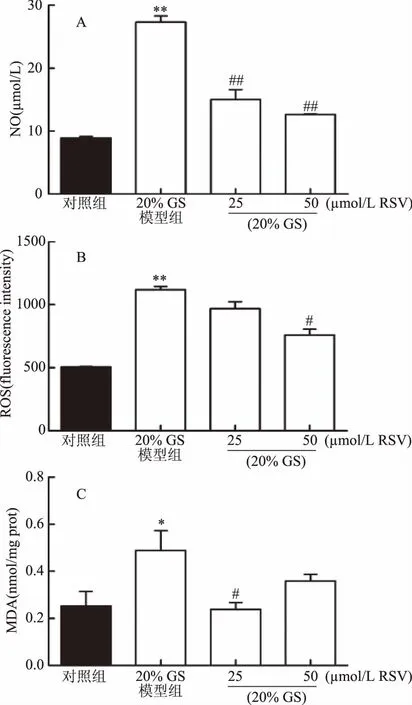
图7 RSV对AGEs诱导INS-1细胞NO、ROS和MDA含量的影响Fig.7 Effects of RSV on the content of No,ROS and MDA in INS-1 cells induced by AGEs
2.7 RSV对AGEs诱导INS-1细胞TNF-α表达的影响
RSV对AGEs诱导INS-1细胞生成炎性因子的影响实验结果如图8所示,与对照组相比,20% GS组细胞培养液中的TNF-α含量极显著升高(p<0.01);与20% GS组相比,25和50 μmol/L的RSV组细胞培养液中的TNF-α含量极显著降低(p<0.01)。

图8 RSV对AGEs诱导INS-1细胞TNF-α表达的影响Fig.8 Effects of RSV on TNF-α expression of INS-1 cells induced by AGEs
3 讨论与结论
糖尿病是一种复杂的、受多因素影响的慢性代谢性疾病,胰岛β细胞的功能障碍和凋亡是糖尿病病程中持续高血糖的主要原因[17-19]。新近研究表明,AGEs与胰岛β细胞功能障碍或凋亡关系密切[20]。细胞和动物实验中发现,AGEs可引起胰岛β细胞凋亡并导致胰岛β细胞合成胰岛素功能障碍[21]。本实验结果显示,含一定浓度AGEs的GS能明显抑制INS-1细胞的增殖,且GS浓度越高,细胞增殖率越低,此结果与相关文献报道一致[15]。20% GS模型组INS-1细胞的SOD活性和GSH含量极显著降低(p<0.01),NO、ROS和MDA含量显著升高(p<0.05),TNF-α合成和释放极显著增加(p<0.01)说明GS对INS-1细胞具有氧化应激损伤和炎性损伤作用。
RSV已被证明具有抗氧化、抗炎、抗衰老和免疫调节等多种药理作用[12,22]。本实验结果显示,25和50 μmol/L浓度的RSV能明显提高GS损伤INS-1细胞的增殖率,表明RSV对GS造成的胰岛β细胞损伤具有明显的保护作用。此结果与现有RSV对血管内皮细胞糖基化损伤的保护作用的研究结果相符合[14]。鉴于目前还没有以AGEs为靶点的临床治疗药物,因此深入研究RSV对AGEs损伤胰岛β细胞的保护作用具有重要意义。
RSV(25和50 μmol/L)与20% GS共处理后,INS-1细胞的SOD活性和GSH含量极显著升高(p<0.01),说明RSV能够显著增强INS-1细胞的抗氧化能力,降低AGEs诱导的氧化损伤;25和50 μmol/L的RSV组NO合成和分泌水平极显著下降(p<0.01),50 μmol/L的RSV组ROS含量显著降低(p<0.05),25 μmol/L的RSV组MDA含量下显著降低(p<0.05),说明了RSV能够显著增强细胞清除细胞内有害自由基的能力,降低自由基引发的脂质过氧化反应;25和50 μmol/L的RSV组均能极显著降低(p<0.01)INS-1细胞的TNF-α水平,说明了RSV能够明显降低炎性因子合成和分泌。表明RSV可以有效缓解由AGEs引起的氧化应激和炎症反应,从而对胰岛β细胞损伤具有保护作用。
综上所述,AGEs对INS-1细胞生长具有明显抑制作用,并能促进INS-1细胞氧化应激和炎症发应。RSV能显著抑制AGEs诱导的氧化应激和炎症反应,显著提高AGEs损伤细胞的增殖率,表明了RSV对AGEs造成细胞损伤具有显著的保护作用,其机制可能是因为RSV在一定程度上能够增强INS-1细胞清除自由基的能力,提高INS-1细胞的抗氧化能力,降低INS-1细胞炎性因子水平。这为进一步深入研究AGEs对胰岛β细胞损伤的作用机制以及开发有效的干预保护药物,为今后RSV在临床防治糖尿病上提供了有力的实验基础。
