大豆胰蛋白酶抑制剂的异源表达与生化特性解析
2018-12-26正祥
, , ,,, ,,正祥,
(1.天津科技大学生物工程学院,天津 300457; 2.天津科技大学化工与材料学院生物化工系,天津 300457)
丝氨酸蛋白酶抑制剂是通过与丝氨酸蛋白酶形成复合物使其部分或完全失活的一类物质的总称,它普遍存在于动物、植物和微生物中[1]。根据氨基酸排列顺序、拓扑学性质及结合机制的不同,可以将其分为16个家族,已从植物中发现了7个家族[2]。其中,大豆胰蛋白酶抑制剂(Soybean trypsin inhibitiors,STIs)是豆科植物中起主要作用的丝氨酸蛋白酶抑制剂,包括已经发现的Kunitz类抑制剂(KTI)和Bowman-Birk类抑制剂(BBT)两种类型[3-4]。因其具有调理内源蛋白酶活性、贮藏蛋白、抗虫以及抗病原菌等生理功能,胰蛋白酶抑制剂在食品、农业和医药等领域具有潜在的应用价值[3,5]。
目前,多肽类胰蛋白酶抑制剂的制备方法主要从组织或种子中分离纯化。分离纯化过程需经过水浸、碱提取、分步盐析、离子交换层析和凝胶过滤层析等程序,过程繁琐,耗时长,且产率和纯度较低[6];实验室进行小量纯化时有报道采用溴化氰活化的琼脂糖凝胶进行亲和层析,但其价格昂贵[6]。随着基因工程技术的快速发展,异源表达成为获得胰蛋白酶抑制剂的一条可行途径。
大豆基因组中至少存在10个不同的sti基因[7],其中ksti3基因已经在大豆和杜氏盐藻中进行了克隆表达[2-3,7-8]。本课题组前期通过对大豆基因组中的胰蛋白酶抑制剂基因进行比对和分析,发现了一个新的编码基因sti[7],其理化特性及生理功能等尚未报道。为此,本研究借助于分子克隆技术将其在毕赤酵母中进行了异源表达,经初步纯化后,对其生化特征进行了解析,以期替代现有的胰蛋白酶制备方法,并为其实际应用提供基础材料。
1 材料与方法
1.1 材料与仪器
大肠杆菌JM109、毕赤酵母菌GS115 由本实验室保藏;含有胰酶抑制剂基因sti的重组毕赤酵母菌GS115(pPIC-STI) 由本研究中构建、筛选并保存;毕赤酵母及其重组菌的培养方法(YPD、BMGY以及BMMY等培养基) 按照Invitrogen的毕赤酵母操作手册进行;大肠杆菌 采用LB培养基进行培养;质粒小量抽提试剂盒、PCR产物纯化试剂盒、各种限制性内切酶、T4DNA连接酶、GeneRuler 1 kb DNA Ladder和生物素等 宝生物工程(大连)有限公司;蛋白分子量标准、遗传霉素(G418)、无氨基酵母氮源(YNB)和氨苄青霉素等 Invitrogen公司;酵母抽提物和胰蛋白胨等 英国OXOID公司;HiTrap Q阴离子交换柱 美国GE Healthcare公司;BCA蛋白质定量检测试剂盒 北京索莱宝科技有限公司;牛胰蛋白酶、苯甲酰-L-精氨酸-对硝基苯胺(L-BAPA)以及其它试剂 均为国产分析纯。
PTC-200型PCR基因扩增仪 美国MJ Research Inc.;Alpha-EC凝胶成像系统 美国Alpha Innotech公司;电转仪 美国BTX公司;LZDX-75KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;SP-2012UV型紫外可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 大豆胰酶抑制剂的克隆表达与分离纯化
1.2.1.1 重组菌的构建 质粒提取、PCR及其产物的纯化、限制性酶酶切、连接、化学转化、电转化及转化子的筛选等操作均采用实验室常规方法[9]。其中,目的基因由生工生物工程(上海)股份有限公司按毕赤酵母的密码子偏爱性进行优化并合成,引物(STI-1:5′-GTACAATTTGTTTTGGATACTGATGATGATC-3′;STI-2:5′-TGCTCTAGACTAAGCAGTGGAAGATCT GAACTTTTG-3′,下划线部分为人工引入的限制性酶切位点)是根据优化后的基因序列进行设计,并由生工生物工程(上海)股份有限公司合成的。最后将获正确的阳性转化子保菌,并命名为GS115(pPIC-STI)。
1.2.1.2 抑制剂STI的发酵制备 将毕赤酵母重组菌GS115(pPIC-STI)的单菌落接种于25 mL YPD液体培养基中进行活化,于220 r/min、30 ℃振荡培养(18~20) h至对数生长期(OD600=2.0~6.0)。然后按1%(v/v)的接种量转入50 mL BMGY培养基中,在相同条件下培养(18~20) h后,离心(4 ℃,8000 r/min,5 min)收集菌体。再用50 mL BMMY培养基重悬细胞至OD600值为1.0,220 r/min、30 ℃继续培养,每隔24 h补加甲醇使其终浓度为0.5%(v/v)进行诱导。与此同时,取样进行抑制活性检测,直到抑制活性不再增加为止(大约5 d)。发酵结束后,于4 ℃、8000 r/min离心10 min收集上清液,即为蛋白酶抑制剂的发酵液,-20 ℃保存或者冻干备用。
1.2.1.3 抑制剂STI的分离纯化 将上述发酵液用30%~80%的硫酸铵分级沉淀后,再用截留分子量为14 kU的透析袋进行透析,然后通过HiTrap Q阴离子柱对其进行纯化,并采用pH为5.75的洗脱液(STI的理论等电点pI为4.75)对其进行梯度洗脱,收集洗脱峰,最后,测定抑制剂的抑制活性,并通过SDS-PAGE(浓缩胶和分离胶的浓度分别为5%和15%)[10]分析蛋白的纯化情况。此外,蛋白浓度的测定采用BCA蛋白质定量检测试剂盒进行。
1.2.2 抑制剂STI的生化特性分析
1.2.2.1 STI抑制活性的测定 参考Erlanger等[11]的方法,以L-BAPA为底物检测抑制剂的抑制活性。具体操作流程如下:
样品组:吸取0.1 mL胰蛋白酶溶液(0.027%,w/v),与0.1 mL胰蛋白酶抑制剂溶液(0.025%,w/v)混合均匀后,于37 ℃水浴锅中放置10 min,使胰蛋白酶抑制剂与胰蛋白酶充分结合形成复合物,降低或消除胰蛋白酶的水解活性。
对照组:将0.1 mL胰蛋白酶溶液(0.027%,w/v)与1 mL 5.3 mol/L的三氯乙酸溶液混匀,于37 ℃孵育10 min。然后取2 mL L-BAPA溶液(0.06%,w/v),分别加入上述两组混合液中,充分混匀。37 ℃恒温水浴10 min后,迅速放在冰上冷却,然后样品组加入1 mL三氯乙酸溶液终止反应,对照组补加0.1 mL胰蛋白酶抑制剂溶液(0.025%,w/v),并在410 nm下测定其吸光值。胰酶酶活的测定与抑制剂活性的检测方法相近,只是将胰酶抑制剂用0.1 mL的缓冲液代替。以每分钟410 nm处的吸光值增加0.01,为一个胰蛋白酶活力单位(AU)。
胰蛋白酶抑制剂的抑制率(TIR)为添加抑制剂后,胰蛋白酶残余酶活性与未添加抑制剂时胰酶酶活性的比值。而胰蛋白酶抑制剂的抑制活性=AU×TIR。
1.2.2.2 STI热稳定性的测定 将重组抑制剂STI用0.05 mol/L Tris-HCl缓冲液(pH为8.2,内含0.02 mol/L CaCl2)进行稀释,使其终浓度为0.025%(w/v)。然后将其分别置于温度为40、50、60、70、80、90和100 ℃的水浴锅中,孵育1 h后,冷却至室温。以L-BAPA为底物,按照1.2.2.1的方法测定STI的剩余抑制活性,每个样品重复测定3次。以最高抑制活性为100%,计算出其它温度下的相对抑制活性,然后作出STI的相对抑制活性与温度之间关系的曲线图。
1.2.2.3 STI的pH稳定性测定 分别将STI溶解于pH为2.0~11.0的缓冲液中,使其终浓度为0.025%(w/v)。室温下孵育1 h后,调节其pH至8.0,测定STI的剩余抑制活性。以最高抑制活性为100%,计算出其它pH下的相对抑制活性,并作出STI相对抑制活性与pH的关系曲线图。所用缓冲液为:50 mmol/L磷酸氢二钠-柠檬酸缓冲液(pH 2.0、3.0、4.0、5.0、6.0、7.0和8.0)和50 mmol/L甘氨酸-氢氧化钠缓冲液(pH 9.0、10.0和11.0)。
1.2.2.4 金属离子对STI活性的影响 在37 ℃和pH8.0的条件下,分别在反应体系中加入不同的金属离子(Na+、K+、Cu2+、Zn2+、Mg2+、Mn2+、Ca2+、Fe2+和Fe3+),使其终浓度分别为1和5 mmol/L。然后按照1.2.2.1的方法来测定STI的抑制活性,以未加金属离子的反应体系的抑制活性为100%,考察金属离子对STI活性的影响。

1.2.2.6 STI抑制专一性的测定 分别用27 μg/mL的胰凝乳蛋白酶、胃蛋白酶、木瓜蛋白酶和碱性蛋白酶替换胰蛋白酶,并将10 μg/mL的抑制剂STI加入反应体系中,其它条件均不变。然后按照1.2.2.1的方法,测定并比较抑制剂STI对不同蛋白酶的抑制效果,即可确定STI是否具有抑制专一性。
1.3 数据处理
相关实验均设置三个平行,采用软件SPSS 19.0进行方差分析,Origin 9.1作图。
2 结果与分析
2.1 STI的诱导表达与分离纯化
通过摇瓶发酵制备蛋白酶抑制剂STI的发酵液。经测定,发酵液中胰蛋白酶抑制剂的抑制活性达到39.06 TIU/mg,表达量约为30 mg/L。进一步通过盐析、透析和离子交换层析将STI的发酵液进行了纯化。纯化后,抑制剂的比抑制活性提高了19.56倍,回收率为60.85%(表1)。其相对分子量约为20.0 kU,与其理论分子量(19.7 kU)相符。而且条带单一,已达到电泳纯(图1),基本满足生化特征分析的要求。
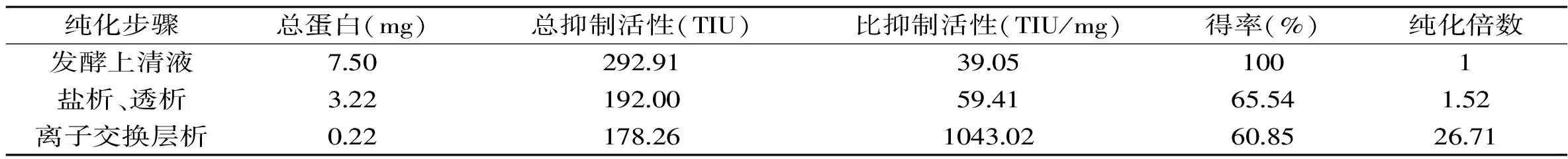
表1 STI的分离纯化Table 1 Isolation and purification of STI
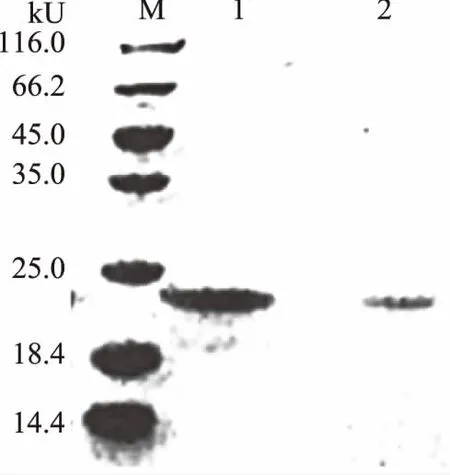
图1 SDS-PAGE分析STI的纯化情况Fig.1 SDS-PAGE analysis of the purification of STI注:M:蛋白分子量标准;1:盐析、透析后的STI;2:离子交换层析纯化后的STI。
2.2 STI的热稳定性
STI热稳定性的测定结果如图2所示。当温度保持在40~80 ℃范围内时,STI的相对抑制活性维持在93%以上,具有较好的热稳定性;而当温度高于80 ℃时,其相对抑制活性急剧下降;当温度为90 ℃时,STI的相对抑制活性仍维持在55%。可见重组STI具有很好的热稳定性。
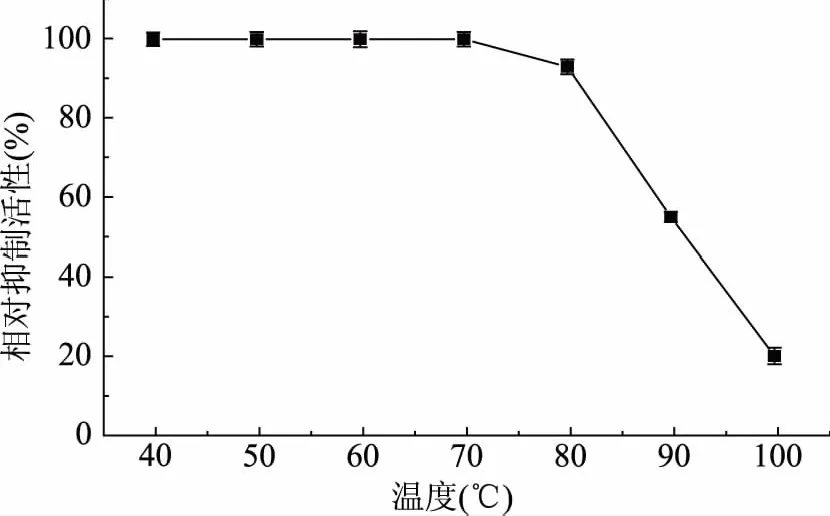
图2 STI的热稳定性Fig.2 Thermal stability of STI
2.3 STI的pH稳定性
pH对STI抑制活性的影响如图3所示。从图中可以看出,随着pH的升高,其抑制活性没有明显的改变。在pH2.0~11.0范围内,STI的相对抑制活性均维持在85%以上,具有良好的稳定性。
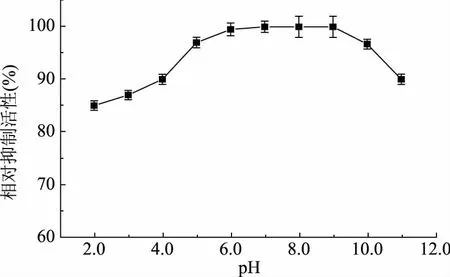
图3 STI的pH稳定性Fig.3 pH stability of STI
2.4 金属离子对STI抑制活性的影响
1 mmol/L和5 mmol/L不同的金属离子对STI抑制活性的影响如图4所示。K+、Zn2+和Mg2+对重组STI活性有明显的激活作用,且5 mmol/L Mg2+的激活效果最明显;而Cu2+、Mn2+、Ca2+、Fe2+和Fe3+对其活性有强烈的抑制作用,其中5 mmol/L Mn2+对其抑制作用最强。Na+对STI的活性没有明显的影响。
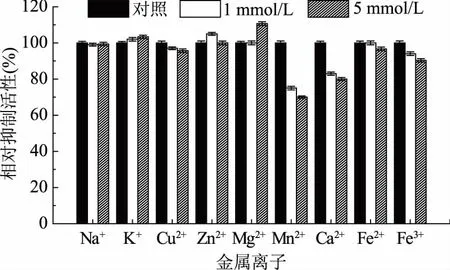
图4 金属离子对STI抑制活性影响Fig.4 Effects of metal ions on the inhibitory activity of STI
2.5 STI抑制方式和抑制能力
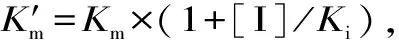
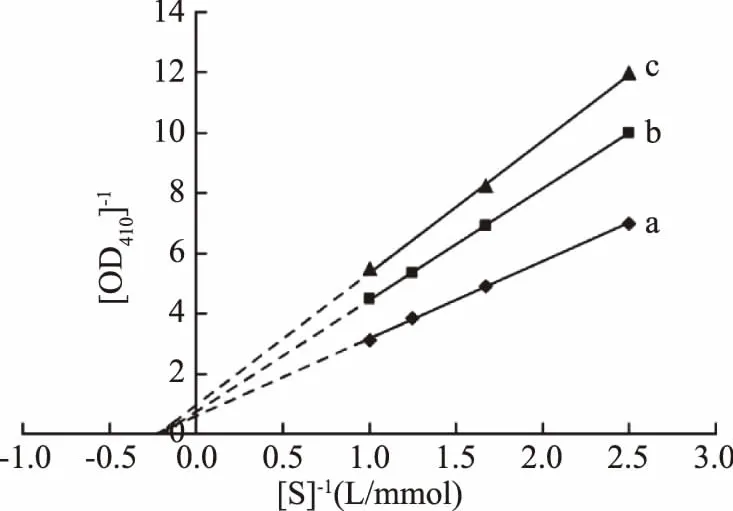
图5 胰蛋白酶活性-STI动力学的Lineweaver-Burk图Fig.5 Lineweaver-Burk plots of trypsin activity-STI kinetics注:a,b和c分别添加0、4和8 μg/mL抑制剂。
2.6 STI的抑制专一性
STI对胰蛋白酶胰、凝乳蛋白酶、木瓜蛋白酶、胃蛋白酶或碱性蛋白酶的抑制率汇总于表2。由表可知,STI对胰蛋白酶的抑制作用最强,对胰凝乳蛋白酶有较弱的抑制作用;而对胃蛋白酶、木瓜蛋白酶及碱性蛋白酶未表现出抑制作用,从而确定了STI对胰蛋白酶有较强的抑制专一性。

表2 STI的抑制专一性Table 2 Inhibitory specificity of STI
3 讨论
本文构建的毕赤酵母重组菌GS115(pPIC-STI)的发酵上清液中杂蛋白较少,只需盐析、透析和离子交换层析等相对简单的纯化过程即可得到电泳纯的STI(图1)。纯化后,STI的比抑制活性达到了1043.02 TIU/mg(表1),远高于即墨野生大豆胰酶抑制剂的比活力(672.06 U/mg)[12]、一步法和多步法获得的大豆胰酶抑制剂的比活力(分别为65.58和433.33 U/mg)[13]等。然而,重组菌表达STI的表达量还不够高(摇瓶水平上表达量为30 mg/L),后续将通过菌种改良和发酵条件优化等方法,进一步提高STI的表达量,以期实现其大规模生产从而替代现有的制备方法,并为其在食品和医药等行业的应用奠定良好的基础。
生化特征的分析表明,重组STI具有良好的热稳定性和pH稳定性(图2和图3),这与黑豆[14]、野生月桂印加豆(Ingalaurina)[15]和酸豆(Tamarindusindica)[16]等来源的胰蛋白酶抑制剂的热稳定性和pH稳定性相似。与许多蛋白一样,重组STI的活性也会受到金属离子的影响:作为常用的对酶有激活作用的K+、Mg2+对STI也有激活作用;一般重金属会抑制酶蛋白的活性,而Cu2+、Mn2+、Ca2+、Fe2+和Fe3+却对STI有抑制作用(图4)。Kunitz型蛋白酶抑制剂一般与酶分子可逆地进行结合,形成稳定的复合物,以竞争性和非竞争性方式影响其活性[16]。本研究获得的抑制剂STI与黑豆[14]以及海红豆(Adenantherapavonina)胰蛋白酶抑制剂[17]具有相同的抑制方式,属于非竞争性抑制剂(图5),且对胰蛋白酶具有较强的抑制作用和较好的抑制专一性(表2),适用于食品和医药行业[16];而即墨野生大豆[12]和酸豆[16]等来源的胰蛋白酶抑制剂则为竞争性抑制剂。
4 结论
本研究通过分子克隆与遗传重组技术,将大豆胰蛋白抑制剂基因sti在毕赤酵母中进行了成功表达。所表达的STI在40~80 ℃或pH 2.0~11.0孵育1 h后,仍能保持85%以上的抑制活性,具有很好的热稳定性和pH稳定性;而且它还是一种胰蛋白酶专一性的、非竞争性抑制剂。这为后续实现其大规模生产和挖掘其应用价值提供基础材料和技术支持。
