黑曲霉诱导子促进青钱柳细胞合成三萜的氧化应激机制
2018-12-26,,,,,,,,*
,,,,, ,,,*
(1.江西农业大学食品科学与工程学院,江西南昌 330045; 2.江西省天然产物与功能食品重点实验室,江西南昌 330045)
青钱柳(Cyclocaryapaliurus(Bata1)Iljinskaja)为我国特有的胡桃科珍稀乔木,多零星分布于我国华南地区,民间常以青钱柳叶制作保健茶。青钱柳叶含有三萜、黄酮、多糖、有机酸、甾醇及生物碱等多种生物活性成分[1],因而具有降糖[2]、降脂[3]、抗癌[4]、抗炎[5]、抗氧化[6]等多种生物活性。2014年,青钱柳被列入新食品原料目录,引起了科研和生产人员的广泛关注。但青钱柳繁育困难,资源稀缺,严重制约了其开发与利用。本实验室通过植物细胞培养技术,建立了稳定的青钱柳细胞悬浮培养体系,以此生产三萜酸等活性次级代谢产物,有望解决青钱柳资源匮乏的难题[7]。
诱导子是指能够促进植物产生一系列防御反应、促进植物防御性次级代谢产物合成的一类触发因子[8]。研究表明,萜类可作为植物抵御病原体侵害的防御性化学物质,该物质的积累可提高植物对病原体的抵抗作用[9]。熊琼琼等[10]在青钱柳细胞培养的第4 d加入真菌诱导子(Aspergillusnigerelicitor,ANE)进行诱导(终浓度为200 μg/mL),3 d后总三萜的含量为对照组的10.21倍,达到49.52 mg/g。由此可见,外源添加ANE可以有效促进青钱柳悬浮培养细胞合成三萜类物质。
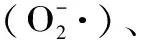
本文通过研究ANE作用下青钱柳细胞氧化应激相关酶的表达及其活性变化情况,从氧化应激层面探索ANE促进细胞合成三萜的作用机制,旨在为植物细胞培养生产活性次级代谢物提供参考。
1 材料与方法
1.1 材料与仪器
青钱柳悬浮培养细胞 江西省天然产物与功能食品重点实验室保存;MS培养基 青岛高科园海博生物技术有限公司;甲醇(色谱纯) 美国天地有限公司;其余分离用有机溶剂 均为国产分析纯;CAT、SOD、POD、PAL、PLC酶活力测定ELISA试剂盒 上海逸晗生物科技有限公司;植物RNA提取试剂盒(Easy Pure® Plant RNA Kit) 北京全式金生物有限公司。
DHG-9101.2S型电热恒温鼓风干燥箱 上海三发科学仪器有限公司;SB-3200DTDN超声波清洗机 宁波新芝生物技术有限公司;DEAAXO4033型高效液相色谱仪 安捷伦科技有限公司;cBot Truseq PE Cluster Kit v3-cBot-HS、Hiseq4000 Truseq SBS Kit v3-HS(200 cycles) Illumina公司。
1.2 实验方法
1.2.1 青钱柳细胞的悬浮培养 参考熊琼琼等[10]的方法。具体操作及条件如下:准确称取2.0 g湿重的青钱柳悬浮培养细胞,接种至装有40 mL MS培养液(内含1.0 mg/L激动素(KT)+0.5 mg/L 2,4-二氯苯氧乙酸(2,4-D)+0.3 mg/Lα-萘乙酸(NAA)+30 g/L蔗糖,pH=6.0)的100 mL的锥形瓶中,并置于温度(28±1) ℃,转速115 r/min的摇床上进行全暗培养。
1.2.2 黑曲霉诱导子的制备 参照熊琼琼等[10]的方法制备黑曲霉诱导子。
1.2.3 黑曲霉诱导子对细胞的诱导 参考熊琼琼等[10]的方法。在悬浮细胞接种后第4 d,向培养体系中加入ANE,使得培养体系中ANE的终浓度为200 μg/mL,并收获诱导不同时间段(0、2、4、6、8、10、12、15、18、21、24、30、36、42、48、54、60、66、72、78 h)的悬浮培养细胞,同时对照组加入与ANE等体积的蒸馏水,每组3个平行。
1.2.4 青钱柳细胞三萜类化合物的提取与检测 参照Ping等[7]的方法,提取和检测青钱柳悬浮细胞三萜类物质。HPLC检测条件如下:色谱柱为Waters C18(4.6 mm×250 mm,5 μm),流动相为0.2%醋酸水(A)和甲醇(B),流速:0.85 mL/min,检测波长:210 nm,柱温:40 ℃,洗脱条件为0~10 min,B 0%~82.5%;10~30 min,B 82.5%~90%;30~40 min,B 90%~90%。
1.2.5 氧化应激相关酶的活性测定及分析 粗酶的提取:参考Zhang等[13]的方法。将不同诱导时间点收获的青钱柳悬浮培养细胞(0、0.25、0.5、1、2、3、4、5、6、7、8、10、12、15、18、21、24、30、36、42、48、54、60、66、72、78 h)进行抽滤,将青钱柳悬浮培养细胞进行抽滤,取鲜重为1 g的青钱柳悬浮培养细胞,加4 mL预冷的磷酸缓冲液(pH=7.0),液氮研磨匀浆,混匀后4 ℃、3000 r/min离心10 min,上清液为粗酶提取液。
酶活的测定:按照试剂盒说明书标明的方法,测定氧化应激相关酶(SOD、POD、CAT、PAL、PLC)的活力。
1.2.6 转录组测序分析氧化应激相关基因表达量 按1.2.3方法分别收获诱导作用不同时间段的新鲜悬浮培养细胞,液氮速冻后置于-80 ℃冰箱中保存备用。分别选取对照组CK(未添加诱导子)、ANE诱导20、60 h后的三个样品进行转录组测序。本试验中样品转录组测序基于HiSeq平台,测序试验采用Illumina TruseqTM RNA sample prep Kit方法进行文库构建,其操作流程如下:样品总RNA提取、总RNA质量检测、cDNA文库建立、转录组测序、转录组数据过滤及从头组装、相关基因功能注释。完成上述工作后,利用Bowtie软件[14]将各个样品测序得到的Fragments与注释的相关基因进行分析,利用RSEM软件[15]对比对结果进行表达量统计,采用FPKM法计算相关基因的表达量。FPKM值(Fragments per kilobase of exon model per million mapped reads,FPKM)是衡量基因表达水平的标准,即每百万条序列中来自某一基因每千碱基长度的reads数目,具体公式如下:
FPKM=cDNA Fragments/(Mapped Reads(Millions)×Transcript Length(kb))
公式中,cDNA Fragments表示比对到某一转录本上的片段数目;Mapped Read(Millions)表示Mapped Read总数;Transcript Length(kb)表示转录本长度。采用edgeR软件对注释的相关基因进行差异表达分析,获得不同样本间表达量不同的差异基因,当相关基因满足FDR<0.05且log2|FC|≥1条件时,其为差异表达基因(FDR表示错误发现率,FC为差异倍数)。
1.3 数据统计与分析
采用Excel和DPS(6.55专业版)统计软件进行统计分析,每组样品设置三个重复,每个样品进行三次平行测定,数据结果以平均值±标准偏差表示。
2 结果与分析
2.1 ANE诱导下青钱柳悬浮培养细胞三萜含量的变化
ANE作用下青钱柳悬浮培养细胞总三萜含量的变化如图1所示。在接种后第4 d时加入ANE,随着诱导时间的延长,细胞三萜含量呈先升高后降低的趋势,而对照组的三萜含量一直处于较为恒定的水平。诱导后10 h三萜含量开始升高,至60 h时达到最高值,含量由12.47 mg/g变为36.46 mg/g,为对照组的3.36倍。根据Yin等[16]的研究,青钱柳悬浮培养细胞中三萜类物质主要为山楂酸、科罗索酸、白桦脂酸、齐墩果酸、熊果酸等五种三萜酸,因此本文采用HPLC法对这五种三萜的含量进行检测,据此计算三萜总含量。此前有文献报道,植物受到病原体侵害后,会产生的一类具有生物特异性的次级代谢产物(如三萜类物质),从而提高植物对病原体的防御能力[17]。因此,ANE可能是通过激活青钱柳细胞防卫机制来促进三萜合成的,因此,后续对ANE诱导作用下的抗氧化相关酶的基因表达情况和活性变化进行了研究。

图1 ANE诱导下青钱柳悬浮培养细胞总三萜含量的变化Fig.1 Changes of total triterpenoids content of the suspended cultured C.paliurus cells under ANE elicitation
2.2 ANE诱导下细胞氧化应激相关酶活性的变化

图2 ANE诱导下青钱柳悬浮培养细胞SOD酶活的变化Fig.2 SOD acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.2.2 ANE诱导下POD酶活性的变化 ANE对青钱柳悬浮培养细胞POD酶活性的影响如图3所示,加入ANE后,细胞内POD酶活力开始升高,在1 h时达到一个峰值,该峰值与SOD的峰值几乎同时出现,之后迅速下降,在6 h降到最低后又开始迅速上升,并在8 h时又达到一个峰值,之后又分别在21、66 h时出现两个峰值,且在66 h时达到最大峰值;而对照组POD酶的活性在整个试验期间内无明显变化,始终处于较低水平,且比较平稳。POD与CAT是植物体内的重要的氧化还原酶,可以催化H2O2分解,是植物体内清除H2O2的关键酶[22-23],该酶的活性变化也可能是对ANE所致的氧化应激的一种保护反应。

图3 ANE诱导下青钱柳悬浮培养细胞POD酶活的变化Fig.3 POD acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.2.3 ANE诱导下CAT酶活性的变化 由图4可知,ANE对胞内CAT酶活力的影响非常明显,诱导后的酶活明显高于对照组,而对照组中CAT酶活力未发生明显变化,一直处于相对较低的水平。加入ANE后,细胞CAT酶活力即开始迅速升高,分别在诱导2、8、24、54及66 h时出现了5个峰值,其中以8 h的峰值比较大。CAT酶活力的变化可能是对添加诱导子所致的高浓度H2O2的保护性反应。

图4 ANE诱导下青钱柳悬浮培养细胞CAT酶活的变化Fig.4 CAT acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.2.4 ANE诱导下PAL酶活性的变化 PAL是苯丙烷代谢途径中的关键酶和限速酶,其活性升高可使木质素、木栓质、多酚类物质含量的升高,进而提高自身的抗病或抗逆能力,其中多酚类物质还具有很强的自由基清除能力,能抑制细胞膜脂过氧化,因此植物细胞的抗氧化活性与PAL的活性也有一定关联[24-25]。ANE对青钱柳悬浮培养细胞PAL酶活性的影响如图5所示,ANE作用下,PAL酶的活性相对于对照组有明显的提高,呈先升高后降低的趋势,分别在7、18及42 h时达到了峰值,其中以42 h时的峰值最大;此后,PAL酶的活性逐渐降低,60 h之后诱导组的活性低于对照组。这可能是因为随着次级代谢物的不断积累,过多的次级代谢产物对细胞本身产生了毒害作用,以致细胞通过关闭或降低相应途径中关键酶的合成,来限制次级代谢产物的积累[26]。ANE诱导引起了PAL活力的升高,可能是细胞应对诱导所致的胞内ROS变化的一种保护性反应。

图5 ANE诱导下青钱柳悬浮培养细胞PAL酶活的变化Fig.5 PAL acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.2.5 ANE诱导下PLC酶活性的变化 PLC是植物中胁迫信号传递的一个关键酶,其水溶性产物进入胞内后,激发钙离子释放,从而进一步调节钙离子、钙调素依赖性酶活性及其相关信号转导途径,有研究表明,植物中PLC还可能与ROS的形成有关[27-28]。ANE对胞内PLC酶活性的影响如图6所示,胞内PLC的活性在添加ANE后的前5 h基本上与对照组相同,之后开始升高,在6 h时出现一个峰值,在第24 h又出现了一个较大的峰值,之后迅速降低,但直至78 h还是明显高于对照组。
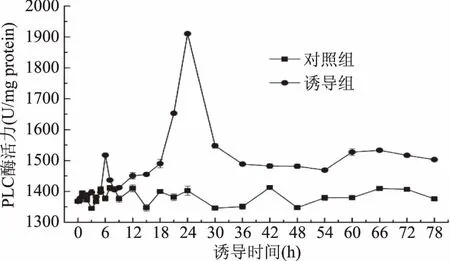
图6 ANE诱导下青钱柳悬浮培养细胞PLC酶活的变化Fig.6 PLC acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.3 ANE诱导对胞内氧化应激相关基因表达的影响
ANE诱导作用下,青钱柳细胞内氧化应激相关的5个酶的活性均出现了明显升高,推测可能是相应基因表达上调所致,在转录层面上,植物细胞对于诱导子的响应常常发生于诱导子诱导的中前期,因此,结合ANE诱导后细胞中氧化应激相关酶酶活力及三萜含量的变化,挑选诱导中前期的对照组(CK)、诱导后20 h及诱导后60 h的细胞进行转录组测序,分析了诱导后5个酶基因的表达变化情况。在转录组注释到的青钱柳细胞相关基因中,共注释到了43个POD候选基因、12个SOD候选基因和2个CAT候选基因,其中有20个POD基因在诱导20、60 h后的表达量都发生了上调,且有3个显著上调;3个SOD基因上调;1个CAT基因表达量显著上调(如表1所示)。此外,本文在转录组测序中还注释到了6个PAL候选基因与19个PLC候选基因,其中4个PAL基因发生了上调、且有3个显著上调;7个PLC基因发生了上调,但都不显著(如表1所示)。以上结果表明,ANE诱导可导致青钱柳悬浮培养细胞产生氧化应激,进而引起氧化应激相关酶的基因表达量的上调,相应的酶活力因此升高。诱导作用下抗氧化系统相关酶活力升高,一方面保护了细胞免受氧化损伤,另一方面也通过信号网络促进了三萜化合物的合成。

表1 ANE诱导对青钱柳悬浮培养细胞氧化应激相关酶基因表达的影响Table 1 Effects of ANE elicitation on the expression of related genes to oxidative stress
2.4 ANE诱导对胞内三萜合成相关基因表达的影响
在植物当中,萜类合成主要通过两条途径进行(图7),包括甲羟戊酸(MVA)途径与2-甲基赤藓醇磷酸(MEP)途径,上述两条途径均以异戊二烯焦磷酸(IPP)及其双键异构体二甲基烯丙基焦磷酸(DMAP)为共同中间产物,合成下游合成途径中的各种萜类物质,此过程涉及多种萜类合成酶[29]。青钱柳细胞中三萜合成途径的通量增加,即三萜合成相关酶基因的表达量上调是细胞中三萜含量增加的直接原因。如表2所示,在ANE诱导子的作用下,转录组注释到的35个三萜合成相关酶基因均发生不同程度的差异表达,其中MVA途径上的相关合成酶基因普遍发生上调,而MEP上游途径中合成酶相关基因(如DXS、IspD、IspE、IspF、IspG、IspH)的表达则普遍发生了略微下调变化,说明在青钱柳细胞当中,三萜类物质主要是通过MVA途径进行合成的。结合三萜含量以及氧化应激相关酶活力变化可知,ANE诱导子可激活青钱柳细胞的氧化应激反应,继而通过信号转导网络,促进细胞当中三萜合成酶相关基因的表达,最终促进青钱柳细胞中三萜类物质的积累。
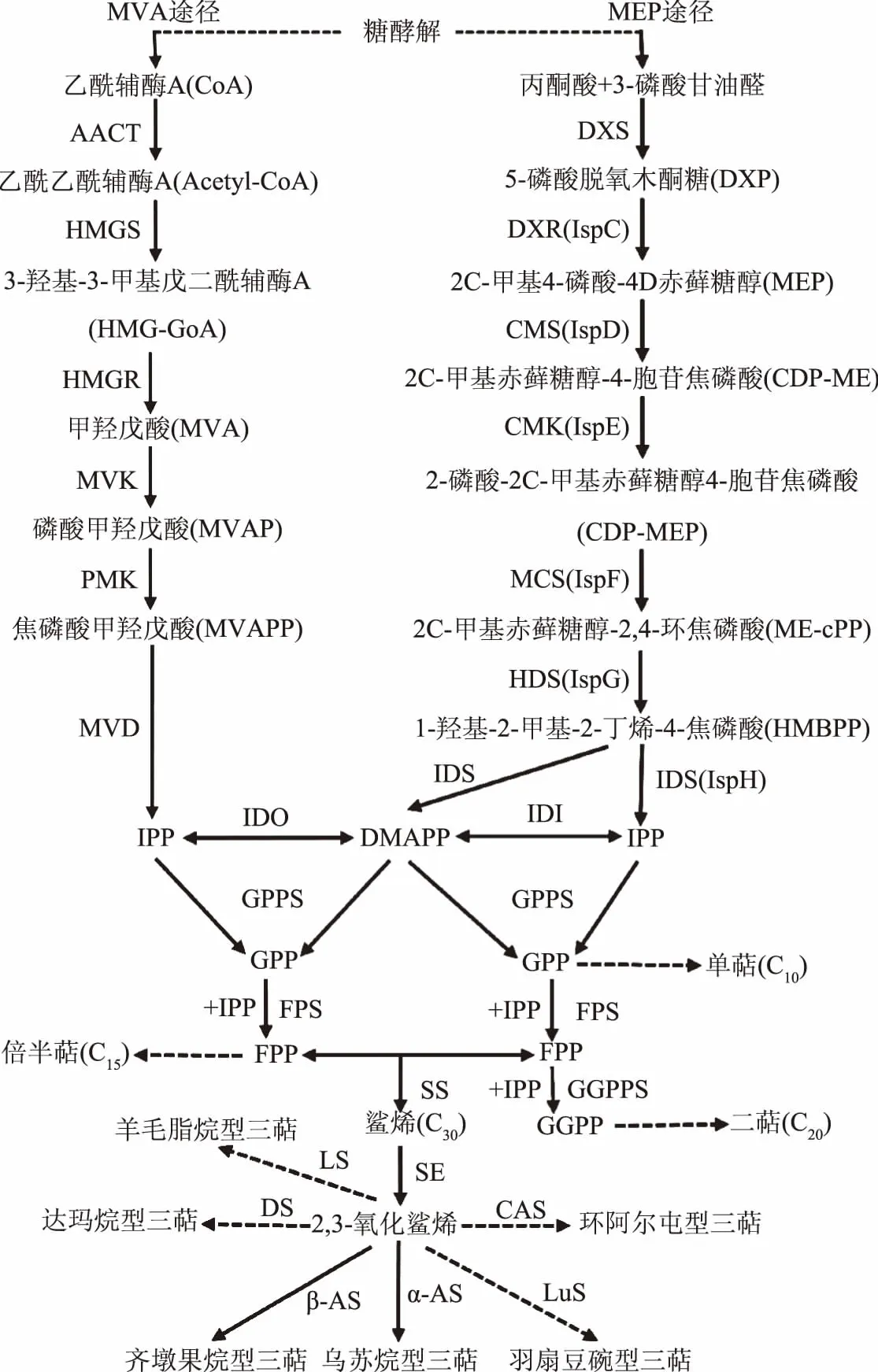
图7 萜类化合物生物合成途径Fig.7 Biosynthetic pathway for terpenoids
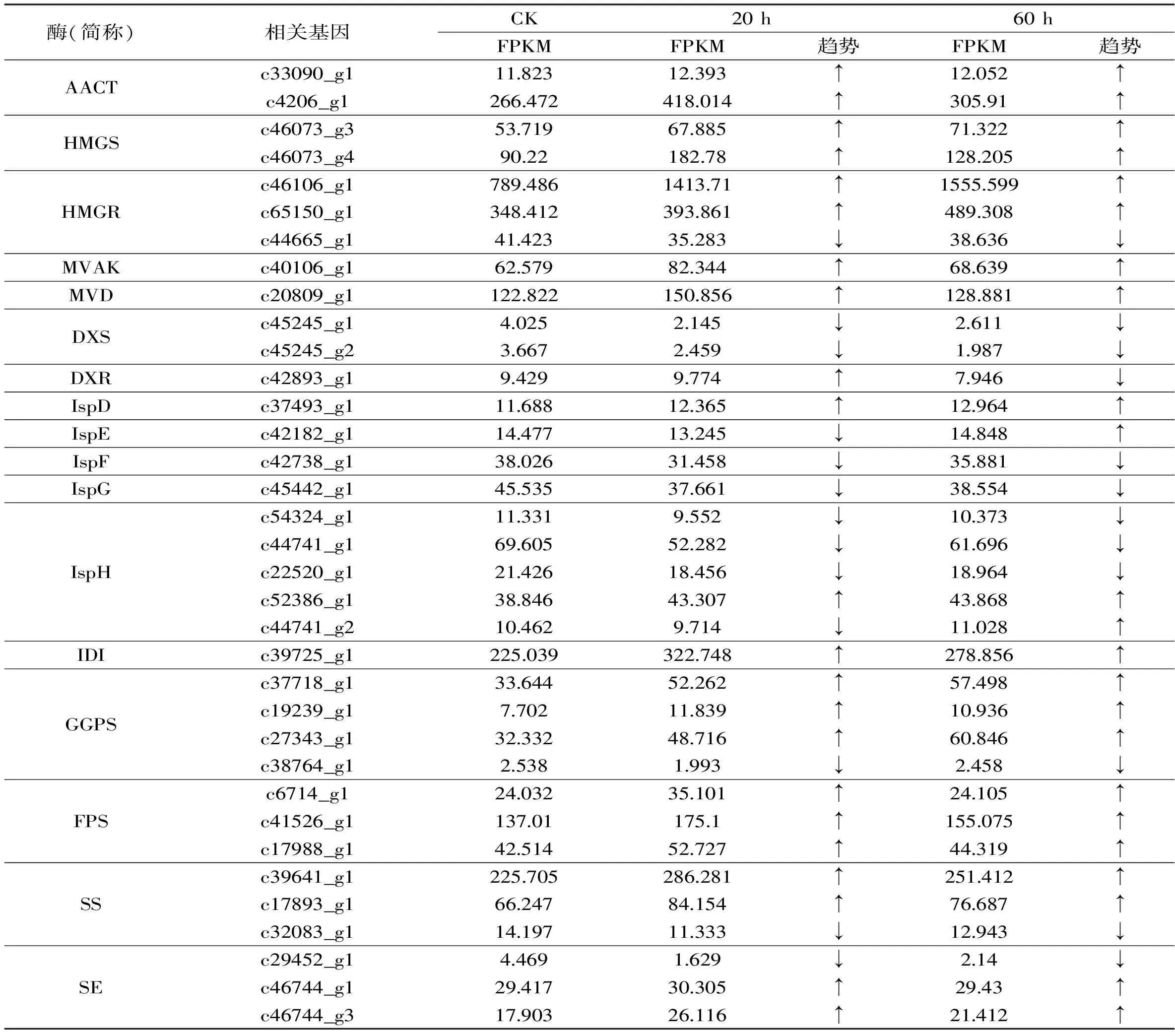
表2 三萜代谢途径中的差异表达基因Table 2 The differentlly expressed genes of terpenoids biosynthetic pathway
3 讨论与结论
植物在遭受逆境胁迫时(如病原体侵染时),细胞内ROS的产生与清除之间的平衡会受到破坏,从而出现ROS的积累。一方面,ROS可直接杀灭侵染植物的病原体,另一方面,ROS又可作为信号分子直接或间接激活某些防卫基因的表达,从而促进植物细胞内防御性次级代谢产物的积累。但过多的ROS会对植物自身造成伤害,因此植物体内有一套完整的氧化与抗氧化的平衡调节系统,即ROS大量积累时,各种抗氧化酶活性也随之上升[30]。
SOD、POD及CAT是细胞内清除ROS的三种重要的抗氧化酶。张长平等[31]使用真菌诱导子提高了南方红豆杉悬浮培养细胞中萜类物质(紫杉醇)的含量,其结果表明,PAL、POD、CAT和SOD酶的活力也发生了时序性变化。侯丕勇等[32]发现,真菌诱导子能诱导铁皮石斛原球茎中LOX、PAL和POD活性的升高,从而提高了总生物碱的含量。翟俏丽等[33]在白桦悬浮培养细胞中添加真菌诱导子诱导1 d后,三萜含量比对照组增长了78%,且在诱导6~10 h内,POD和PAL酶的活性分别是对照组的5.74、5.70倍。

PAL是苯丙烷代谢途径中的关键酶和限速酶,其活性升高可促进植物黄酮、茶醌类色素及木质素类物等物质的积累,继而增强植物本身的抗氧化、抗病或抗逆能力。本文研究发现,经ANE处理后青钱柳细胞PAL酶的活性显著提高,在18 h时达到最大,其后又在42 h时,再次上升达到最大峰值,这与刘长军等[34]报道的ANE作用新疆紫草细胞后PAL酶活性明显增加的结果相似。
PLC是植物中胁迫信号传递的一个关键酶,其水溶性产物进入胞内后,激发钙离子释放,从而进一步调节钙离子、钙调素依赖性酶活性及其相关信号转导途径[27]。本实验发现,添加ANE后,青钱柳细胞PLC的活性明显提高,这可能是PLC介入了ANE对细胞三萜类物质合成的诱导作用过程,但具体的机制有待于进一步研究。
此外,在转录水平上,本实验表明,在ANE的诱导下,细胞氧化应激相关的5个酶的基因表达量明显上调,三萜合成途径中合成酶相关基因表达亦发生上调。由此可见,真菌诱导子是一种能促进青钱柳悬浮培养细胞中三萜类物质积累的诱导因子,在其诱导作用下,青钱柳细胞发生了氧化应激,随后细胞内信号网络被激活,继而促进三萜合成酶相关基因表达发生上调,并最终促进青钱柳细胞当中三萜类物质的积累。
