葡萄状枝瑚菌菌丝液体培养条件优化
2018-12-26,,,,
,, , ,
(南京师范大学生命科学学院,江苏南京 210023)
葡萄状枝瑚菌[Ramariabotrytis(Pers.)Ricken]又称为葡萄色顶枝瑚菌,是一种常见的大型真菌,隶属于担子菌门(Basidiomycota)伞菌纲(Agaricomycetes)钉菇目(Gomphales)钉菇科(Gomphaceae)枝瑚菌属(Ramaria)[1],夏秋季于林中地上散生,广泛分布于世界各地。该菌是我国野生的食用真菌[2],含有16种氨基酸,其中7种是人体必需氨基酸;矿质元素和蛋白质含量均高于常见的栽培食用菌[3];葡萄状枝瑚菌还可以药用,据张亚光[4]报道,葡萄状枝瑚菌具有和胃现气、破血缓中、祛风等作用。
在葡萄状枝瑚菌的子实体中还获得了一些天然产物,Prostenik等[5]从葡萄状枝瑚菌子实体中分离获得了甘油磷脂。Yaoita等[6]从其子实体种发现4种已知的甾醇和一种新的神经酰胺——(2S,2′R,3R,4E,8E)~N-2′-hydroxyoctadecanoyl-2-amino-9-methyl-4,8-heptade-cadiene-l,3-diol;Sunil K等[7]从子实体中分离得到两种水不溶性葡聚糖:(1-3)-α-D-glucan和β-(1-3)-D-glucan;Bhanja等[8]从子实体碱性提取物中分离出水溶性葡聚糖,该水溶性葡聚糖是一种有效的免疫刺激剂;Li[9]从葡萄状枝瑚菌子实体中提取出了粗多糖,并发现葡萄状枝瑚菌多糖(RBP)的4个组分中,RBP-3具有很强的羟基自由基清除活性能力,而RBP-4具有较强的DPPH自由基还原能力。此外,Lee等[10]证实葡萄状枝瑚菌子实体具有明显的酶活性,其中漆酶的酶活性最高,α-淀粉酶和木聚糖酶相对较高;Kim等[11]研究发现,葡萄状枝瑚菌子实体提取物具有免疫调节和抗肿瘤活性,这些生物活性的发现对于抗癌、抗衰老及治疗心血管疾病具有积极的作用。
目前国内外对于葡萄状枝瑚菌的研究主要集中在其子实体中的活性物质及其活性功能等方面,对于葡萄状枝瑚菌液体发酵的研究报道较少,而液体发酵对于真菌天然产物、生物活性和生产技术等的研发都尤为重要,液体发酵的菌丝和发酵液具有与子实体相似的营养成分、药理成分和保健功效,采用液体发酵技术获取菌丝体及发酵液,不仅可以代替难以栽培的子实体所具备的功能,也可以相对缩短生产周期和成本,且工艺简单可应用于大规模生产。因此,本研究通过单因素和正交试验确定葡萄状枝菌液体培养的最佳培养基配方和培养条件,以期为葡萄状枝瑚菌的液体发酵提供理论依据。
1 材料与方法
1.1 材料与仪器
葡萄状枝瑚菌 2016年7月10日于重庆市黄水镇鱼龙乡七月山采集葡萄状枝瑚菌子实体,按照张攻等[12]的方法自行通过组织分离和纯化培养获得,保存于本实验室4 ℃冰箱;葡萄糖、乳糖、蔗糖、果糖、甘露醇、可溶性淀粉、蛋白胨、酵母粉KNO3、NaNO3、NH4Cl、(NH4)2SO4、KH2PO4、FeSO4·7H2O、MgSO4·7H2O、VB1、VB2、VB3、VB6、VB9、VB11分析纯,上海生工生物技术有限公司;马铃薯 采购于当地苏果超市。
CXZ型智能光照培养箱 南京同立实验有限公司;CA-1390-1垂直层流超净工作台 上海上净设备有限公司;JA1003电子天平 上海舜宇恒科学仪器有限公司;SHZ-D III循环水真空泵 巩义市英裕予华仪器厂;HVE-50高压蒸汽灭菌锅 Hirayama manufacturing corporation;QHZ-123B叠加恒温振荡培养箱 上海百典仪器设备有限公司;DZF-6090真空干燥箱 上海双旭电子有限公司。
1.2 实验方法
1.2.1 供试培养基的配制 PDA加富培养基:200 g马铃薯,20 g葡萄糖,3 g蛋白胨,0.8 g KH2PO4,1.2 g MgSO4·7H2O,0.01 g VB1,1000 mL蒸馏水,pH自然[13];种子培养基:20 g葡萄糖,3 g蛋白胨,0.8 g KH2PO4,1.2 g MgSO4·7H2O,0.01 g VB1,1000 mL蒸馏水,pH自然;无碳基础培养基:3 g蛋白胨,0.8 g KH2PO4,0.01 g VB1,1000 mL蒸馏水,pH自然;无氮基础培养基:20 g可溶性淀粉,0.8 g KH2PO4,0.01 g VB1,1000 mL蒸馏水,pH自然;基础培养基Ⅰ:20 g可溶性淀粉、3 g酵母粉、0.01 g VB1,1000 mL蒸馏水,pH自然;基础培养基Ⅱ:20 g可溶性淀粉、3 g酵母粉、0.8 g KH2PO4、1.2 g FeSO4·7H2O、1.2 g MgSO4·7H2O,1000 mL蒸馏水,pH自然。
1.2.2 液体菌种的制备 按常规方法将保藏的葡萄状枝瑚菌母种从试管接种到PDA加富培养基平板中,23 ℃活化培养7 d后,以1 cm的打孔器取5片葡萄状枝瑚菌,接入装瓶量为50 mL/250 mL锥形瓶种子培养基中,静置培养2 d后,23 ℃,160 r/min培养7 d得葡萄状枝瑚菌种子液。
1.2.3 碳源对菌丝生长量影响的测定 用葡萄糖、乳糖、蔗糖、果糖、甘露醇、可溶性淀粉6种碳源,分别以20 g加入1 L无碳基础培养基,pH自然,每瓶(50 mL/250 mL)接种量10%(V/V),接种后在23 ℃下、160 r/min摇床培养7 d后测定菌丝生长量,确定最有利于菌丝生长的碳源;在最优碳源下,考察碳源浓度(15、20、25、30、35 g/L)对菌丝生长量的影响,确定最佳碳源浓度。
1.2.4 氮源对菌丝生长量影响的测定 用KNO3、NaNO3、NH4Cl、(NH4)2SO4、蛋白胨和酵母粉6种氮源,分别以3 g加入1 L无氮基础培养基,pH自然,每瓶(50 mL/250 mL)接种量10%(V/V),接种后在23 ℃下、160 r/min摇床培养7 d后测定菌丝生长量,确定最有利于菌丝生长的氮源;在最优氮源下,考察氮源浓度(2.5、3.0、3.5、4.0、4.5 g/L)对菌丝生长量的影响,确定最佳氮源浓度。
1.2.5 无机离子对菌丝生长量影响的测定 分别以0.8 g KH2PO4、1.2 g FeSO4·7H2O、1.2 g MgSO4·7H2O、1.2 g FeSO4·7H2O+1.2 g MgSO4·7H2O、0.8 g KH2PO4+1.2 g FeSO4·7H2O+1.2 g MgSO4·7H2O、0.8 g KH2PO4+1.2 g MgSO4·7H2O,加入1 L基础培养基Ⅰ,pH自然,每瓶(50 mL/250 mL)接种量10%(V/V),接种后在23 ℃下、160 r/min摇床培养7 d后测定菌丝生长量,确定最有利于菌丝生长的无机离子;在最优无机离子下,考察无机离子浓度(2.6、3.2、3.8、4.4、5.0 g/L)对菌丝生长量的影响,确定最佳无机离子浓度。
1.2.6 生长因子对菌丝生长量影响的测定 用VB1、VB2、VB3、VB6、VB9和VB116种维生素作为生长因子,分别以0.01 g加入1 L基础培养基Ⅱ,pH自然,每瓶(50 mL/250 mL)接种量10%(V/V),接种后在23 ℃下、160 r/min摇床培养7 d后测定菌丝生长量,确定最有利于菌丝生长的生长因子;在最优生长因子下,考察生长因子浓度(0.005、0.010、0.015、0.020、0.025 g/L)对菌丝生长量的影响,确定最佳生长因子浓度。
1.2.7 培养基初始pH对菌丝生长量影响的测定 供试培养基为摇瓶种子培养基,灭菌前以1 mol/L的HCl和1 mol/L的NaOH将初始pH分别调节为5.5、6.0、6.5、7.0、7.5、8.0,每瓶(50 mL/250 mL)接种量10%(V/V),接种后在23 ℃下、160 r/min摇床培养7 d后测定菌丝生长量,确定最有利于菌丝生长的培养基初始pH。
1.2.8 光照对菌丝生长量影响的测定 供试培养基同1.2.7,pH6.5,每瓶(50 mL/250 mL)接种量10%(V/V),接种后分别在全黑暗、全光照和半光照(12 h光照,12 h黑暗)3种处理下,23 ℃、160 r/min摇床培养7 d后测定菌丝生长量,确定最有利于菌丝生长的光照条件。
1.2.9 培养温度对菌丝生长量影响的测定 供试培养基同1.2.8,每瓶(50 mL/250 mL)接种量10%(V/V),接种后全黑暗条件下分别在17、20、23、26、29、32 ℃下,160 r/min摇床培养7 d后测定菌丝生长量,确定最有利于菌丝生长的培养温度。
1.2.10 摇床转速对液体培养菌丝生长量影响的测定 供试培养基同1.2.8,每瓶(50 mL/250 mL)接种量10%(V/V),接种后全黑暗条件下分别以120、140、160、180、200、220、240 r/min的摇床转速,在23 ℃下摇床培养7 d后测定菌丝生长量,确定最有利于菌丝生长的摇床转速。
1.2.11 正交试验 根据单因素实验结果确定最佳因素后,采用L9(34)正交表以葡萄状枝瑚菌菌丝生长量为指标,选取可溶性淀粉为碳源,酵母粉为氮源,KH2PO4+FeSO4·7H2O+MgSO4·7H2O组合为无机离子,VB1为生长因子,安排正交试验,以进一步优化葡萄状枝瑚菌液体培养基组成,液体培养条件为培养基初始pH6.5,装瓶量50 mL/250 mL锥形瓶,接种量10%(V/V),全黑暗培养7 d,试验因素及水平见表1。

表1 液体培养基正交试验因素和水平Table 1 Factors and levels of orthogonal test for liquid medium
1.2.12 菌丝生长量的测定 培养结束后将每瓶发酵液进行真空抽滤收集菌丝,55 ℃恒温烘箱中烘干4 h至恒重,用电子天平恒重。
1.3 数据分析
每组实验重复3次,实验结果以平均值±标准差表示,应用SPSS 13.0软件和Origin 8.1软件进行统计分析和制图,利用one way ANOVA的LSD检验法对数据进行差异显著性分析,显著性水平为p<0.05。
2 结果与分析
2.1 碳源对葡萄状枝瑚菌菌丝生长量的影响
葡萄状枝瑚菌对碳源的利用比较广泛,既可以利用成分复杂的有机氮源,又可以利用单糖和双糖等小分子碳源,6种供试的碳源对葡萄状枝瑚菌菌丝生长量的影响存在显著性差异(图1),说明其对碳源的利用具有选择性。以蔗糖为碳源时,菌丝生长量最低,为0.253 g/50 mL;以可溶性淀粉为碳源时,菌丝生长量最大,为0.39 g/50 mL,且与其他5种碳源之间差异显著(p<0.05),供给可溶性淀粉时菌丝生长量大,葡萄状枝瑚菌更倾向于利用有机碳源,说明能够迅速产生相应的水解酶,从而将大分子降解成小分子供其生长所需,因此,葡萄状枝瑚菌液体培养基的最佳碳源为可溶性淀粉。
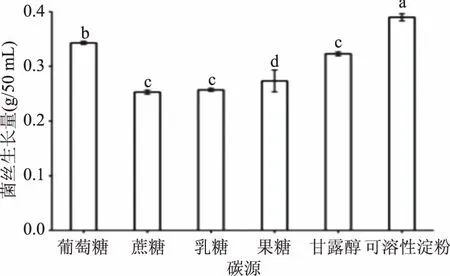
图1 碳源对葡萄状枝瑚菌菌丝生长量的影响Fig.1 Effects of different carbon sources on the dry mycelial weight of Ramaria botrytis注:图中不同字母代表差异显著性(p<0.05),下图相同。
如图2所示,随着可溶性淀粉浓度的升高,葡萄状枝瑚菌菌丝生长量也随之升高,当可溶性淀粉浓度为25 g/L时,菌丝生长量最大,为0.416 g/50 mL,添加的可溶性淀粉浓度超过25 g/L时,菌丝生长量随着可溶性淀粉浓度的升高而逐渐降低,可能是由于培养基中可溶性淀粉浓度过大,导致发酵液的粘度增大,影响了溶氧和其他物质的传递,进而影响了菌丝生长,所以选择25 g/L为最佳可溶性淀粉浓度。
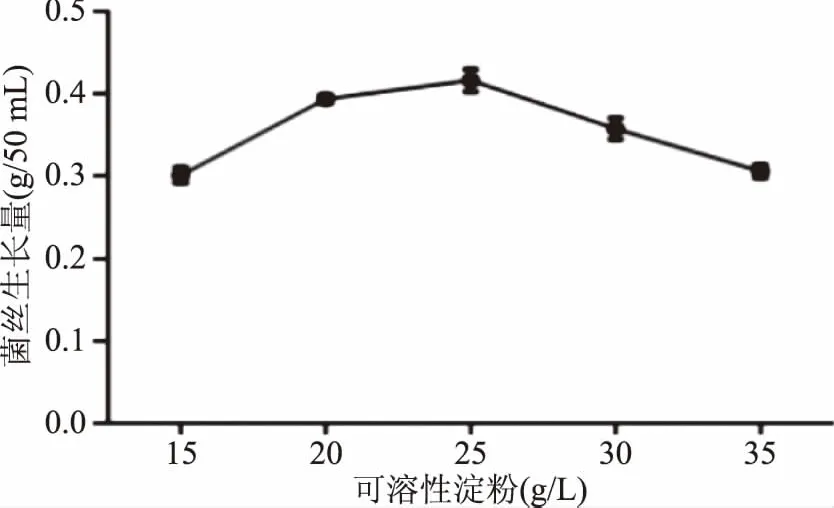
图2 可溶性淀粉浓度对葡萄状枝瑚菌菌丝生长量的影响Fig.2 Effect of different concentrations of soluble starch on the dry mycelial weight of Ramaria botrytis
2.2 氮源对葡萄状枝瑚菌菌丝生长量的影响

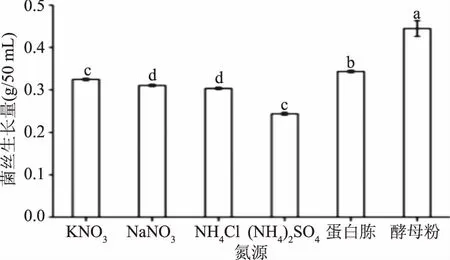
图3 氮源对葡萄状枝瑚菌菌丝生长量的影响Fig.3 Effects of different nitrogen sources on the dry mycelial weight of Ramaria botrytis
如图4所示,随着酵母粉浓度的升高,葡萄状枝瑚菌菌丝生长量也随之升高,当酵母粉浓度为3.5 g/L时,菌丝生长量最大,为0.483 g/50 mL,当酵母粉浓度超过3.5 g/L时,菌丝生长量随着酵母粉浓度的升高而逐渐降低,所以选择3.5 g/L为最佳酵母粉浓度。

图4 酵母粉浓度对葡萄状枝瑚菌菌丝生长量的影响Fig.4 Effects of different concentrations of yeast extract on the dry mycelial weight of Ramaria botrytis
2.3 无机离子对葡萄状枝瑚菌菌丝生长量的影响
无机盐是影响食用菌生长发育的重要因素之一,孟丽等[17]研究表明,低浓度的FeSO4·7H2O可以促进双孢蘑菇(Agaricusbisporus)和黄背木耳(Auriculariapolytricha)等担子菌菌丝的生长发育;康健等[18]研究发现,向培养基中添加0.1%的KH2PO4和0.5%的MgSO4时,香菇(Lentinulaedodes)菌丝的湿重达到最大。本实验中,培养基中分别添加6个供试的无机离子组合,其对葡萄状枝瑚菌菌丝生长量的影响存在差异(图5),添加MgSO4·7H2O时,菌丝生长量最低,为0.339 g/50 mL;添加KH2PO4+FeSO47H2O+MgSO4·7H2O时菌丝生长量最大,为0.883 g/50 mL,且与添加其他5个供试的无机离子处理之间差异显著(p<0.05);K+、Mg2+、Fe2+三者共同添加到培养基中比单独添加其中一种离子的效果好,这证实了张焱珍等基于对荷叶离褶伞(Lyophyllumdecasters)的研究而提出的观点[19],这三个离子间的互作可以显著提高菌丝的生长量,因此,KH2PO4+FeSO47H2O+MgSO4·7H2O无机离子组合为葡萄状枝瑚菌液体培养基的最佳无机离子。

图5 无机离子对葡萄状枝瑚菌菌丝生长量的影响Fig.5 Effects of different inorganic ions on the dry mycedial weight of Ramaria botrytis注:K+Mg为KH2PO4+MgSO4·7H2O,Fe+Mg为FeSO4·7H2O+MgSO4·7H2O,K+Fe+Mg为KH2PO4+FeSO4·7H2O+MgSO4·7H2O。
如图6所示,葡萄状枝瑚菌菌丝生长量随着KH2PO4+FeSO4·7H2O+MgSO4·7H2O组合浓度的升高而升高,当KH2PO4+FeSO4·7H2O+MgSO4·7H2O组合浓度为3.8 g/L(即KH2PO4+FeSO4·7H2O+MgSO4·7H2O为1.0 g/L+1.4 g/L+1.4 g/L)时,菌丝生长量最大,为1.011 g/50 mL,当KH2PO4+FeSO4·7H2O+MgSO4·7H2O组合浓度浓度超过3.8 g/L时,菌丝生长量随着酵母粉浓度的升高而逐渐降低,所以选择3.8 g/L为最佳无机离子组合浓度。
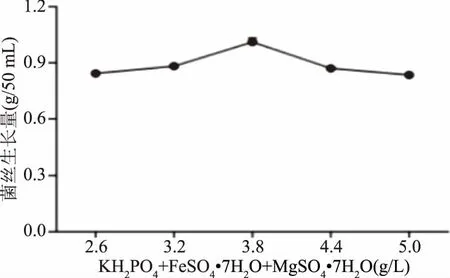
图6 KH2PO4+FeSO4·7H2O+MgSO4·7H2O组合浓度对葡萄状枝瑚菌菌丝生长量的影响Fig.6 Effects of different concentrations of KH2PO4+FeSO4·7H2O+MgSO4·7H2O on the dry mycelial weight of Ramaria botrytis
2.4 生长因子对葡萄状枝瑚菌菌丝生长量的影响
据相关资料报道,真菌是VB的天然缺陷型,在真菌中以辅酶的形式存在,需要的量很少,但对真菌的生长至关重要,必须由外界添加才能更好生长[20]。培养基中分别添加6种不同的维生素,其对葡萄状枝瑚菌菌丝生长量的影响存在差异(图7)。以VB3为生长因子时,菌丝生长量最低,为0.572 g/50 mL;以VB1为生长因子时菌丝生长量最大,为1.12 g/50 mL,且VB1为生长因子时与其他5种生长因子之间差异显著(p<0.05),因此,VB1为葡萄状枝瑚菌液体培养基的最佳生长因子。

图7 生长因子对葡萄状枝瑚菌菌丝生长量的影响Fig.7 Effects of different growth factors on the dry mycelial weight of Ramaria botrytis
如图8所示,当VB1浓度为0.015 g/L时,菌丝生长量最大,为1.161 g/50 mL,当VB1浓度大于0.015 g/L时,菌丝生长量随着VB1浓度的升高而逐渐降低,高浓度的VB1对菌丝的生长有抑制作用,因此选择0.015 g/L为最佳VB1浓度。

图8 VB1浓度对葡萄状枝瑚菌菌丝生长量的影响Fig.8 Effects of different concentrations of VB1 on the dry mycelial weight of Ramaria botrytis
2.5 培养基初始pH对葡萄状枝瑚菌菌丝生长量的影响
培养基的初始pH对葡萄状枝瑚菌液体培养下的菌丝生长量有着不同程度的影响(图9)。在低pH时,菌丝生长量随着pH升高而逐渐增大,初始pH6.5时,菌丝生长量最大,为0.603 g/50 mL,并且与其他5个初始pH处理之间差异显著(p<0.05);pH6.5之后,菌丝生长量随着pH升高而快速减小,初始pH8.0时,菌丝生长量最低,为0.2517 g/50 mL,表明该菌的生长对碱性条件十分敏感,而更喜好偏酸性的条件,这与Fang等[21]对于Ganodermalucidum液体培养初始pH的探究结论相同,因此,确定葡萄状枝瑚菌菌丝体生长的最适培养基初始pH为6.5。
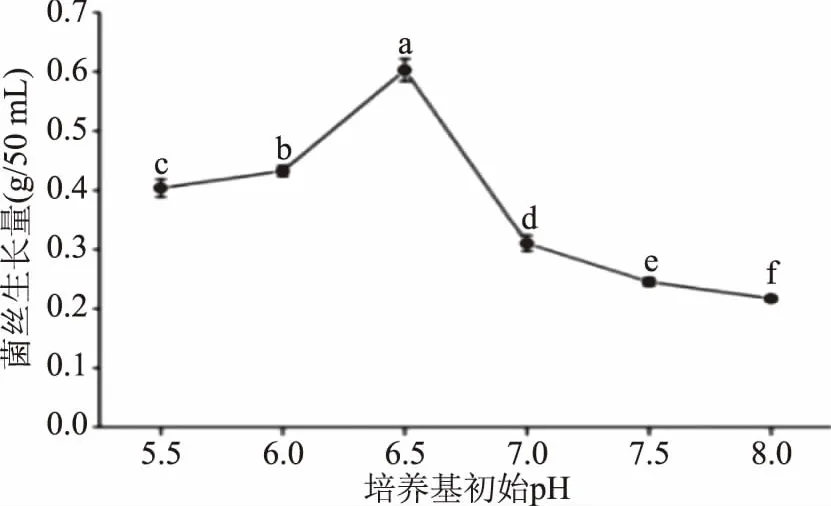
图9 培养基初始pH对葡萄状枝瑚菌菌丝生长量的影响Fig.9 Effect of initial medium pH on the dry mycelial weight of Ramaria botrytis
2.6 光照条件对葡萄状枝瑚菌菌丝生长量的影响
葡萄状枝瑚菌液体培养时,菌丝在光照和黑暗条件下的生长量存在显著差异(p<0.05)(图10)。24 h完全光照培养条件下,菌丝生长量最小,为0.758 g/50 mL;24 h完全黑暗培养时菌丝生长量最大,为0.827 g/50 mL,且与其他两种光照处理之间差异显著(p<0.05),这与Vargos-Isla[22]对一种分离自巴西的野生食用菌的研究结果一致,Lentinusstrigosus的液体培养也是在黑暗条件下生长最好,但其中的机理还有待研究。

图10 光照条件对葡萄状枝瑚菌菌丝生长量的影响Fig.10 Effects of light and dark on the dry mycelial weight of Ramaria botrytis
2.7 培养温度对葡萄状枝瑚菌菌丝生长量的影响
栽培食用菌根据菌丝体最适生长温度分为低温菌(21~24 ℃)、中温菌(25~26 ℃)和高温菌(32~35 ℃)[23],葡萄状枝瑚菌在不同的培养温度下,菌丝生长量存在显著差异(图11),菌丝生长量在23 ℃时达到最大,为0.842 g/50 mL,且与其他5个培养温度间差异显著(p<0.05),23 ℃是其最适培养温度,由此可以判断出葡萄状枝瑚菌属于低温菌。高于23 ℃的温度处理,对菌丝体的生长都有着一定的抑制作用,32 ℃中培养,菌丝生长量最小,仅为0.083 g/50 mL,可能是高温抑制了菌丝体细胞内酶的活性,影响了菌丝的正常生长,使得菌丝生长量明显降低,因此,23 ℃为葡萄状枝瑚菌液体培养的最适温度。
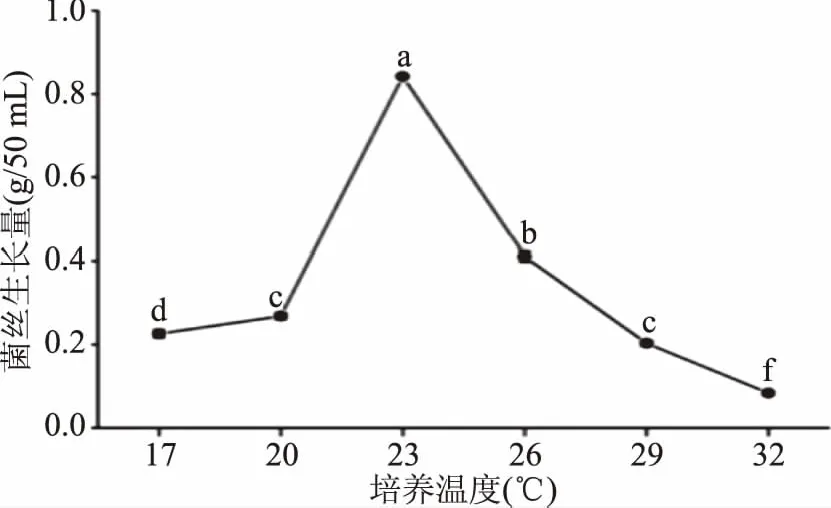
图11 培养温度对葡萄状枝瑚菌菌丝生长量的影响Fig.11 Effect of the temperature on the dry mycelial weight of Ramaria botrytis
2.8 摇床转速对葡萄状枝瑚菌菌丝生长量的影响
摇床转速影响培养液的氧气供应,也显著的影响葡萄状枝瑚菌菌丝体的生长,不同转速影响葡萄状枝瑚菌液体培养中的菌丝生长量(图12)。当转速为120~220 r/min时,菌丝生长量随着转速的增大而增大。220 r/min时,达到最大的菌丝生长量,为1.077 g/50 mL,且与前5个转速间差异显著(p<0.05)。在递增的转速条件下,菌丝生长量也逐渐增加,表面该菌是一种生长时需要提供足够氧气的真菌。当转速达到240 r/min时,菌丝生长量仅为0.187 g/50 mL,低于120 r/min时的0.326 g/50 mL,可能是由于转速过高,剪切力大,不利于菌丝的生长和菌丝球的形成[24],因此,适合葡萄状枝瑚菌液体培养的最佳摇床转速为220 r/min。

图12 摇床转速对葡萄状枝瑚菌菌丝生长量的影响Fig.12 Effect of different rotational speeds of the culture table on the dry mycelial weight of Ramaria botrytis
2.9 正交试优化葡萄状枝瑚菌液体培养基
通过表2中K1、K2、K3的大小,可判断A、B、C、D各因素对本实验中各项指标大小的影响程度。以菌丝平均生长量为试验指标,根据极差值R的大小,可以判断个因素对试验指标的影响主次,上表的计算结果可见,极差值R由大到小依次为A>C>B>D,所以主次因素的影响顺序应为A>C>B>D。由以上对于K和R的计算与分析,可以得出本实验中水平最优的组合是A2B2C3D1,即1L液体培养基的组成为25 g可溶性淀粉,3.5 g酵母粉,4.4 g(1.2 g KH2PO4+1.6 g FeSO4·7H2O+1.6 g MgSO4·7H2O)无机离子,0.01 g VB1。
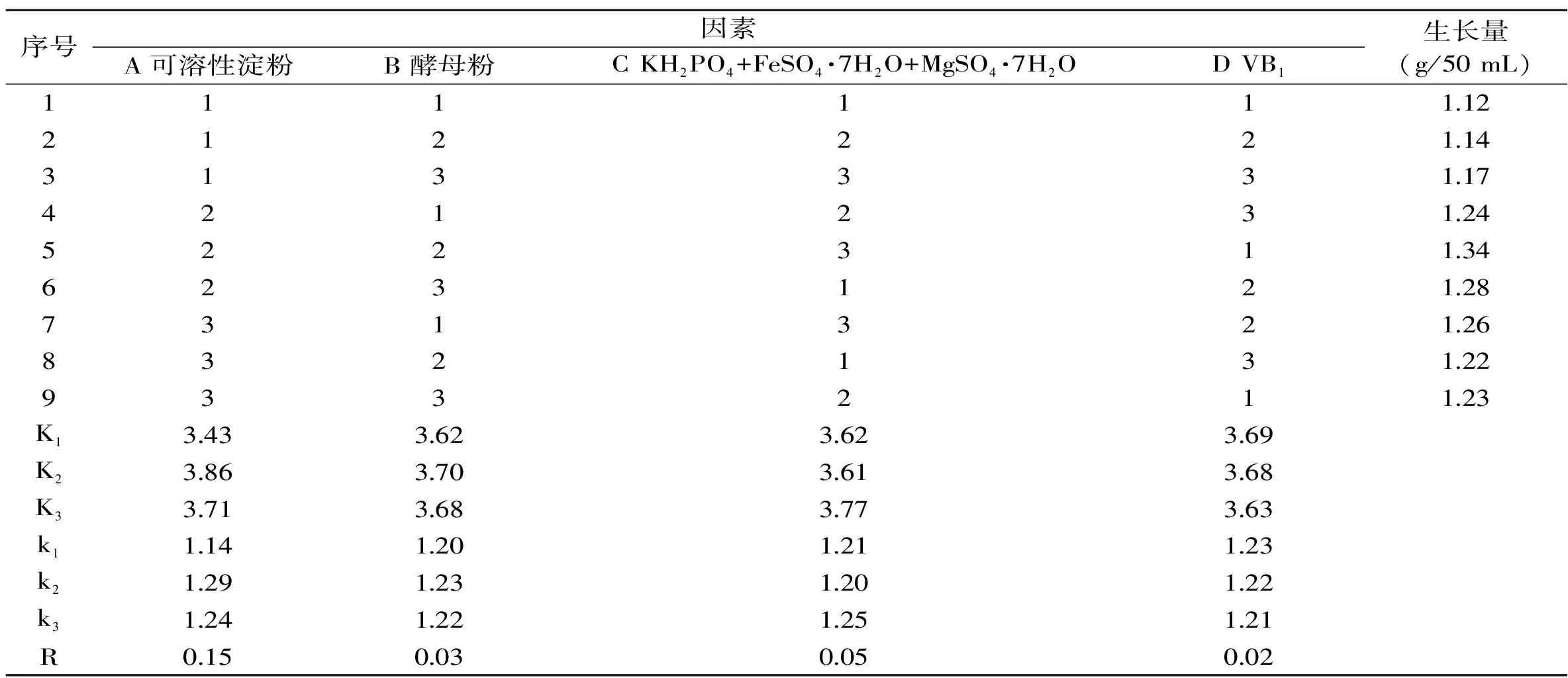
表2 葡萄状枝瑚菌液体培养基正交试验结果与方差分析Table 2 The orthogonal test and range analysis of the optimum medium for the liquid culture of Ramaria botrytis
2.10 验证实验
依照正交试验确定的葡萄状枝瑚菌液体培养的最佳培养基配方,1 L液体培养基中25 g可溶性淀粉,3.5 g酵母粉,4.4 g(1.2 g KH2PO4+1.6 g FeSO4·7H2O+1.6 g MgSO4·7H2O)无机离子,0.01 g VB1配置液体培养基,培养基初始pH6.5,每瓶(50 mL/250 mL)葡萄状枝瑚菌种子液接种量10%(V/V),在23 ℃、摇床转速为220 r/min下全黑暗培养7 d,所得菌丝生长量为(26.8±0.29) g/L。
3 讨论
为了进行食用菌的液体发酵,不论是野生的还是栽培的,考察碳源、氮源、无机盐和生长因子等营养要素与温度、pH、氧气和光照等培养条件的影响是必要的[25-26],从液体培养葡萄状枝瑚菌(Ramariabotrytis)的菌丝生长量来看,与其它大型食用真菌的情况类似[15,22],不同营养要素和不同培养条件对其生长的影响存在差异。通过本实验中的液体培养条件进行对葡萄状枝瑚菌进行培养,其菌丝生长量可达(26.8±0.29) g/L,远高于Tae-Hee等[27]经过30 d液体培养葡萄状枝瑚所得到的最大产量19.23 g/L,在提高了菌丝产量的同时缩短了液体培养的时间。但刑仁昌等[28]液体培养蒙古口蘑(Tricholomamongolicum),最适培养条件下菌丝生长量为30 g/L;易千红等[29]对黄枝瑚菌(Ramariaflava)进行液体培养,最适条件下菌丝生长量为42.6 g/L,与上述几种担子菌液体培养后菌丝生长量相比,本实验中葡萄状枝瑚菌液体培养后的最大产量仍然有待提高。因此,我们将在今后的研究中扩大对碳源、氮源、无机离子和生长因子的筛选范围,并通过优化试验,以提高葡萄状枝瑚菌液体培养的菌丝生长量。
4 结论
本研究通过单因素实验和正交试验,确定了有利于葡萄状枝瑚菌液体培养的最佳培养基为1 L液体培养基中含25 g可溶性淀粉,3.5 g酵母粉,4.4 g(1.2 g KH2PO4+1.6 g FeSO4·7H2O+1.6 g MgSO4·7H2O)无机离子,0.01 g VB1;最佳培养条件为:23 ℃、摇床转速为220 r/min时,培养基初始pH6.5,装瓶量50 mL/250 mL锥形瓶,接种量10%(V/V),全黑暗培养7 d。实验结果为葡萄状枝瑚菌液体深层发酵培养的培养基配方优化以及发酵条件提供了依据。
