饲料精氨酸水平对黄颡鱼幼鱼生长性能、消化吸收相关指标、免疫功能和抗氧化能力的影响
2018-12-13赵红霞陈启明黄燕华曹俊明王国霞陈晓瑛
赵红霞 陈启明 黄燕华 曹俊明* 王国霞 陈 冰 陈晓瑛
(1.广东省农业科学院动物科学研究所,广州510640;2.农业部华南动物营养与饲料重点实验室,广州510640;3.广东省畜禽育种与营养研究重点实验室,广州510640)

黄颡鱼(Pelteobagrusfulvidraco)属鲶形目,鲿科,黄颡鱼属。其肉质细嫩、味道鲜美、无肌间刺[9],有独特风味,是营养丰富的动物性食品[10]。因为优良的肉质,黄颡鱼不仅在国内有很好的销量,日本、韩国和东南亚也是潜在的市场[11]。为满足市场需求,我国近年的黄颡鱼规模化养殖不断增加,对黄颡鱼营养需求的研究也成为热点。Zhou等[12]研究了黄颡鱼对精氨酸的适宜需要量。沈勇等[13]通过检测黄颡鱼消化酶活性和养分消化率探讨饲料精氨酸与赖氨酸配比对黄颡鱼消化吸收的影响。本实验室前期研究表明,饲料中适宜水平的精氨酸可显著提高黄颡鱼幼鱼的生长性能和抗氨氮应激能力[14]。但是,关于饲料中精氨酸水平对黄颡鱼幼鱼消化吸收相关酶活性、免疫功能和抗氧化能力影响方面的研究尚不多见。为丰富精氨酸在黄颡鱼研究领域的应用成果,本试验通过在饲料中添加不同水平的精氨酸,研究其对黄颡鱼幼鱼生长性能、消化吸收相关酶活性、免疫功能和抗氧化能力的影响,评估精氨酸在黄颡鱼实用饲料中的适宜添加水平,为精氨酸在黄颡鱼配合饲料中的应用提供理论依据。
1 材料与方法
1.1 试验设计
以鱼粉、豆粕为主要蛋白质源,面粉为主要糖源,鱼油、豆油为主要脂肪源,以丙氨酸作为等氮替代物,通过添加不同水平的精氨酸(L-精氨酸盐酸盐,纯度≥99%,购自宁波大榭开发区海德氨基酸工业有限公司),配制成精氨酸水平分别为2.44%、2.64%、2.81%、3.01%和3.23%的5种等氮等脂(蛋白质水平为42%,脂肪水平为9%)实用饲料,饲料蛋白质和脂肪水平等参照本实验室前期研究[15]设定。饲料原料经粉碎后过60目筛,按配方准确称取,各种饲料原料逐级混匀后,于NH-10型捏合机中(华南理工大学科技实业总厂)加入鱼油、豆油,混合均匀后,加适量水在B20强力搅拌机(广州市番禺力丰食品机械厂)中搅拌,用SLX-80型双螺杆挤压机(华南理工大学科技实业总厂)制成1.5 mm的条状,在G-500型造粒机(华南理工大学科技实业总厂)中制成颗粒饲料,55 ℃烘干,自然冷却后放入密封袋,置于-20 ℃冰箱中保存备用。试验饲料组成及营养水平见表1,试验饲料氨基酸组成见表2。

表1 试验饲料组成及营养水平(风干基础)
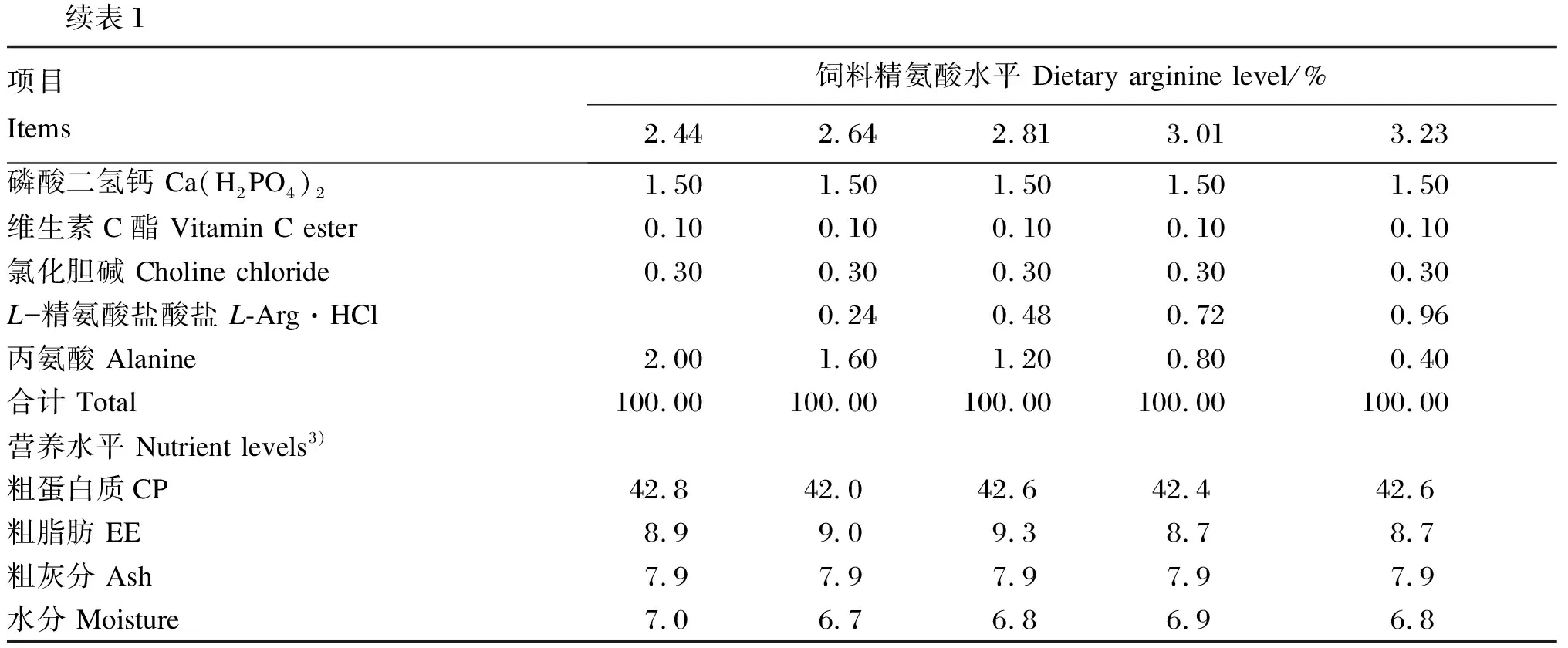
续表1项目 Items饲料精氨酸水平 Dietary arginine level/%2.442.642.813.013.23磷酸二氢钙 Ca(H2PO4)21.50 1.50 1.50 1.50 1.50 维生素C酯 Vitamin C ester0.10 0.10 0.10 0.10 0.10 氯化胆碱 Choline chloride0.30 0.30 0.30 0.30 0.30 L-精氨酸盐酸盐 L-Arg·HCl0.24 0.48 0.72 0.96 丙氨酸 Alanine2.00 1.60 1.20 0.80 0.40 合计 Total100.00 100.00 100.00 100.00 100.00 营养水平 Nutrient levels3)粗蛋白质CP42.8 42.0 42.6 42.4 42.6 粗脂肪 EE8.9 9.0 9.3 8.7 8.7 粗灰分 Ash7.9 7.9 7.9 7.9 7.9 水分 Moisture7.0 6.7 6.8 6.9 6.8
1)每千克维生素预混料含有 Contained the following per kg of vitamin premix:VA 3 200 000 IU,VB14 g,VB28 g,VB64.8 g,VB1216 mg,VD31 600 000 IU,VE 16 g,VK 4 g,泛酸钙 calcium pantothenate 16 g,叶酸 folic acid 1.28 g,烟酸 nicotinic acid 28 g,肌醇 inositol 40 g,生物素 biotin 64 mg。
2)每千克矿物质预混料含有 Contained the following per kg of mineral premix:MgSO4·H2O 12 g,Ca(IO3)29 g,KCl 36 g,Met-Cu 1.5 g,ZnSO4·H2O 10 g,FeSO4·H2O 1 g,Met-Co 250 mg,NaSeO30.003 6 g。
3)营养水平为实测值。Nutrient levels were measured values.

表2 试验饲料氨基酸组成(风干基础)
1.2 试验鱼与饲养管理
试验用黄颡鱼幼鱼购自广东省清远市黄沙渔业基地。养殖试验在广东省农业科学院动物科学研究所水产研究室室内循环水养殖系统中进行,养殖用水为曝气的自来水,进水速率为1.5 L/min,试验系统由直径80 cm、高70 cm的圆柱形玻璃纤维桶组成,容水量约为300 L。试验开始前将黄颡鱼幼鱼在室外水泥池中暂养2周,期间投喂商品饲料(蛋白质水平为40%,脂肪水平为9.5%),每天2次(08:30和18:30)。暂养结束后,选取初始体均重为(1.13±0.02) g的黄颡鱼幼鱼700尾,随机分为5组,每组4个重复,每个重复35尾鱼,分别投喂5种精氨酸水平的试验饲料。投喂量为体重的5%~6%,每天08:30和18:30各投喂1次,上午投喂40%,下午投喂60%,根据摄食情况调整投喂量。养殖系统采取循环水过滤系统,定时换水,定期测定水质,试验期间水温29.5~33.0 ℃,自然光源,氨氮浓度<0.20 mg/L,亚硝酸盐浓度<0.01 mg/L,溶氧浓度>6.0 mg/L,pH 7.4~7.9。养殖试验为期56 d。
1.3 样品采集
养殖试验结束后停食24 h,称量终末体重并统计存活数。从每个重复随机选取15尾鱼,放入120 mg/L的MS-222溶液中麻醉,随机取10尾静脉取血,4 000 r/min离心10 min,取上清液分装制备血清,-80 ℃冰箱保存备用;剩下的5尾于冰上迅速解剖和剥离胃、肝脏和肠道,-80 ℃冰箱保存,用于消化吸收相关酶活性的测定。
1.4 指标测定
1.4.1 生长性能指标计算
存活率(SR,%)=100×终末尾数/初始尾数;
增重率(WGR,%)=100×(终末体重-
初始体重)/初始体重;
FCR=饲料摄入量/(终末体重-初始体重)。
1.4.2 饲料营养成分检测
饲料营养成分采用AOAC(1984)[17]中方法测定。其中,水分含量采用105 ℃烘干恒重法测定,粗蛋白质含量采用凯氏定氮法测定,粗脂肪含量采用索氏抽提法测定,粗灰分含量采用高温550 ℃马弗炉灰化法测定。饲料经盐酸水解后采用高效液相色谱仪(HPLC)分析系统(LC1260,安捷伦科技公司)安捷伦ZORBAX c18(150 mm×5 μm)测试柱测定氨基酸组成。
1.4.3 血清免疫、抗氧化指标和胃、肝脏、肠道消化吸收相关指标测定
血清免疫、抗氧化指标和胃、肝脏、肠道消化吸收相关酶活性采用试剂盒检测,试剂盒均购自南京建成生物工程研究所,具体测定方法参照试剂盒所附说明书。血清免疫指标:血清一氧化氮(NO)、补体4(C4)、免疫球蛋白(IgM)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)含量,血清抗氧化指标:超氧化物歧化酶(SOD)、过氧化物酶(POD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性与总抗氧化能力(T-AOC)及丙二醛(MDA)含量。消化吸收相关指标:胃、肝脏和肠道蛋白酶、脂肪酶、淀粉酶活性,肠道碱性磷酸酶(AKP)、γ-谷氨酰转移酶(γ-GT)、Na+/K+-ATP酶(Na+K+-ATPase)活性及内皮素1(ET-1)含量。
1.5 数据统计与分析
试验数据用平均值±标准差(mean±SD,n=4)表示,采用SPSS 20.0软件进行统计分析。先对试验数据开展方差齐性检验,满足方差齐性条件则进行单因素方差分析(one-way ANOVA),差异显著再用Tukey’s检验方法进行多重比较;方差齐性条件不满足的,则用Dunnett’s T3检验法进行多重比较。差异显著性水平为P<0.05。
2 结果与分析
2.1 黄颡鱼幼鱼的生长性能
各组黄颡鱼幼鱼养殖56 d后的存活率均为100%,未出现死亡情况。由表3可知,随着饲料中精氨酸水平的升高,黄颡鱼幼鱼的WGR呈先升后降、FCR呈先降后升趋势,在2.64%组分别达到最大值和最小值。与3.23%组相比,2.64%组和2.81%组黄颡鱼幼鱼的WGR显著升高(P<0.05),2.64%组、2.81%组和3.01%组黄颡鱼幼鱼的FCR显著降低(P<0.05)。以黄颡鱼幼鱼的WGR和FCR为评价指标,经二次回归模型分析得出黄颡鱼幼鱼对饲料中精氨酸的需求量分别为2.74%(占饲料蛋白质的6.45%)(图1)和2.75%(占饲料蛋白质的6.47%)(图2)。
2.2 黄颡鱼幼鱼的消化酶活性
由表4可知,黄颡鱼幼鱼的胃蛋白酶和淀粉酶活性在3.01%组达到最高,显著高于2.44%组(P<0.05)。2.81%组和3.01%组黄颡鱼幼鱼的胃脂肪酶活性显著高于其他各组(P<0.05)。2.64%组、2.81%组、3.23%组黄颡鱼幼鱼的肝脏淀粉酶活性显著高于2.44%组(P<0.05)。饲料中精氨酸水平对黄颡鱼幼鱼的肝脏蛋白酶、脂肪酶活性和肠道蛋白酶、脂肪酶、淀粉酶活性没有产生显著影响(P>0.05)。

表3 投喂含不同精氨酸水平饲料56 d后黄颡鱼幼鱼的生长性能
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.

图1 饲料精氨酸水平与黄颡鱼幼鱼增重率的关系

图2 饲料精氨酸水平与黄颡鱼幼鱼饲料系数的关系
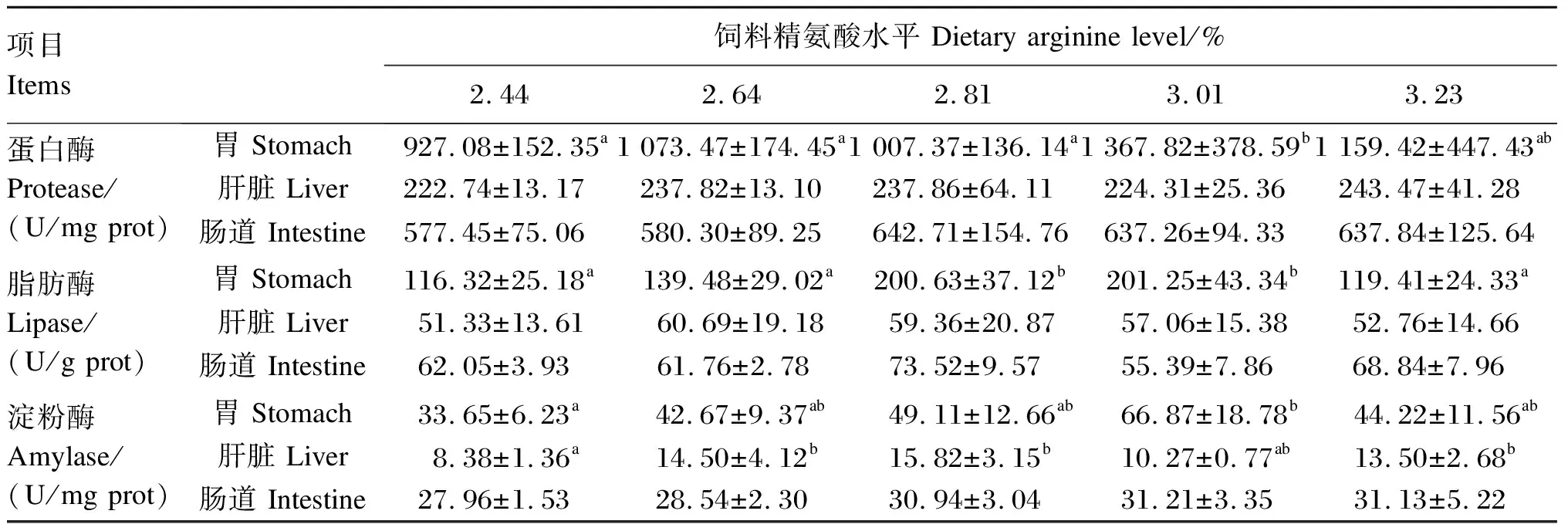
项目 Items饲料精氨酸水平 Dietary arginine level/%2.442.642.813.013.23蛋白酶Protease/(U/mg prot) 胃 Stomach927.08±152.35a1 073.47±174.45a1 007.37±136.14a1 367.82±378.59b1 159.42±447.43ab肝脏 Liver222.74±13.17237.82±13.10237.86±64.11224.31±25.36243.47±41.28肠道 Intestine577.45±75.06580.30±89.25642.71±154.76637.26±94.33637.84±125.64脂肪酶 Lipase/(U/g prot) 胃 Stomach116.32±25.18a139.48±29.02a200.63±37.12b201.25±43.34b119.41±24.33a肝脏 Liver51.33±13.6160.69±19.1859.36±20.8757.06±15.3852.76±14.66肠道 Intestine62.05±3.9361.76±2.7873.52±9.5755.39±7.8668.84±7.96淀粉酶Amylase/(U/mg prot) 胃 Stomach33.65±6.23a42.67±9.37ab49.11±12.66ab66.87±18.78b44.22±11.56ab肝脏 Liver8.38±1.36a14.50±4.12b15.82±3.15b10.27±0.77ab13.50±2.68b肠道 Intestine27.96±1.5328.54±2.3030.94±3.0431.21±3.3531.13±5.22
2.3 黄颡鱼幼鱼的肠道吸收相关指标
由表5可知,2.64%组、2.81%组、3.01%组和3.23%组黄颡鱼幼鱼肠道AKP活性显著高于2.44%组(P<0.05)。2.64%组和2.81%组黄颡鱼幼鱼肠道γ-GT活性显著高于2.44%组、3.01%组和3.23%组(P<0.05)。饲料中精氨酸水平对黄颡鱼幼鱼肠道Na+/K+-ATPase活性和ET-1含量没有产生显著影响(P>0.05)。

表5 投喂含不同精氨酸水平饲料56 d后黄颡鱼幼鱼的肠道碱性磷酸酶、
2.4 黄颡鱼幼鱼的血清免疫指标
由表6可知,2.81%组和3.01%组黄颡鱼幼鱼血清NO含量显著高于2.44%组(P<0.05),2.64%组、2.81%组、3.01%组和3.23%组黄颡鱼幼鱼血清IL-1β含量显著低于2.44%组(P<0.05),2.44%组和2.64%组黄颡鱼幼鱼血清IL-6含量显著高于2.81%组(P<0.05)。饲料中精氨酸水平对黄颡鱼幼鱼血清C4、IgM、TNF-α含量未产生显著影响(P>0.05)。以黄颡鱼幼鱼血清NO含量为评价指标,经二次回归模型分析得出黄颡鱼幼鱼对饲料中精氨酸的需求量为2.94%(占饲料蛋白质的6.92%)(图3)。

表6 投喂含不同精氨酸水平饲料56 d后黄颡鱼幼鱼的血清免疫指标
2.5 黄颡鱼幼鱼的血清抗氧化指标
由表7可知,2.64%组黄颡鱼幼鱼血清GSH-Px活性显著高于2.44%组(P<0.05),2.64%组黄颡鱼幼鱼血清CAT活性显著高于2.44%组、3.01%组和3.23%组(P<0.05),3.01%组黄颡鱼幼鱼血清MDA含量显著低于2.64%组(P<0.05)。饲料中精氨酸水平对黄颡鱼幼鱼血清SOD、POD活性和T-AOC未产生显著影响(P>0.05)。
3 讨 论
3.1 饲料精氨酸水平对黄颡鱼幼鱼生长性能的影响
精氨酸可以参与体内蛋白质及多胺的合成,促进生长[1-2]。已有研究表明,精氨酸可以提高鱼类的生长性能[3-6]。本试验结果表明,随着饲料精氨酸水平的升高,黄颡鱼幼鱼的WGR升高、FCR降低,在2.64%组分别达到最大值和最小值,说明适宜水平的精氨酸可以提高黄颡鱼幼鱼的生长性能。利用二次回归模型拟合WGR和饲料精氨酸水平,得出黄颡鱼幼鱼对饲料中精氨酸的需求量为2.74%(占饲料蛋白质的6.45%)。该结果在鱼类精氨酸需求量范围(占饲料蛋白质的3.8%~8.1%)[12,18-21]之内。随着饲料精氨酸水平的进一步升高,黄颡鱼幼鱼的生长性能呈现下降趋势,该现象与在金鲳(Trachinotusovatus)[1]、尼罗罗非鱼(OreochromisniloticusL.)[3]和军曹鱼(Rachycentroncanadum)[18]等上的研究结果类似。在对哺乳动物中的研究发现,饲料中过量的精氨酸导致动物生长性能下降可能是由于精氨酸-赖氨酸的拮抗作用造成的,但是这一作用在鱼类中是否存在还存在争议[2]。Berge等[19]和廖英杰等[20]的研究认为,大西洋鲑(Salmosalar)和团头鲂存在精氨酸-赖氨酸拮抗现象,而Alam等[21]和Zhou等[12]研究结果则认为牙鲆(Paralichthysolivaceus)和黄颡鱼不存在精氨酸-赖氨酸拮抗现象。
沈勇等[13]发现黄颡鱼饲料中精氨酸与赖氨酸比值约为1.20时,能够显著促进生长性能,但饲料中赖氨酸添加量过量则抑制黄颡鱼的生长。在黄颡鱼中是否存在精氨酸-赖氨酸拮抗现象还有待于进一步研究。

图3 饲料精氨酸水平与黄颡鱼幼鱼

项目 Items饲料精氨酸水平 Dietary arginine level/%2.442.642.813.013.23谷胱甘肽过氧化物酶GSH-Px/(U/mL) 163.65±15.60a303.18±80.83b198.53±65.19ab192.83±36.50ab258.68±99.26ab过氧化氢酶 CAT/(U/mL)3.30±0.58a5.38±0.63b3.89±1.01ab2.95±0.12a3.68±1.04a超氧化物歧化酶 SOD/(U/mL)66.72±0.8668.38±9.1867.68±2.9666.44±4.6469.87±4.57过氧化物酶 POD/(U/mL)45.96±9.5256.46±17.2343.04±0.6637.86±5.3547.88±0.43总抗氧化能力 T-AOC/(U/mL)2.07±0.901.51±0.761.89±1.052.79±0.831.71±1.03丙二醛 MDA/(nmol/L)8.60±0.35ab9.57±0.18b9.39±0.81ab8.18±0.57a8.58±1.24ab
3.2 饲料精氨酸水平对黄颡鱼幼鱼消化酶活性的影响
消化酶是生物体内催化各种生化反应的一类特殊的蛋白质,主要作用是消化和分解生物体从外界所摄取的食物,为生长和发育提供所需的各种营养物质[22]。王际英等[23]研究发现,饲料精氨酸水平可以显著影响仿刺参肠道蛋白酶的活性,对脂肪酶和淀粉酶活性无显著影响。Chen等[24]的研究表明,精氨酸可以显著提高建鲤蛋白酶和脂肪酶的活性,对淀粉酶活性无显著影响。王连生等[25]试验证明,饲料中添加精氨酸显著提高杂交鲟前肠蛋白酶和淀粉酶活性。本试验结果表明,饲料中适宜水平的精氨酸显著提高了黄颡鱼幼鱼胃蛋白酶、脂肪酶和淀粉酶活性及肝脏淀粉酶活性。精氨酸对不同鱼类消化酶活性的影响不尽相同,影响鱼类消化酶活性的因素有很多,如食性、生长阶段、理化因子(如水温、pH、盐度等)、营养与饲料(饲料原料、饲料添加剂等)等[26]。沈勇等[13]研究发现,饲料中精氨酸/赖氨酸为2.19/2.61组黄颡鱼的肝脏、肠道胰蛋白酶活性显著高于精氨酸/赖氨酸为3.07/2.61、2.19/3.65和3.08/3.65组,胃蛋白酶活性在饲料精氨酸/赖氨酸为1.74/2.08、1.74/30.2和2.63/2.08组显著高于其他各组。本试验结果与之不同,黄颡鱼幼鱼胃蛋白酶和淀粉酶活性在精氨酸水平为3.01%时达到最高,胃脂肪酶活性在精氨酸水平为3.01%达到最高,肝脏淀粉酶活性在精氨酸水平为2.64%、2.81%和3.23%时较2.44%时显著升高。精氨酸来源、精氨酸/赖氨酸、饲料组成等军可能影响精氨酸的利用,从而导致黄颡鱼幼鱼消化酶活性出现较大差异。
3.3 饲料精氨酸水平对黄颡鱼幼鱼肠道吸收相关指标的影响
肠道不仅在消化吸收营养物质过程中发挥着重要作用,而且是集内分泌、免疫、屏障等功能为一体的重要器官,鱼类肠道健康对于鱼体的整体健康起到非常重要的作用[27-28]。AKP、γ-GT、Na+K+-ATPase活性和ET-1含量是反映肠道对营养物质代谢、转运和消化吸收功能的指标,目前尚未见关于精氨酸对黄颡鱼肠道AKP、γ-GT、Na+K+-ATPase活性和ET-1含量影响的相关报道。本试验中,饲料精氨酸水平对黄颡鱼幼鱼肠道Na+K+-ATPase活性和ET-1含量没有产生显著影响。分布于动物肠道上皮刷状缘细胞表面的肠型碱性磷酸酶(IAKP)与维生素D、钙、氨基酸、胆固醇、脂类和葡萄糖等多种营养物质吸收有关[29-30]。本试验结果显示,饲料中添加精氨酸显著提高黄颡鱼幼鱼肠道AKP活性,表明精氨酸可以增强黄颡鱼肠道的吸收能力,促进营养物质的代谢。γ-GT是谷氨酸循环的关键酶,能促进氨基酸向细胞内转运,为蛋白质生物合成提供原料[31]。本试验发现,2.64%组和2.81%组黄颡鱼幼鱼肠道γ-GT活性显著高于2.44%组、3.01%组和3.23%组,表明饲料中适宜水平的精氨酸能够提高黄颡鱼幼鱼肠道γ-GT活性,促进体内氨基酸的转运。
3.4 饲料精氨酸水平对黄颡鱼幼鱼免疫功能的影响
鱼类和哺乳动物一样,具有非特异性和特异性免疫功能,能通过黏膜屏障、组织和体液中各种免疫细胞和因子共同抵御病原入侵[32]。补体系统可以被抗原-抗体复合物激活或直接被抗原激活,结合到抗原表面,也可以被外源细菌凝集素和炎症初期产生的蛋白共同激活,辅助非特异性和特异性免疫[33]。C4是补体系统中的主要成分,是体内具有酶原活性的球蛋白[34]。本试验条件下,饲料精氨酸水平对血清C4含量无显著影响,与廖英杰等[20]在团头鲂幼鱼上的研究结果一致。大量研究表明,鱼类能进行体液和细胞免疫应答,而免疫球蛋白是鱼类特异性体液免疫应答的主要介质[35]。本试验研究显示,精氨酸对黄颡鱼幼鱼血清IgM含量无显著影响。NO既是肿瘤免疫、微生物免疫的效应分子,又是多种免疫细胞的调节因子。在本试验中,随着饲料中精氨酸水平的升高,黄颡鱼幼鱼血清NO含量呈现先上升后下降的趋势,表明饲料中添加适量的精氨酸可以增强黄颡鱼幼鱼发免疫功能。炎症是常见的病理过程,可以生于机体各部位的组织和各器官,参与炎症反应的各种细胞因子主要有IL-1β、IL-6和TNF-α等。Zheng等[36]研究发现,精氨酸可以降低断奶仔猪肝脏IL-6和TNF-α的mRNA表达量。Tan等[37]的研究显示,精氨酸可以降低肉鸡肠道IL-1β的mRNA表达量。本试验结果亦显示,饲料精氨酸水平的升高可以降低黄颡鱼幼鱼血清促炎因子IL-1β、IL-6的含量,表明精氨酸可以在一定程度上缓解黄颡鱼机体的炎症反应,与Holen等[38]在大西洋鲑上得出的结论一致。
3.5 饲料精氨酸水平对黄颡鱼幼鱼抗氧化能力的影响

4 结 论
饲料中适宜水平的精氨酸可提高黄颡鱼幼鱼的WGR,降低FCR,增强消化吸收能力、免疫功能和抗氧化能力。以黄颡鱼幼鱼的WGR和血清NO含量为评价指标,经二次回归模型分析得出黄颡鱼幼鱼对饲料中精氨酸的需求量分别为2.74%(占饲料蛋白质的6.45%)和2.94%(占饲料蛋白质的6.92%)。
