山东省副猪嗜血杆菌分子流行病学调查及其外膜蛋白P2基因的表达纯化
2018-11-23李建达任素芳郭立辉孙文博丛晓燕吴家强
杨 杰,李建达,曾 昊,任素芳,郭立辉,孙文博,陈 智,丛晓燕,于 江,吴家强,3
(1.山东省农业科学院畜牧兽医研究所,济南250100;2.山东省畜禽疫病防治与繁育重点实验室,济南250100;3.山东师范大学生命科学学院,济南250014)
副猪嗜血杆菌(Haemophilus parasuis,Hps)是一种革兰氏阴性菌,形态具有多形性,主要侵害4~8周龄仔猪。由Hps引起的疾病称为副猪嗜血杆菌病,又称格拉泽氏病(Glässer’s disease),发病仔猪表现出纤维素性胸膜炎、腹膜炎、心包炎、关节炎,甚至脑膜炎等症状,发病率为10%~15%左右,严重时死亡率可达50%[1]。近几年,Hps引起猪多发性浆膜炎和关节炎的报道在我国各地猪场中屡见不鲜,北京市、黑龙江省、辽宁省、山东省、河南省、湖南省、宁夏回族自治区、湖北省等地均有检测分离出Hps的报道,其感染造成的损失相当严重[2]。随着规模化养猪业的发展,Hps已经成为影响全球养猪业健康发展的主要细菌之一。
Hps的血清型复杂多样,可分为15个血清型,另外有20%左右的分离菌株未能进行血清学分型[3]。蔡旭旺等[4]研究表明我国以血清4型和5型最为流行,其次是13型、14型和12型。本实验室前期调查发现血清1型在我国也较为流行[5]。
目前,Hps的毒力因子主要包括脂多糖(lipopolysaccharides,LPS)、转铁蛋白、菌毛、荚膜(capsule,CP)、外膜蛋白(outer membrane proteins,Omp)等[6-12]。其中Omp是革兰阴性菌外膜的主要结构,可同时激发机体的体液免疫和细胞免疫,具有异种血清型的免疫交叉保护作用,是一种潜在的共同保护性抗原。Mü nch等[13]研究结果表明,不同血清型菌株抗原性不同,用Hps感染动物产生的抗体针对Omp而不是LPS 和氨甲酰磷酸合成酶(carbamoyl phosphate synthetase,CPS),说明Omp具有很好的免疫原性。也有研究发现Omp能够降低Hps在小鼠血液、肝脏和肺脏中的定植及其引起的病理损伤[14]。Tadjine等[15]报道Hps的15个血清型均与1个主要的外膜蛋白反应,这个蛋白属于革兰阴性菌的Omp家族,表明这个蛋白可能是一个很好的诊断标记的候选蛋白。有研究表明重组表达的OmpP2能与血清5型交叉反应[16-17],诱导免疫应答。
本实验室对山东省Hps进行了分子流行病学调查,明确Hps分离株ompP2基因的遗传演化规律,成功构建Hps OmpP2的原核表达载体,获得了OmpP2蛋白高效表达的工程菌。通过对IPTG诱导浓度、温度及诱导时间的摸索,确定OmpP2蛋白的最佳表达条件,并获得高纯度的OmpP2蛋白。
1 材料与方法
1.1 质粒、菌株及试剂pEASY-Blunt克隆载体购自北京全式金生物技术有限公司;原核表达载体pET-30a、表达菌株BL21、Hps菌、Hps阳性兔血清由本实验室保存;TransStartFastPfu DNA Polymerase、感受态Trans-5α为北京全式金生物技术有限公司产品;T4 DNA Ligase,限制性内切酶Nde I、BamH I、Sph I、Xho I为美国Thermo公司产品;DNA Marker DL2000、DL5000、Taq酶等购自大连宝生物工程有限公司;凝胶回收试剂盒、质粒提取试剂盒购自天根生化科技有限公司;His标签鼠的单克隆抗体购自艾美捷科技有限公司;辣根过氧化物酶(HRP)标记的羊抗鼠/羊抗兔二抗购自武汉博士德生物工程有限公司;硝酸纤维素膜(NC膜)购自上海金标生物技术有限公司。
1.2 引物设计根据参考文献[18],合成Hps特异性鉴定引物。上游引物:5'-GTGATGAGGAAGGGTG GT-3',下游引物:5'-GGCTTCGTCACCCTCTG T-3'。参考GenBank上发表的Hps外膜蛋白P2序列(FJ685754.1)设计1对引物,在上游引物的5'端加入Nde I酶切位点,下游引物5'端加入BamH I酶切位点,PCR扩增ompP2基因。引物由上海生工生物工程股份有限公司合成。上游引物P1:5'-CGCCA TATGATGAAAAAAACACTAGTAGCATTAGC-3'(斜体代表Nde I酶切位点),下游引物P2:5'-CCG GGATCCTTACCATAATACACGTAAACCAACA-3'(斜体代表BamH I酶切位点)。
1.3 Hps分子流行病学调查2015年和2016年从山东省多个地区的猪场,无菌采集疑似病料共225份(包括发病猪、病死猪或发病猪的血液、肺脏、心包液、脑、关节液),划线接种于含10 mg/mLNAD和5%新生牛血清的TSA培养基上,置于37℃培养箱培养36~72 h,观察细菌菌落形态,挑取疑似菌落进行Hps PCR扩增[5]。
1.4 ompP2基因的扩增及遗传演化分析将PCR鉴定阳性的Hps,采用直接煮沸法从Hps培养液中提取DNA,PCR反应体系50 μL:10×Buffer10 μL,2.5×dNTP 5 μL(2.5 μmol/L),10 μmol/L引物P1、P2各2 μL,TransStartFastPfu DNA Polymerase 1 μL,DNA模板2 μL,去离子水28 μL。反应条件:95℃预变性2 min;95℃变性45 s,65℃退火45 s,72℃延伸90 s,32个循环;72℃再延伸10 min。PCR产物经1%琼脂糖凝胶电泳后,纯化回收,与pEASY-Blunt载体连接,并转化Trans-5α感受态细胞,提取质粒进行PCR鉴定和酶切鉴定,将阳性质粒送上海生工生物工程技术服务有限公司进行序列测定。
对17株Hps 分离株与NCBI中公布的SW124 OmpP2序列(HM172009.1)以及Hps 血清5型分离株LZ株,用DNASTAR软件进行氨基酸同源性比对及遗传进化树分析。
1.5 同源性蛋白的交叉反应性分析选取与Hps血清5型分离株LZ株同源性较近的两株分离株5和WFZC,感染猪肺泡巨噬细胞8 h,以LZ株阳性兔血清作为一抗,以FITC标记的羊抗兔抗体作为二抗,荧光显微镜观察结果,以确定具有一定同源性蛋白的交叉反应性。
1.6 ompP2基因原核表达载体的构建及鉴定将测序正确的Hps 血清5型LZ株的ompP2重组质粒pEASY-ompP2和pET-30a原核表达载体,分别用限制性内切酶Nde I和BamHI进行双酶切,纯化回收,连接后转化BL21表达菌株,挑取单克隆进行Sph I和Xho I双酶切鉴定,并将阳性质粒送上海生工生物工程技术服务有限公司进行序列测定。
1.7 OmpP2蛋白的表达与纯化待菌液培养至OD600为0.8时,加入IPTG(终浓度0.25 mmol/L),分别于15℃、37℃进行诱导表达,超声破碎至菌液清亮,取超声后的上清和沉淀分别上样。分别用50、100、500 mmol/L浓度的咪唑平衡缓冲液洗脱目的蛋白,并收集每个洗脱组分,进行SDS-PAGE分析检测。
1.8 OmpP2纯化蛋白的鉴定纯化后的OmpP2蛋白用His标签鼠的单克隆抗体作为一抗,以辣根过氧化物酶(HRP)标记的羊抗鼠抗体作为二抗进行Western blot鉴定,显色,观察条带。
1.9 OmpP2蛋白的反应原性分析纯化后的OmpP2蛋白电泳后,转印到NC膜上,用血清2型、4型、5型、13型、15型阳性兔血清作为一抗,以辣根过氧化物酶(HRP)标记的羊抗兔抗体作为二抗,显色,观察条带,以确定纯化的OmpP2蛋白与不同血清型Hps 阳性血清之间的反应原性。
2 结果
2.1 Hps的分离鉴定225份样品中共分离获得17株Hps 分离株,在含10 mg/mL NAD和5%新生牛血清的TSA培养基上生长出圆形、光滑湿润、无色透明的露珠状小菌落(图1),PCR扩增获得长度为822 bp的目的条带。2015年和2016年Hps 的检出率分别是7.63%、7.48%(表1)。

图1 Hps分离株革兰氏染色镜检形态Fig.1 The microscopic observation result of Hps isolates
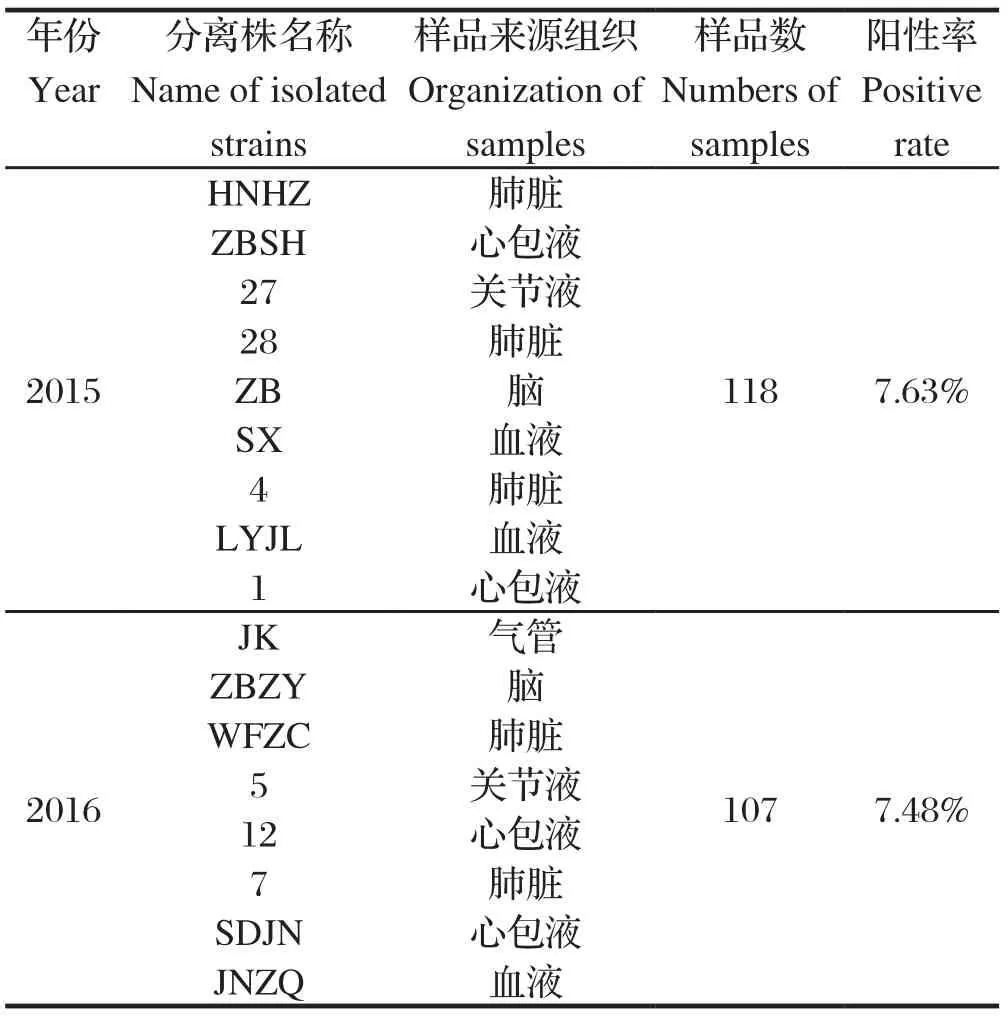
表1 Hps分离菌株检出情况Table 1 The detection of Hps isolates from samples
2.2 ompP2基因的扩增PCR扩增Hps ompP2基因,可获得大小为1000 bp左右的扩增片段,与预期目的片段大小相符(图2)。
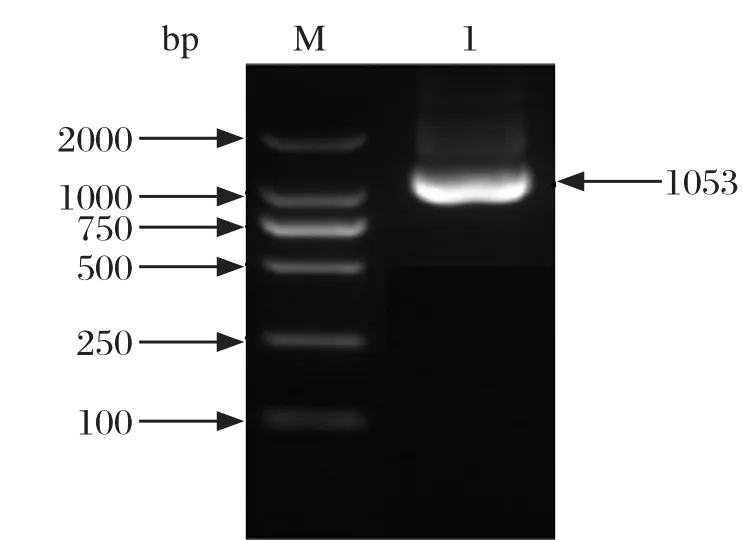
图2 Hps ompP2基因的PCR扩增结果Fig.2 The PCR ampli fication results of Hps ompP2 gene
2.3 序列比对分析用DNASTAR软件对17株Hps 分离株与NCBI中公布的SW124 OmpP2序列(登录号:HM172009.1)及Hps 血清5型分离株LZ株进行氨基酸序列比对分析,结果发现有大片段的连续或不连续缺失,主要出现在146~170 aa和256~279 aa处(图3)。

图3 HpsOmpP2蛋白分离株氨基酸序列比对结果Fig.3 Amino acid sequence alignment of OmpP2 protein between Hps isolates
2.4 同源性分析将PCR检测为阳性的17株Hps分离株与NCBI中公布的SW124 OmpP2序列(HM172009.1)及Hps 血清5型分离株LZ株进行氨基酸同源性比对,结果见表2。17株山东分离株与SW124的同源性为87.7%~96.1%,与血清5型LZ株的同源性为94.3%~99.1%,而17株山东分离株之间的核苷酸同源性为88.2%~97.8%。
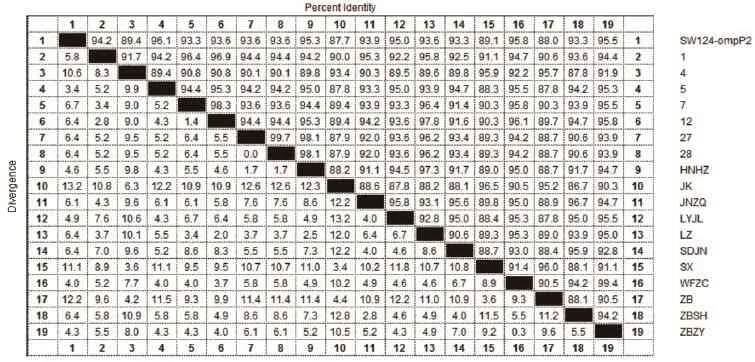
表2 Hps氨基酸序列同源性比较结果Table 2 Homology comparison of amino acid sequences between Hps isolates
2.5 遗传进化树分析结果显示,遗传进化树主要分为两个大支,其中13株分离株属于一个大支,与参考株SW124和LZ株属于同一支系;而其余4株则属于另一大支,与参考株SW124和LZ株亲缘关系相对较远(图4)。
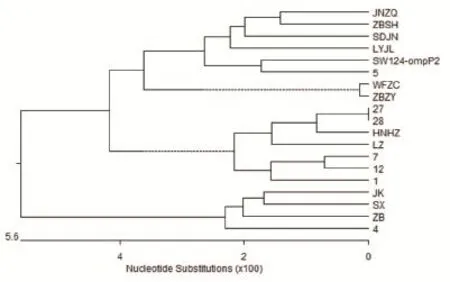
图4 ompP2基因遗传进化树Fig.4 The genetic phylogenetic tree of ompP2 gene
2.6 同源性蛋白的交叉反应性分析用Hps 血清5型LZ株阳性兔血清作为一抗进行免疫荧光,分离株5和WFZC均有绿色荧光出现,而未用Hps 感染的细胞无绿色荧光出现,说明同源性蛋白具有一定的交叉反应性(图5)。

图5 免疫荧光检测结果Fig.5 The result of immuno fl uorescence assay
2.7 原核表达载体pET-30-ompP2的酶切鉴定重组质粒经Nde I和Hind III双酶切鉴定,结果可见酶切后呈两条带(图6),阳性样品送上海生工生物工程技术服务有限公司进行序列测定,将测序成功的质粒命名为pET-30-ompP2。
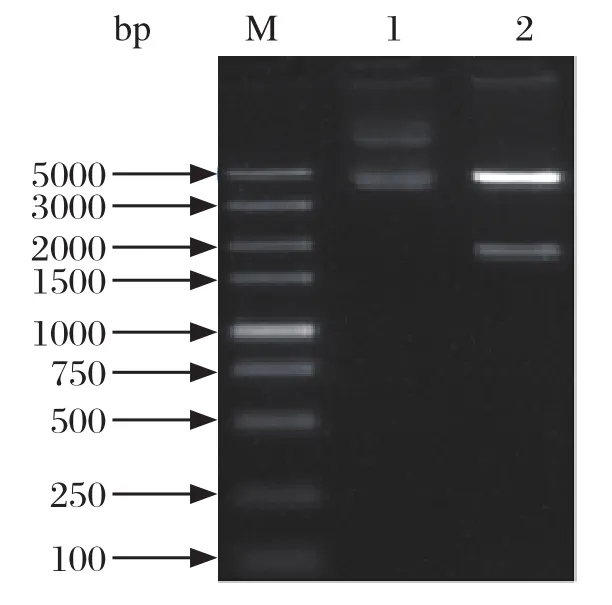
图6 重组质粒pET-30a-ompP2酶切鉴定结果Fig.6 Identi fication of recombinant plasmid pET-30aompp2 by enzyme digestion
2.8 OmpP2蛋白最佳诱导条件的确定将菌液分别置于15℃、37℃诱导表达,结果发现37℃诱导4 h,OmpP2蛋白表达效果更好,目的条带大小为39 kDa(图7)。因此,OmpP2蛋白表达的最佳诱导温度确定为37℃。
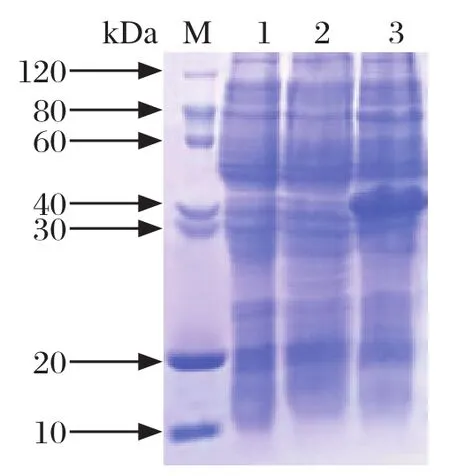
图7 OmpP2蛋白最佳诱导温度的确定Fig.7 Determination of optimal induction temperature for OmpP2 protein
2.9 OmpP2蛋白的包涵体表达及纯化超声后沉淀中OmpP2蛋白的表达量很高(图8),说明该蛋白是包涵体表达。用50 mmol/L和100 mmol/L浓度的咪唑洗脱效果比500 mmol/L浓度的咪唑洗脱效果好(图9)。
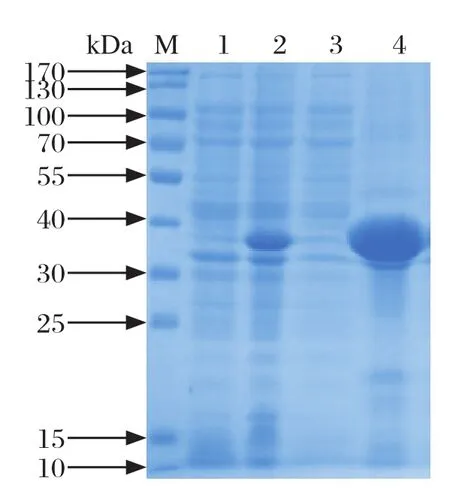
图8 OmpP2蛋白SDS-PAGE分析Fig.8 SDS-PAGE analysis of OmpP2 protein
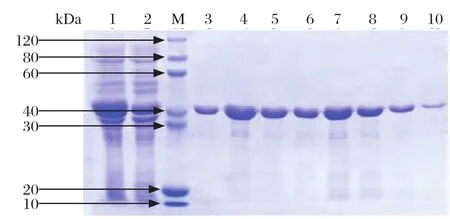
图9 OmpP2蛋白纯化SDS-PAGE分析Fig.9 SDS-PAGE analysis of puri fied OmpP2 protein
2.10 OmpP2蛋白的鉴定纯化后的OmpP2蛋白在40 kDa左右出现特异性条带,与预期大小一致(图10)。
2.11 OmpP2蛋白反应原性分析Western blot结果如图11所示,OmpP2蛋白能够与血清2型、4型、5型、13型、15型Hps 阳性兔血清发生反应,说明纯化的OmpP2蛋白与不同血清型的Hps 阳性血清均存在良好的反应原性。
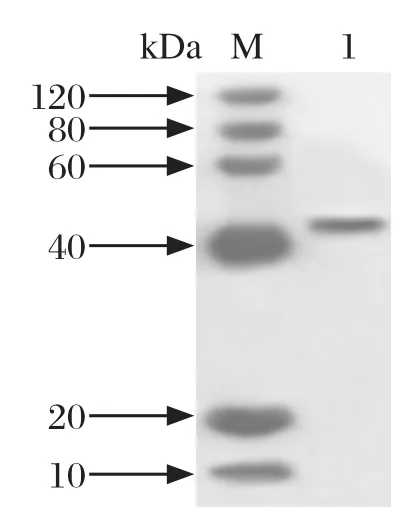
图10 ompP2基因表达产物的Western blot鉴定Fig.10 Western blot identi fication of ompP2 gene expression

图11 OmpP2蛋白与不同血清型Hps 阳性兔血清Western blot结果Fig.11 Western blot result of OmpP2 protein with different serotypes of Hps positive rabbit serum
3 讨论
副猪嗜血杆菌病是目前危害养猪业的主要细菌性疾病之一,引起该病的病原Hps是寄生于猪呼吸道的常在菌,一旦条件发生改变就会引起该病的发生[19]。禤雄标等[20]2009~2010年对广西86份疑似病料进行检测,Hps分离率达30.2%。周玉龙等[21]对2010年黑龙江省送检的43份病例进行检测,阳性率达18.60%。张岩等[22]2012年对新疆石河子垦区疑似病料105份进行检测,检出率达27.62%。于江等[5]2018~2012年对山东省、河南省、河北省、湖南省、江苏省、上海市等多个猪场送检的186份疑似样品进行检测,分离鉴定到57株Hps,分离率达30.6%,以血清4型和5型最为流行,其次是血清1、12、13型。近几年,随着猪繁殖与呼吸综合征、猪圆环病毒病等免疫抑制疾病的发生,Hps继发感染的病例越来越多,给养猪业带来极大的经济损失。本研究对2015~2016年从山东省不同地区采集的Hps疑似感染样品进行检测,并对ompP2基因进行核苷酸同源性比对和进化树分析。
Hps分为15个血清型,至少有20%无法定型,且不同血清型细菌之间的交叉保护能力不确定。已有报道用全菌裂解抗原[23]或荚膜多糖抗原建立了ELISA检测方法[24],但其特异性不强[16]。因此,需要一种反应原性和交叉保护性好的抗原,作为血清学诊断方法建立和亚单位疫苗制备的基础。外膜蛋白是革兰阴性菌外膜的主要结构,占其全部组成的1/2[25],在维持外膜结构和保证物质运输等方面均有重要作用。同时细菌的外膜蛋白也可以产生不同血清型间交叉保护性[26]。研究人员通过攻毒后保护试验证实Omp具有一定的保护作用[27]。现在已经鉴定出15个新的有免疫原性的外膜蛋白,其中有4种(PalA、OmpP2、D15和Hps 06257)被证明具有作为疫苗候选蛋白的潜力[28]。Hps中存在TbpA和TbpB两种转铁蛋白。李建军等[29]建立了TbpA基因的原核表达系统,证明TbpA蛋白具有良好免疫原性。朱小宁等[30]构建了D15基因的原核表达载体,证实表达产物能被Hps阳性血清识别,具有反应原性。
本研究对Hps血清5型分离株LZ株的ompP2基因进行剪接和修饰,确定最佳诱导温度,获得了高效表达的OmpP2蛋白,通过Western blot方法确定该蛋白与不同血清型Hps阳性血清之间均存在特异性反应,因此推测可以用ompP2基因的表达产物建立ELISA诊断方法,以检测Hps 的血清抗体水平,也为今后研究Hps OmpP2的生物学特性及对Hps的血清学诊断、亚单位疫苗的开发奠定了基础。
