猪红斑丹毒丝菌云南YNKMYZS-2016株的分离鉴定
2018-11-23郑碧妞王建聂陈建华字品文王生奎
郑碧妞,陶 松,岩 锐,王建聂,陈建华,字品文,姚 俊,王生奎
(1. 云南省怒江傈僳族自治州泸水市农业和科学技术局,泸水673199;2. 云南农业大学动物科学技术学院,昆明650201;3. 云南省普洱市孟连傣族拉祜族佤族自治县农业和科学技术局,孟连665800;4. 云南省文山市柳井彝族乡农业综合服务中心,文山663012;5. 云南省丽江市宁蒗彝族自治县农业和科学技术局,宁蒗673500;6. 云南省大理白族自治州云龙县果桥镇农业综合服务中心,云龙672708;7. 云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,昆明 650224)
红斑丹毒丝菌(Erysipelothrix rhusiopathiae)俗称猪丹毒杆菌,属于丹毒杆菌属,形直或微弯,是一种纤细的小杆菌,在感染动物的组织触片或血片中呈单在、成对或小丛状。在普通培养基上生长差,加入少量血液或血清,或在肉肝胃酶消化培养基中生长良好。在固定培养基上培养,可形成光滑(S)型、粗糙(R)型和中间(I)型菌落。红斑丹毒丝菌不运动,不产生芽孢,无夹膜,革兰氏染色阳性[1]。红斑丹毒丝菌可感染包括哺乳动物、禽和鱼类等70多种动物,其中猪最敏感。红斑丹毒丝菌主要感染3~12月龄猪,一年四季均可发病,发病率一般为10%~15%,严重时死亡率可达50%[2]。该菌引起的猪丹毒是一种急性、热性、人畜共患传染病,其特征主要表现为急性败血症、亚急性疹块型和慢性疣状心内膜炎及多发性非化脓性关节炎[3]。猪丹毒广泛流行于世界各地,也是我国主要的猪传染病之一,对养猪业造成了严重的经济损失[4]。
红斑丹毒丝菌血清型众多,迄今已确认的血清型有26个(1a、1b、2~24及N型),约80%以上的猪源分离菌株属于1型(包括1a和1b)和2型[5]。不同血清型菌株的致病力不同,1型毒力最强,主要引起急性败血型猪丹毒;2型毒力较弱,主要与疹块型或关节炎型猪丹毒有关[5]。红斑丹毒丝菌spaA 基因编码的产物为表面保护性抗原(surface protect antigen,Spa)。根据基因水平和蛋白水平的差异,可将Spa分为SpaA、SpaB、SpaC 三类。研究发现,SpaA 仅存在于毒力较强的血清型1a、1b、2、5、8、9、12、15、16、17 和N 型的菌株中,不仅具有良好的免疫原性及免疫保护功能,而且是红斑丹毒丝菌的重要致病因子[6]。通过对spaA 基因遗传进化的研究,可从基因水平上分析红斑丹毒丝菌分离株之间的差异[7]。
2016年10月,云南省昆明市某规模化种猪场饲养的怀孕母猪突然发病,精神沉郁,食欲不振,体温升高至41℃~41.5℃。病程较长的猪全身颈部、背部、腹部皮肤有大面积红色疹块,食欲下降并伴随呕吐,结膜充血,粪便干硬,并附有粘液。临死前腋下、股内、腹内有不规则鲜红色斑块,指压褪色后融合一起(图1A)。为了查明病因,对送检病死猪尸体进行解剖,可见肺脏肿大、出血(图1B),肠系膜淋巴结肿大、出血(图1C),肺部切开有气泡产生(图1D)。采集病死猪肺脏、脾脏、脑组织、淋巴结等内脏组织及流产胎儿组织,进行猪瘟病毒、猪繁殖与呼吸综合征病毒、猪细小病毒、伪狂犬病毒、日本乙型脑炎病毒、猪圆环病毒2型病毒、猪流产衣原体、多杀性巴氏杆菌及刚地弓形虫的PCR或real-time PCR检测。同时进行致病菌的分离培养和鉴定,最终分离鉴定出1株猪红斑丹毒丝菌。根据药敏测定结果选用敏感药物对猪群进行预防及治疗,效果显著,及时有效地控制了本病的扩散及蔓延。

图1 病死猪病理变化Fig.1 Pathological change of sick pigs
1 材料与方法
1.1 样品 昆明市某规模化养殖场送检死亡母猪肝脏、肺部、淋巴组织、胎盘及流产胎儿。
1.2 主要试剂营养琼脂培养基、麦康凯培养基、革兰氏染液购自杭州滨和微生物试剂有限公司;Gibic新生犊牛血清、病毒基因组RNA提取试剂盒(MagMAX-96 viral RNA isolation kit)、RNA病毒反转录试剂盒购自美国Thermo Fisher SCIENTIFIC公司;病毒基因组RNA提取试剂盒购自美国Ambion生物技术有限公司;病毒DNA提取试剂盒购自美国OMEGA生物技术有限公司;2×Plus Taq酶、DNA Marker DL2000均购自天根生物技术(北京)有限公司;一步法RT-PCR试剂盒购自大连宝生物(TaKaRa)生物技术有限公司;半自动细菌生化鉴定及药敏检测系统ATB及梅里埃链球菌生化快速鉴定试条、兽医细菌药敏鉴定试条均购自法国梅里埃公司。
1.3 实验动物昆明成年小白鼠8只购自昆明医科大学实验动物中心。
1.4 引物、探针猪瘟病毒、伪狂犬病毒、乙型脑炎病毒、猪细小病毒及猪圆环病毒2型检测引物及探针由云南省热带亚热带动物病毒病重点实验室设计。检测猪繁殖与呼吸综合征病毒欧洲型毒株及美洲型高致病性毒株、经典毒株及通用型引物和探针,以及猪流产(鹦鹉热)衣原体,猪红斑丹毒丝菌,多杀性巴氏杆菌,刚地弓形虫的检测引物及探针参考文献[8-16]。以上引物及探针均分别由上海Invitrogen生物科技有限公司、上海GENEray生物科技有限公司及昆明硕擎生物科技有限公司合成。详细信息见表1。
1.5 病死猪组织匀浆病毒核酸及细菌基因组DNA的抽提
1.5.1 病毒基因组(RNA/DNA)的抽提 取病死怀孕母猪及流产胎儿大脑、肺脏、脾脏、肺门淋巴结、肝脏、肾脏及胎盘组织匀浆,反复冻融3次后,4500×g离心10 min,取上清液按试剂盒说明书操作,提取组织病料病毒DNA或 RNA样品,所抽提病毒核酸样品均-80℃保存备用。
1.5.2 细菌基因组DNA的抽提 取组织病料上清或分离培养细菌菌落,按照细菌基因组DNA抽提试剂盒说明书提取DNA,-80℃保存备用。
1.6 猪繁殖与呼吸综合征病毒、猪瘟病毒、伪狂犬病毒、猪圆环病毒2型、猪细小病毒、日本乙型脑炎病毒、巴氏杆菌、刚地弓形虫的PCR检测分别采用云南省热带亚热带动物病毒病重点实验室建立的猪瘟病毒real-time PCR和猪细小病毒、乙型脑炎、伪狂犬及圆环病毒2型PCR检测方法进行,参考文献中的猪繁殖与呼吸综合征病毒欧洲型及美洲型高致病性毒株、经典毒株[8-9],猪流产衣原体[10],布氏杆菌[11]及刚地弓形虫[12-13]PCR及real-time PCR检测方法对送检样品进行检测。
1.7 致病菌的分离培养及鉴定
1.7.1 致病菌的分离培养 无菌采集病死怀孕母猪肺脏组织样品,划线接种于新生牛血清琼脂平板上,置CO2培养箱37℃培养24 h后,挑取单个菌落,重新划线接种于新生牛血清琼脂平板上,同样于CO2培养箱37℃倒置培养24 h,若有菌落生长,则挑取菌落进行革兰氏染色后镜检。
1.7.2 分离菌株昆明小白鼠致病性试验 取适量纯化的分离菌株菌落,用无菌生理盐水悬浮混合均匀后,测定细菌浓度,并稀释至浓度为1.5×108个/mL,每只昆明小白鼠腹腔接种0.2 mL,共接种6只。同时给2只昆明小白鼠腹腔注射同等剂量的无菌生理盐水,作为对照组。接种后观察并记录小白鼠的发病及死亡情况,解剖观察病理变化,并进行菌株的分离。1.7.3 分离菌株的细菌生化及药敏鉴定 选用法国梅里埃链球菌生化快速鉴定试条对分离菌株进行细菌生化鉴定,具体操作按照说明书进行,接种后置于湿盒内,37℃培养4 h±30 min后,读取结果。选用法国梅里埃兽医细菌药敏鉴定试条对分离菌株进行细菌药敏鉴定,具体操作按照说明书进行,接种后置于湿盒内37℃培养18~24 h后,读取结果。
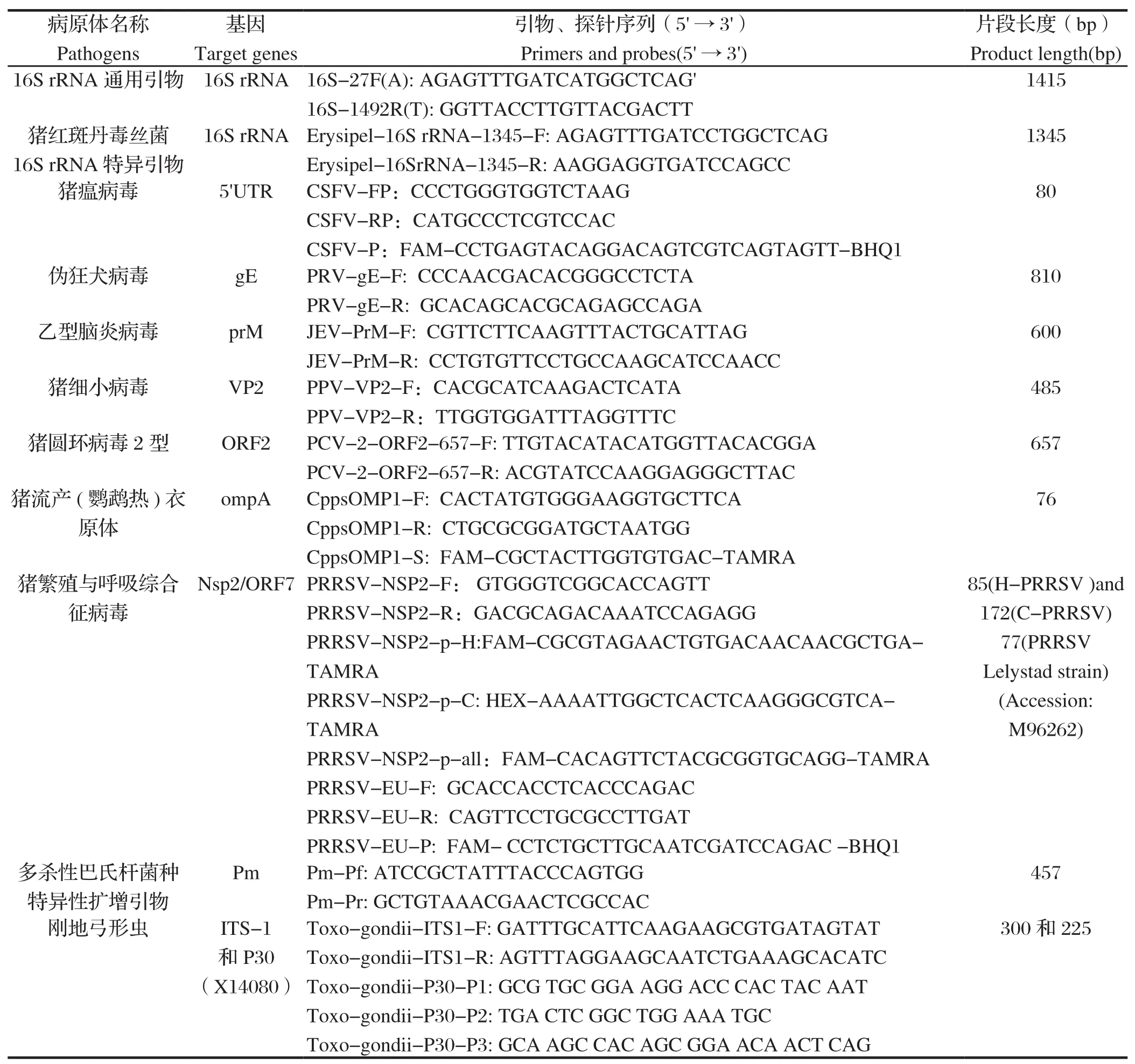
表1 引物、探针信息表Table 1 Primers and probes used in this paper
1.8 分离菌株细菌基因组16SrRNA的扩增及序列分析参考文献合成细菌基因组16S rRNA基因特异引物Erysipel-16SrRNA-1345-F、R,扩增所提取的细菌基因组DNA。PCR反应体系25 μL:2×Taq PCR Master mix 12.5 μL、上下游引物 E-16SrRNA-1345-F和E-16SrRNA-1345-R各1 μL、模板DNA 4 μL、灭菌ddH2O 6.5μL,混匀,短暂离心后上机。反应条件:95℃预变性5min;95℃ 1min,60℃ 50 s,72℃ 2 min运行35个循环;72℃再延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳检测。
参考文献合成细菌16S rRNA基因通用引物16S-27F、16S-1492R,扩增所提取的细菌基因组DNA。PCR反应体系(25 μL):2×Taq PCR Master mix 12.5 μL、上下游引物16S-27F(A)和16S-1492R(T)各1 μL、模板DNA3 μL、灭菌ddH2O 7.5 μL,混匀,短暂离心后上机。反应条件:96℃预变性3min;95℃变性30 s,57℃退火30 s,72℃延伸1 min 30 s运行35个循环;72℃再延伸5 min。PCR产物经1.5%琼脂糖凝胶电泳检测,切胶回收纯化,送北京擎科新业生物技术有限公司测序后进行序列分析。
2 结果与讨论
2.1 检测猪繁殖与呼吸综合征病毒毒株、猪瘟病毒、伪狂犬病毒、多杀性巴氏杆菌、猪圆环病毒2型、猪细小病毒、日本乙型脑炎病毒及刚地弓形虫的PCR检测样品经猪繁殖与呼吸障碍综合征病毒欧洲型及美洲型、高致病性及经典毒株、猪瘟病毒、伪狂犬病毒、巴氏杆菌、日本乙型脑炎病毒、刚地弓形虫PCR检测,其结果全为阴性(图略)。
2.2 细菌的培养及染色分离菌株在胎牛血清平板上生长缓慢,菌落细小、光滑、湿润、边缘整齐。染色后镜检显示菌体为革兰氏染色阳性,呈球状、短杆状,单个或双菌存在(图1)。

图1 革兰氏染色镜检结果Fig.1 Gram stain results of the isolates
2.3 分离菌株细菌基因组RNA的特异扩增、非特异扩增及序列分析结果结果显示,Erysipel-16S rRNA-1345-F/R引物扩增出特异型条带,条带大小为1345 bp(图2A)。16S-27F(A)/16S-1492R(T)引物扩增出特异性条带,条带大小为1415 bp(图2B),测序结果显示分离株与猪红斑丹毒丝菌参考菌株同一性达97%,表明该菌株为猪红斑丹毒丝菌,命名为云南YNKMYZS-2016株。

图2 分离菌株的PCR检测结果Fig.2 PCR results of the isolate
2.4 分离菌株16S rRNA序列分析结果分离菌株与猪红斑丹毒丝菌参考菌株Fujisawa株、GXBY-1株、SY1027株及WH13013株同源性高达100%,与KGBB1株、KG-BB2株同源性达96.3%(图3)。基于分离菌株16S rRNA基因序列构建的进化树显示,分离菌株与GenBank中的猪红斑丹毒丝菌参考菌株Fujisawa株、GXBY-1株、SY1027株及WH13013株同属于一个进化分支,而KG-BB1株、KG-BB2株同属于另一进化分支(图4)。

图3 猪红斑丹毒丝菌16S rRNA基因序列比对结果Fig.3 The alignment results based on 16S rRNA gene sequence of Erysipelothrix rhusiopathiae

图4 猪红斑丹毒丝菌16S rRNA序列的系统进化树Fig.4 The phylogenetic tree construction based on 16S rRNA gene sequences of Erysipelothrix rhusiopathiae
2.5 生化鉴定与药敏试验结果生化鉴定结果见表2。选择28种较常见的抗生素药敏纸片对该株菌进行药敏试验,结果显示,YNKMYZS-2016株对青霉素、红霉素、阿莫西林、阿莫西林/克拉维酸、原始霉素、苯唑西林、泰洛星、头孢噻吩、头孢哌酮、呋喃妥因敏感,对林可霉素、多粘菌素 E、复方新诺明、链霉素、磺胺甲恶唑、大观霉素、氟甲喹、卡那霉素、奥索利酸、庆大霉素、依氟沙星、安普霉素、氯霉素、夫西地酸、四环素、利福平、多西环素、甲硝唑耐药,详见表3。
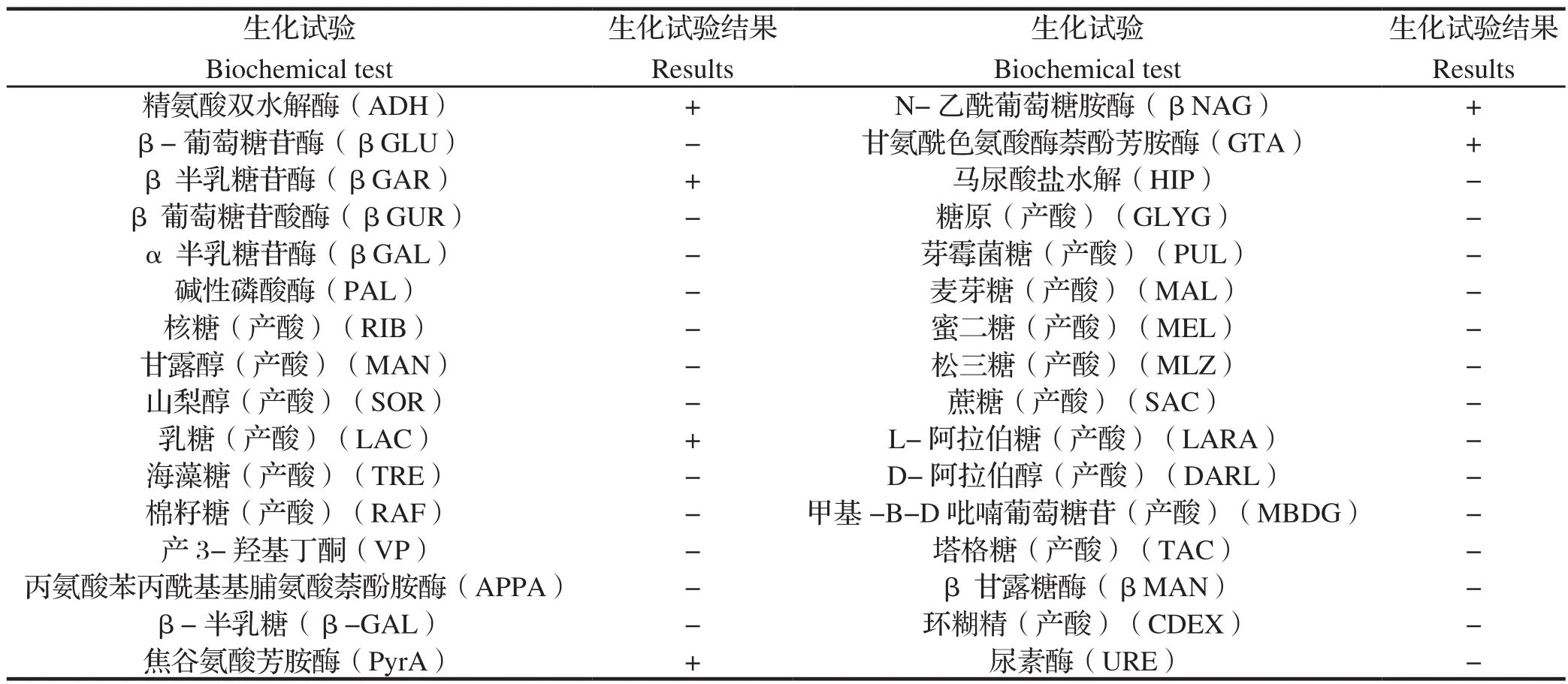
表2 猪红斑丹毒丝菌分离菌株生化反应结果Table 2 The results of biochemical identi fication for Erysipelothrix rhusiopathiae YNKMYZS-2016
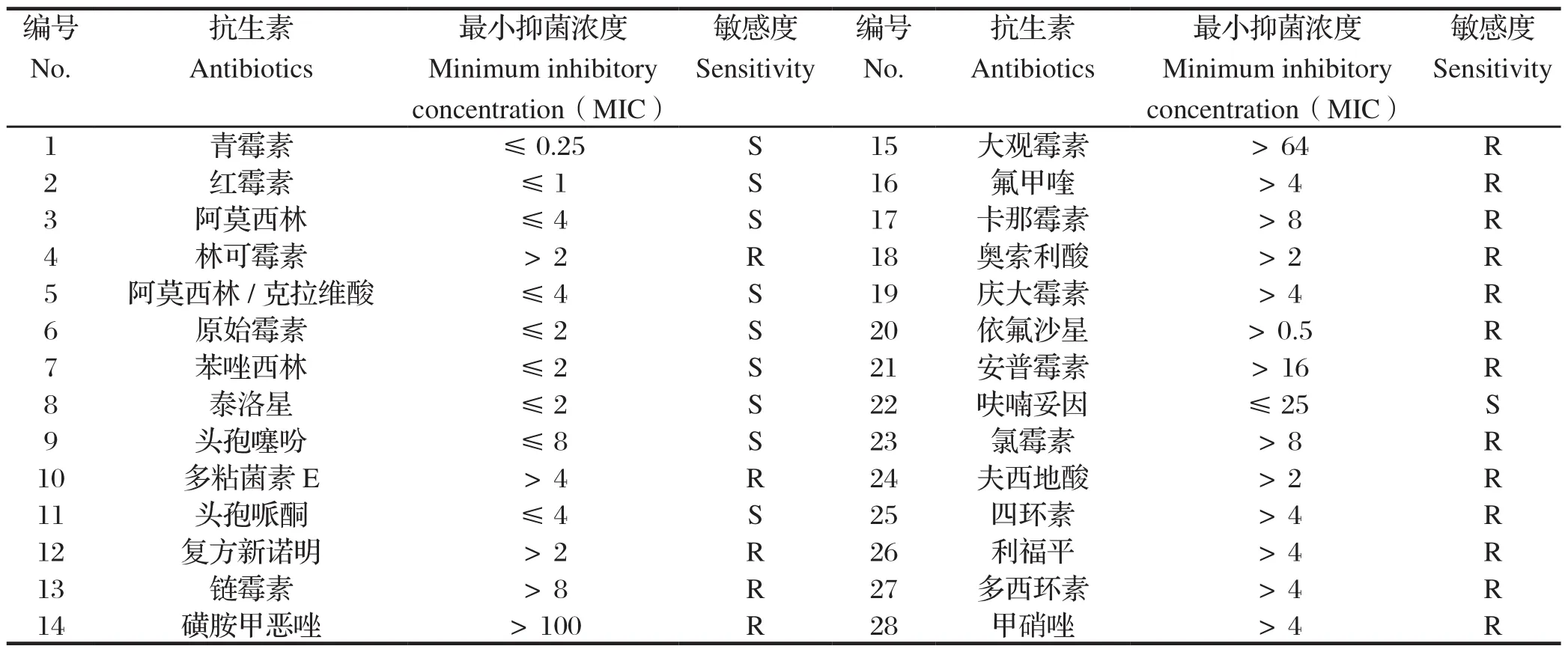
表3 猪红斑丹毒丝菌分离菌株对28种抗生素的药敏试验结果Table 3 The results of antibiotic sensitivity test for Erysipelothrix rhusiopathiae YNKMYS-2016
2.6 动物实验结果6只实验组昆明小白鼠接种分离株YNKMYZS-2016株2 h后精神萎顿,饮食欲废绝,打堆,接种后24~53 h内死亡。剖检死亡小白鼠后可见肺脏、肝脏、肾脏及脾脏出血,并从肝脏及脾脏穿刺样品分离到同一细菌,而正常对照组昆明小白鼠内脏器官无异常病理变化,肝脏及脾脏穿刺样品未分离到病原细菌。
2.7 讨论目前,国内有许多传染性疫病可引起猪急性死亡,例如,高致病性繁殖与呼吸道综合征、急性猪瘟、猪丹毒、猪肺疫、猪梭菌病、沙门氏菌、李氏杆菌和猪链球菌病等,以单独感染或混合感染的形式出现,给养猪业造成了巨大经济损失[14]。在20世纪80年代和90年代初,猪丹毒与猪瘟、猪肺疫并称为中国养猪业的三大传染病,给我国养猪业造成严重的经济损失。随着规模养猪场的发展,猪丹毒似乎逐渐谈出了人们的视线,急性典型的临床病例发生比例越来越低,很多猪场已经停止使用猪丹毒疫苗。但近几年,在江西、浙江、湖南、四川、云南、广州、福建等省均有猪丹毒散发的报道[15],造成不同生长阶段猪群发病死亡,而且随着时间的推移,猪丹毒有从南向北发展的趋势,并日益严重。由于猪丹毒杆菌具有广泛的宿主,病猪和带菌猪是最主要的传染源,细菌可通过分泌物和排泄物污染及传播,且对外界环境的抵抗力很强,一旦侵入环境中,便会通过各种途径传播至其他地区。养殖户多年放弃免疫猪丹毒疫苗,使得其发病率逐渐呈上升趋势,且猪红斑丹毒丝菌常与猪瘟病毒、猪繁殖与呼吸道综合征、猪圆环病毒、伪狂犬病毒、猪细小病毒、猪传染性胸膜肺炎放线杆菌及副猪嗜血杆菌等病原共同感染或继发感染,加重本病的发生与流行。
本研究同时使用法国梅里埃API Coryne鉴定试条(24~48 h鉴定棒状杆菌和相关菌种)和API rapid ID 32 Strep鉴定试条(快速链球菌和相关菌种鉴定)对分离菌株进行鉴定,结果显示,分离菌株为猪红斑丹毒丝菌。两种试纸条鉴定的置信度非常高,ID%值均达到99%以上。细菌生化鉴定历来是细菌鉴定的金标准,本研究对分离菌株的生化鉴定获得了非常高的置信度,表明当前流行的猪红斑丹毒丝菌在生化特性上具有较高的保守性。细菌16S rRNA序列比对结果与生化鉴定结果也高度一致,均显示分离菌为猪红斑丹毒丝菌。由于细菌16S rRNA 基因的PCR检测方法操作简单,结合快速、高效的商业化测序技术服务,已成功地应用于多种细菌的鉴定,并逐渐成为细菌快速鉴定的重要方法。
青霉素一直是抗猪丹毒的首选药物,本研究药敏试验结果表明,该株猪红斑丹毒丝菌(YNKMYZS-2016)对青霉素及头孢类抗生素依然敏感,除了青霉素及头孢类抗生素可供选择外,还可参考选择呋喃妥因或红霉素(大环内酯类)进行预防和治疗。
本次猪丹毒主要发生于生产母猪及育肥猪,暴发初期临床表现为发病急、死亡快,死后皮肤无出血、发绀及猪丹毒典型的“打火印”特征,直至部分病程较长的发病猪皮肤才出现指压褪色的“打火印”,因此在发病初期临床上很难确诊。此外,猪丹毒与猪繁殖与呼吸道综合征、猪瘟、伪狂犬、猪弓形虫病及猪肺疫等的临床症状和病理变化相似,极易发生误诊,不能及时确诊会给猪场造成较大的经济损失。目前,通过疫苗预防接种可以降低猪丹毒的发生率及死亡率,但传统的灭活疫苗、弱毒疫苗存在较多缺陷,对猪丹毒的免疫保护效果不理想。当前流行的猪红斑丹毒丝菌存在一定程度的抗原性变异,如果疫苗产品仍使用几十年前的菌种,疫苗制品的抗原与流行菌株抗原匹配度不理想的话,将会出现疫苗产品保护效率较低的结果。因此,分离获得当前猪红斑丹毒丝菌流行菌株,进行新型疫苗产品的研发,对于更有效地预防和控制猪丹毒是十分必要的。
