酶法制备鱼降血压肽的工艺优化及其组分分析
2018-10-24赵永慧盖乐乐刘晓攀张中堂王祥鹏盘赛昆
徐 倩,戴 遥,赵永慧,盖乐乐,刘晓攀,张中堂,王 熙,王祥鹏,盘赛昆,3,4,*
(1.淮海工学院 海洋生命与水产学院,江苏连云港 222005; 2. 江苏天边渔村食品有限公司,江苏连云港 222100; 3.江苏省海洋生物产业技术协同创新中心淮海工学院,江苏连云港 222005; 4.江苏省海洋资源开发研究院,江苏连云港 222005)
高血压是最常见的心血管疾病,是全球范围内的重大公共卫生问题[1]。调查结果显示,我国18岁及以上居民高血压患病率为18.8%,估计全国患病人数超过1.6亿,高血压已成为严重威胁我国居民健康的主要疾病[2]。因此,开发降血压药物具有重要的现实意义。目前,治疗高血压最常见的方法是服用化学合成的降压药物,但长期服用会引发一系列的副作用:如气管痉挛、心悸、味觉功能紊乱、皮肤过敏等[3],因而非化学合成药物的辅助降压更受到患者的青睐,其中利用天然蛋白质制备的降血压肽由于安全性高、无毒副作用已成为降血压研究领域的热点[4]。
降血压肽是目前研究最深入、最系统且潜在应用价值最高的一种生物功能性肽[5],可通过抑制血管紧张素转化酶(Angiotensin Converting Enzyme,ACE)活性,促进血管平滑肌进行舒张,血压下降,使人体血压处于稳定状态[6]。降血压肽来源广泛,可分为陆源蛋白肽和海洋生物蛋白肽两种。目前,陆源蛋白肽中已经发现很多有潜力的降血压肽,如蛋清蛋白降压肽[7]、花生蛋白降压肽[[8]、羊骨降压肽[9]等。由于海洋生物种类和数量都远大于陆源生物,所以国内外的研究者对水产品蛋白降血压肽进行了大量的研究,发现水产来源的降血压肽的效果优于其他食品蛋白源的降血压肽[10]。
鲬鱼(Platycephalusindicus),俗称狗腿鱼,属于暖水性底层鱼类,分布于太平洋西部和印度洋,我国黄海与渤海产量较大,是我国重要的经济鱼类之一[11]。鲬鱼具有产量高、价格低、蛋白质含量丰富的特点,是一类具有很大开发潜力的鱼类资源[12]。近年来,由于市场对鲬鱼的需求量不断增加,鲬鱼养殖业也逐渐形成沿海地区的新兴支柱产业之一。目前鲬鱼多为原料型初级产品,且国内外学者对鲬鱼的研究大多集中在生物学方面,对其生理活性物质中的真正有效成分的研究较少[13]。本研究以新鲜鲬鱼为原料,通过蛋白质酶解技术[14]制备生物活性肽[15],为鲬鱼的深加工和综合利用奠定基础。
1 材料与方法
1.1 材料与仪器
新鲜鲬鱼 体长约380 mm±50 mm,体宽约80 mm±10 mm,蛋白质的含量为18.53%,购于连云港市水产品直销市场;酪氨酸 分析纯,天津市科密欧化学试剂有限公司;干酪素 化学纯,国药集团化学试剂有限公司;Alcalase(89767 U/g)、木瓜蛋白酶(617400 U/g)、酸性蛋白酶(91570 U/g) 诺维信生物技术有限公司;马尿酰组氨酰亮氨酸(HHL)、血管紧张素转换酶(色谱级)Sigma公司;其余试剂均为分析纯。
DK20消化系统、UDK132半自动蒸馏系统 意大利VELP公司;UV754N-紫外可见分光光度计 上海市精科有限公司;CR22G高速冷冻离心机 日本HITACHI公司;JMS-50胶体磨 廊坊市正瑞机械有限公司;DS-1高速组织捣碎机 金坛市荣华仪器制造有限公司;Biologic DuoFlowRR蛋白质层析系统 美国伯乐公司。
1.2 实验方法
1.2.1 原料预处理 新鲜鲬鱼→去头、去鳍、去内脏→清水冲洗干净→切段→绞碎(5000 r/min,8 min)→分装(50 g/袋)→-18 ℃冷冻保存备用
1.2.2 鲬鱼活性肽的制备 原料→解冻→调节固液比→匀浆→调节pH→酶解→灭酶(沸水浴,15 min)→冷却→离心(3000 r/min,10 min)→取上清液→鲬鱼降压肽
1.2.3 酶的选择 选择具有代表性的三种酶按表1在最适反应条件下酶解鲬鱼,加酶量均为2000 U/g·pro,根据水解进程确定适宜的酶。供试酶的活力分别为Alcalase 89767 U/g·pro,酸性蛋白酶91570 U/g·pro,木瓜蛋白酶617400 U/g·pro。
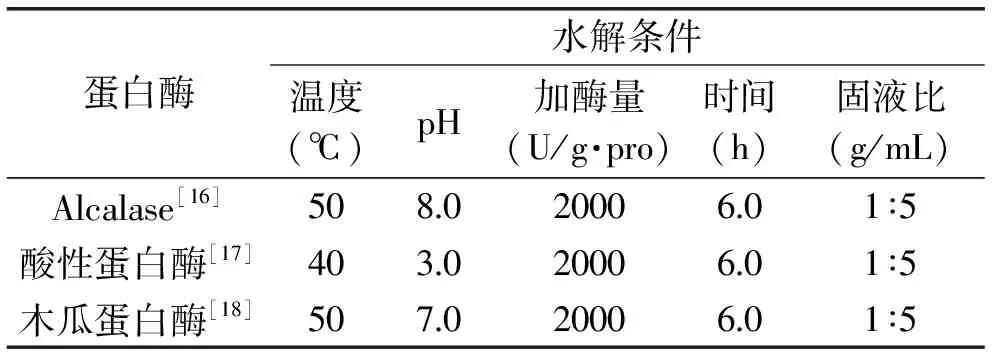
表1 供试蛋白酶作用条件Table 1 Hydrolysis conditions of tested proteinase
1.2.4 水解度的测定 总氮采用凯氏定氮法参照文献[19]的方法测定,氨基酸态氮采用甲醛滴定法参照文献[20]的方法测定,计算水解度公式:

式中:V1为用百里酚酞作指示剂滴定时消耗氢氧化钠标准溶液的体积(mL);V2为用中性红作指示剂滴定时消耗氢氧化钠标准溶液的体积(mL);c为氢氧化钠标准溶液浓度(mol/L);n为匀浆的固液比(g/mL);s为鱼肉总氮(mg);0.014为1/2N2的毫摩尔质量(g/mmol)。
1.2.5 肽含量测定 基于双缩脲反应机理,参照文献[21]的方法以谷胱甘肽为标准,测定鲬鱼酶解液的肽含量。按表2加样,在漩涡仪上混合均匀,静置10 min,在540 nm处测定吸光值。以肽质量浓度(mg/mL)为横坐标,吸光值为纵坐标,绘制标准曲线;鲬鱼水解液离心(3 ℃,10000 r/min,10 min),取上清液,加三氯乙酸(TCA),再进行低速离心(10 min,3000 r/min),取上清液,与双缩脲以3∶2比例混合,静置10 min,在540 nm处测定吸光值,根据标准曲线(y=0.1089x+0.0046)计算肽含量。
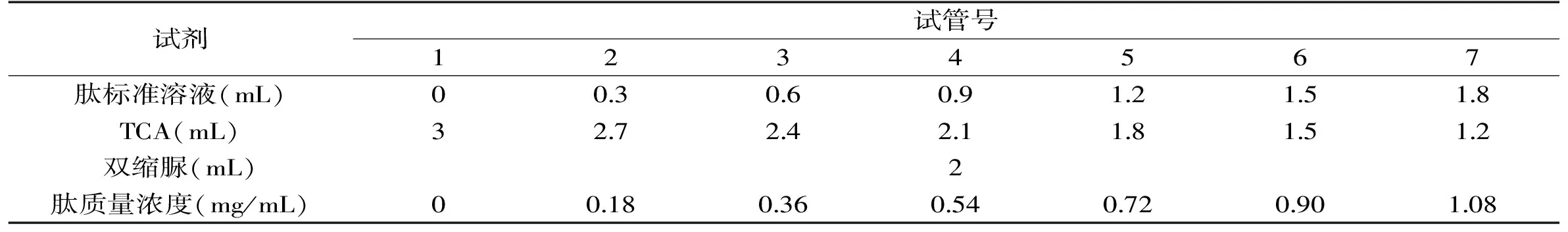
表2 谷胱甘肽标准曲线加样表Table 2 Schedule of Glutathione standard curve
1.2.6 ACE抑制率的测定 体外ACE抑制活性的测定参照文献[22]采用改进的分光光度法测定,按表3配制反应液。对照管吸光值记为A,样品管吸光值记为S,空白管吸光值记为C,ACE抑制率计算公式:
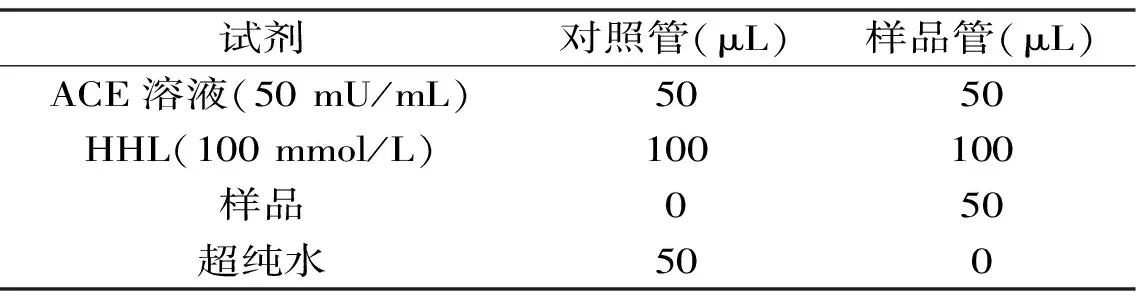
表3 反应液加样表Table 3 Schedule of the reaction liquid
1.2.7 酶解单因素实验 影响酶解作用的因素一般为酶解时间、pH、温度、加酶量、固液比等五个单因素。以ACE抑制率和水解度为指标,考察各因素对水解度及产物ACE抑制率的影响。
1.2.7.1 反应温度对蛋白水解度及产物ACE抑制率的影响 固液比1∶5 g/mL,pH=8,加酶量为35000 U/g·pro,酶解时间2.5 h,温度分别为40、50、60、70 ℃。
1.2.7.2 pH对蛋白水解度及产物ACE抑制率的影响 固液比1∶5 g/mL,加酶量为35000 U/g·pro,温度50 ℃,酶解时间2.5 h,pH分别为6.0、7.0、8.0、9.0。
1.2.7.3 固液比对蛋白水解度及产物ACE抑制率的影响 pH=8,加酶量为35000 U/g·pro,温度50 ℃,酶解时间2.5 h,固液比分别为1∶5、1∶10、1∶15、1∶20 g/mL的悬浮液。
1.2.7.4 加酶量对蛋白水解度及产物ACE抑制率的影响 固液比1∶5 g/mL,pH=8,温度50 ℃,酶解时间2.5 h,加酶量分别为25000、30000、35000、40000 U/g·pro。
1.2.7.5 酶解时间对蛋白水解度及产物ACE抑制率的影响 固液比1∶5 g/mL,pH=8,加酶量为35000 U/g·pro,温度50 ℃,时间设置为1.5、2.0、2.5、3.0 h。
1.2.8 响应面优化酶解条件 根据单因素实验结果,选择三个关键因素,按旋转中心组合试验设计原理设计试验,因素水平见表4。

表4 响应面实验因素水平表Table 4 Factors and levels of response surface analysis methodology
1.2.9 验证实验 通过响应面优化得出最佳酶解条件,在最佳条件下制得酶解液,并测定其ACE抑制率,做三次平行实验,并进行T检验,判断是否具与预测值有显著性差异。
1.2.11 分子量分布测定 利用凝胶层析法[24-25]测定酶解物的分子量分布,通过Sephadex G-15柱(φ1.1 cm×50 cm)进行分析检测。以纯水为洗脱液,流速为0.4 mL/min,上样量为3.5 mL,QuadTecTM检测器检测,检测波长为280 nm。标准样分别为L-酪氨酸(Mr=181.19),AMP(Mr=347.2),辅酶I(NAD,Mr=681.44),短杆菌肽(Bacitracin zinc,Mr=1486.2),用缓冲液配成5 g/L的溶液备用,用蓝葡聚糖2000测定柱外水体积Vo,然后由标准样的保留时间乘以洗脱液流速计算出相应的洗脱体积Ve,并按下式计算Kav(有效分配系数),其中Vt为柱床总体积:
然后以相对分子质量的对数值(logMr)为横坐标,Kav为纵坐标绘制标准曲线。样品的相对分子质量根据其洗脱体积由标准曲线求得。
1.3 数据处理

2 结果与分析
2.1 水解酶的筛选
采用Alcalase、木瓜蛋白酶、酸性蛋白酶水解鲬鱼蛋白,进程如图1~图2。

图1 不同蛋白酶对蛋白水解度的影响Fig.1 Effect of different proteases on degree of hydrolysis
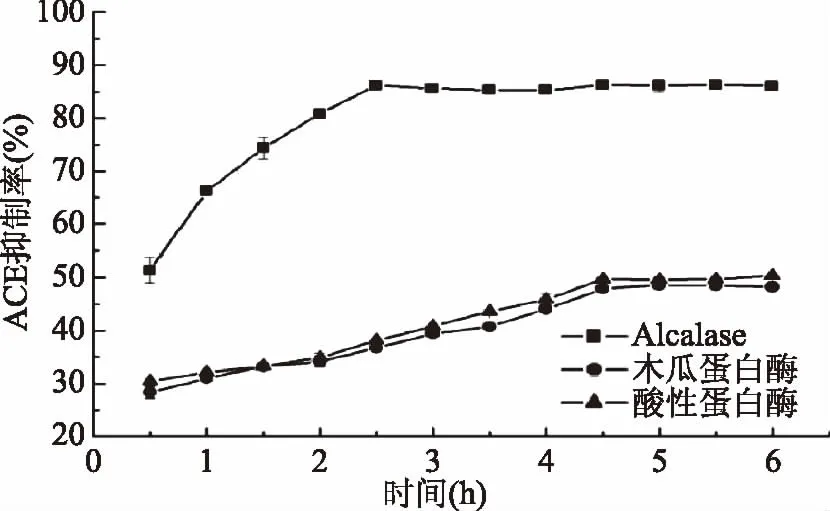
图2 不同蛋白酶水解产物的ACE抑制率Fig.2 ACE inhibitory ratio of different enzymatic hydrolysate
图1显示,供试蛋白酶作用于鲬鱼蛋白后,在试验时间范围内,蛋白的水解度都随着酶解时间的增加而增加。其中,酸性蛋白酶作用下水解度高于Alcalase和木瓜蛋白酶,其大约5 h可完成整个水解过程,最终水解度为34.45%。仅从水解度来看,3种酶中酸性蛋白酶最适合水解鲬鱼蛋白。但图2显示,酸性蛋白酶水解物的ACE抑制率虽然比木瓜蛋白酶水解物强,但比Alcalase水解物的ACE抑制率弱。木瓜蛋白酶和酸性蛋白酶的水解产物ACE抑制率随水解进程的变化极为相似,在4.5 h时达到稳定,但最终获得的ACE抑制率较低。这可能是由于不同的酶具有各自的底物专一性,其酶切位点所作用的氨基酸种类不同,释放的肽段长短不一,序列各异,对ACE的竞争性抑制强弱也不同。
综上,以酶解产物的ACE抑制率为主要参考指标,以水解度为辅助参考指标,发现Alcalase水解后的鲬鱼酶解液的ACE的抑制活性最高,2.5 h后ACE抑制率即达到86.12%,显著高于木瓜蛋白酶与酸性蛋白酶(p<0.05),所以选择Alcalase酶作为最适宜水解酶。
2.2 单因素实验
2.2.1 温度对抑制率及水解度的影响 Alcalase分子稳定性与酶解温度的高低密切相关。反应温度过高,酶分子的空间结构发生改变,次级键解离,致使酶的活性降低甚至丧失催化活性。但反应温度过低,体系内分子运动速度缓慢,降低了酶与蛋白分子的碰撞几率[26]。由图3可知,温度对鲬鱼蛋白酶解产物的水解度和ACE抑制率的影响较大,而具有较好的相关性。在测定温度范围内,随着温度的升高,水解度和ACE抑制率呈先上升后下降趋势,在50 ℃时二者均达到最大值:水解度为23.94%,ACE抑制率为84.55%。当温度高于50 ℃时,可能因酶的活性受到抑制,所以水解度和ACE抑制率急剧下降,则表明Alcalase的活性受温度影响显著(p<0.05)。因此,Alcalase水解鲬鱼蛋白适宜的温度为50 ℃。
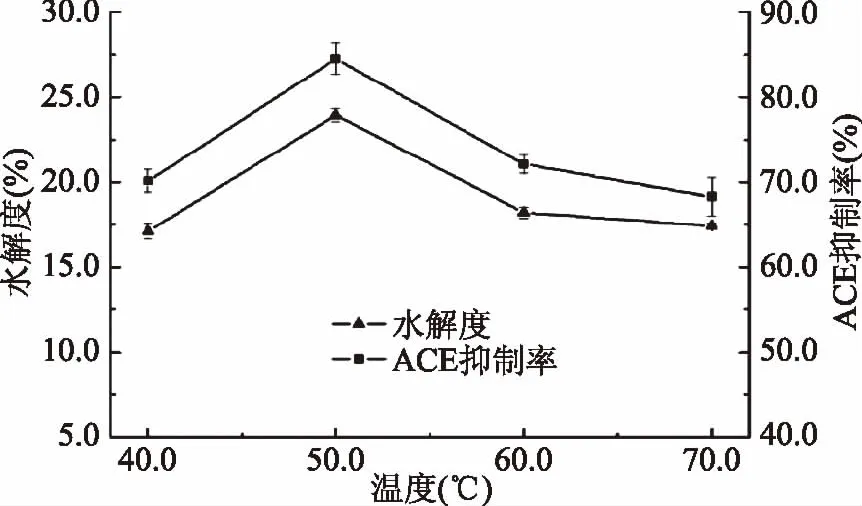
图3 温度对ACE抑制率影响折线图 Fig.3 Temperature effect on the ACE inhibitory activity chart
2.2.2 pH对抑制率及水解度的影响 酶促反应中,酶活力受pH影响较大。根据图4可以看出,pH在6.0~7.0范围内,水解度和ACE抑制率随pH迅速增加;继续增大pH(7.0~8.0),水解度和ACE抑制率增加缓慢,表明酶促反应速率降低。当pH升高至8.0时,水解度和ACE抑制率分别达最大值:水解度为24.33%,ACE抑制率为84.35%。随着pH进一步提高,水解度和ACE抑制率呈现明显下降趋势,主要原因为在过碱性环境中,酶的构象发生改变,降低了酶的活性,由此表明Alcalase适合于弱碱性的环境。因此,Alcalase酶解鲬鱼蛋白适宜的pH为8.0,此时获得的产物活性也最高。

图4 pH对ACE抑制率影响折线图Fig.4 pH effect on the ACE inhibitory activity chart
2.2.3 固液比对抑制率及水解度的影响 由图5可知,随着固液比的不断增大,即鲬鱼蛋白浓度的降低,水解度不断减小,表明试验在选定的蛋白浓度范围内,Alcalase酶解鲬鱼蛋白中的底物肽键始终处于不饱和,在水解过程中,鲬鱼蛋白浓度的降低,降低了水解的反应速度,从而导致水解度快速降低。然而,ACE抑制率随着固液比的上升而下降,但幅度不大几乎处于稳定状态,表明固液比在Alcalase水解过程中对酶解产物的ACE抑制率影响较小。在固液比为1∶5 g/mL时ACE抑制率最大为81.67%,故酶解鲬鱼蛋白最适固液比为1∶5 g/mL。

图5 固液比对ACE抑制率影响折线图Fig.5 Solid-liquid ratio effect on the ACE inhibitory activity chart
2.2.4 加酶量对抑制率及水解度的影响 由图6可知,Alcalase添加量在2000.0~3000.0 U/g·pro范围内,鲬鱼蛋白的水解度随添加量增大快速提高;酶添加量在3000.0~3500.0 U/g·pro 范围内,水解度增加缓慢;当添加量达到3500.0 U/g·pro时,水解度达到最大值18.54%。水解过程中,随着添加量的增大,大分子鲬鱼蛋白在较短时间内被降解成为小分子多肽,多肽得率迅速增加,体系反应的初速度迅速增大。当添加量较大时,底物已被酶所饱和,酶的浓度不再是水解反应的限速因素。而且,进一步添加酶的用量降低了产物肽所占蛋白的比重,导致测定时水解度明显降低。随着加酶量的增加,ACE抑制率呈先上升后下降的趋势,当加酶量为3500 U/g·pro时,ACE抑制率达最大值84.63%。因此,Alcalase水解鲬鱼蛋白适宜的加酶量为3500U/g·pro。
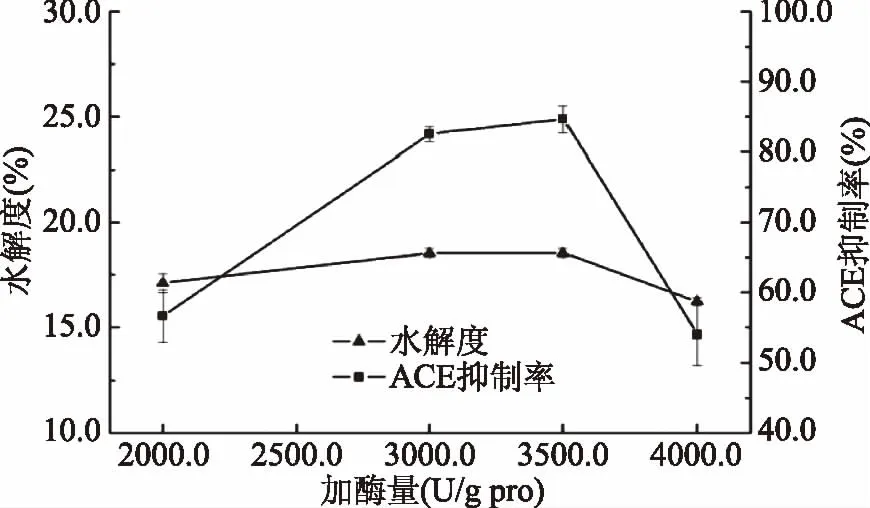
图6 加酶量对ACE抑制率影响折线图Fig.6 Enzyme amount effect on the ACE inhibitory activity chart
2.2.5 时间对抑制率及水解度的影响 由图7可见,酶解初期,酶解液的ACE 抑制率随水解度的增加而增大;酶解后期,酶解液的ACE 抑制率随水解度的增大而降低。Alcalase兼具内切和外切特性,它能快速地将蛋白质从分子内部或一端切割成小分子多肽。ACE一般易于与短肽结合,且酶解产物的C-端氨基酸是与ACE活性部位结合的关键。当小肽的C-端氨基酸为环状结构的芳香族氨基酸或脯氨酸时,对ACE具有较强的抑制作用[27]。当酶解时间达到2.5 h时,酶解生成的小肽C-端氨基酸含有的芳香族氨基酸或脯氨酸较多,随着酶解时间的延长,水解度加大,部分肽段进一步裂解,肽段的空间结构和C-端氨基酸被破坏,从而使ACE 抑制活性降低。由此可见,以水解度为指标,酶解3.0 h得到的酶解产物并非是对ACE活性有最大抑制率的酶解产物。而在酶解2.5 h时,酶解液的ACE 抑制率达到最大值77.83%,此时水解度为24.34%。因此,Alcalase水解鲬鱼蛋白适宜的酶解时间为2.5 h。
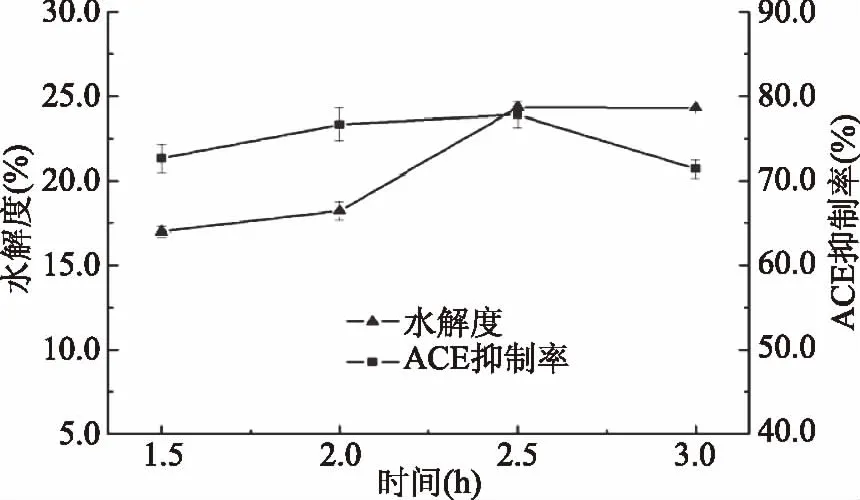
图7 时间对ACE抑制率影响折线图Fig.7 Time effect on the ACE inhibitory activity chart
2.3 响应面分析法优化酶解条件
2.3.1 模型建立 由单因素试验结果发现,在设定的因素范围内,料液比和反应时间对水解度与抑制率影响不显著,加酶量、温度、pH对水解度与抑制率影响相对显著。因此,以ACE抑制率为响应值,采用Central Composite实验设计优化Alcalase水解鲬鱼蛋白最优工艺参数。不同因素及水平组合条件下ACE抑制率见表5,模型方差分析见表6。
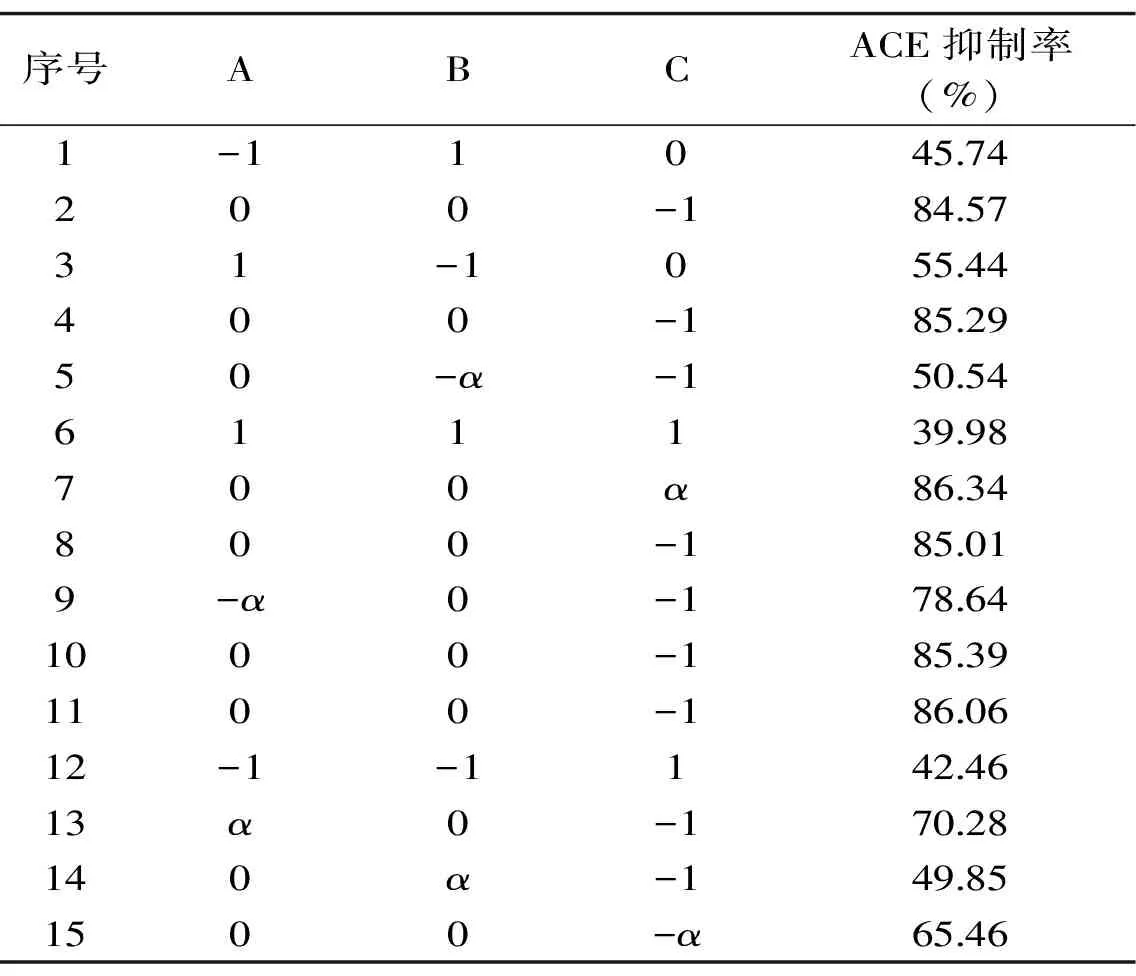
表5 响应面优化试验结果 Table 5 Test design and results
采用Design-Expert 8.0.6软件的非线性回归二次多项式拟合实验数据,得到的预测模型为:
ACE抑制率=85.26-2.96A-0.24B+7.38C-5.40A2-17.53B2-4.68C2+2.70AB+2.80AC-4.76BC+11.74ABC
由表6方差分析结果可以看出,模型p<0.0001方差模型达到极显著,失拟p=0.061>0.05,不显著,因此二次模型成立。模型的一次项A(温度)和C(加酶量)对响应值有显著影响,而B(pH)对响应值无显著影响,说明3个因素中,温度和加酶量对结果的影响较大。由表6中p值可知,3个影响因素对ACE抑制率的影响主次为加酶量>温度>pH。交互项(AB、AC、BC)和二次项(A2、B2、C2)对响应值有显著影响(p<0.05),说明因素之间的交互作用对试验结果产生重要影响。

表6 优化后的模型方差分析表Table 6 The anova table of the model after optimization
2.3.2 ACE抑制率响应面直观分析 响应面可以直观地反映各因素及它们之间的的交互作用对响应值的影响。图8~图10为本实验响应面分析立体图,通过对三维立体图的分析可以很直观的判断加酶量、温度和pH三个影响因素间的互相作用。

图8 加酶量与pH的交互作用对ACE抑制率的影响Fig.8 Effect of interaction between enzyme addition and pH value on ACE inhibition rate
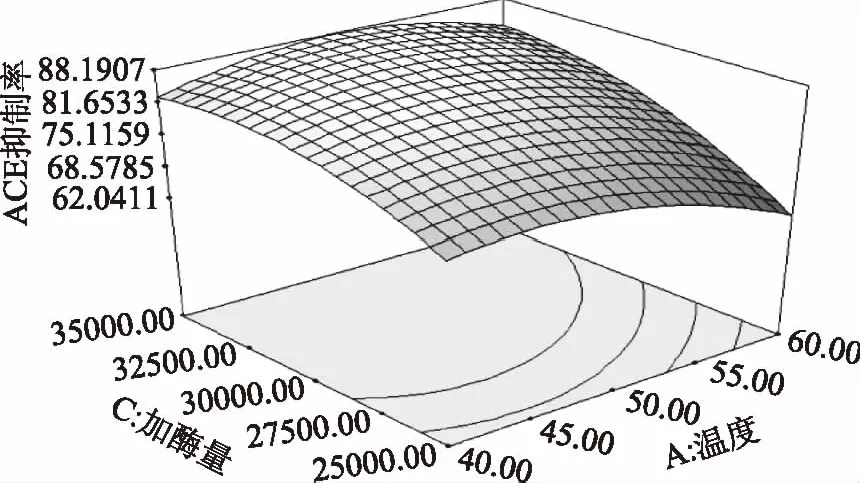
图9 加酶量与温度的交互作用对ACE抑制率的影响Fig.9 Effect of interaction between enzyme addition and temperature on ACE inhibition rate

图10 pH与温度的交互作用对ACE抑制率的影响Fig.10 Effect of interaction between pH value and temperature on ACE inhibition rate
如图8所示,ACE抑制率随pH和加酶量的增加而下降,响应曲面图陡峭说明加酶量和pH之间交互作用极显著,且加酶量上升幅度大于pH上升幅度,说明加酶量对ACE的抑制率的影响较大。由图9可得,加酶量在整个因素水平内,ACE抑制率整体呈增长趋势。温度在整个因素水平的范围内对ACE的抑制率则是先增大后减小的,且整个过程变化平缓。加酶量上升幅度明显大于提取温度上升幅度,说明加酶量对ACE的抑制率的影响较大。由图10可知,随着pH和反应温度的升高,ACE抑制率先升高后缓慢下降,pH和温度两者的交互作用对ACE的抑制率也有显著影响。
根据该模型,得到的最优解为A=48.94、B=7.93、C=32396.6,即最优酶解条件是:温度48.94 ℃,pH7.93,加酶量为32396.6 U/g·pro,固液比1∶5 g/mL,酶解时间2.5 h,在此条件下,模型预测值为88.94%。
2.4 响应面优化结果验证
根据设备精度将最优的酶解条件拟修为温度49 ℃、pH7.9、加酶量32396.6 U/g·pro、固液比1∶5 g/mL、酶解时间2.5 h,做三次平行试验,测得ACE抑制率分别为:85.78%、81.34%、91.67%。使用SPSS进行T检验,由表7~表8可知,t=-0.892小于t(3,0.05)=3.182,可知p大于0.05,表明实测值与预测值无显著差异,模型可靠。

表7 单个样品统计量Table 7 A single sample statistic

表8 单个样品检验Table 8 Single sample inspection
2.5 酶解物ACE抑制率IC50的测定
酶解物肽含量与ACE抑制率量效关系如图11。
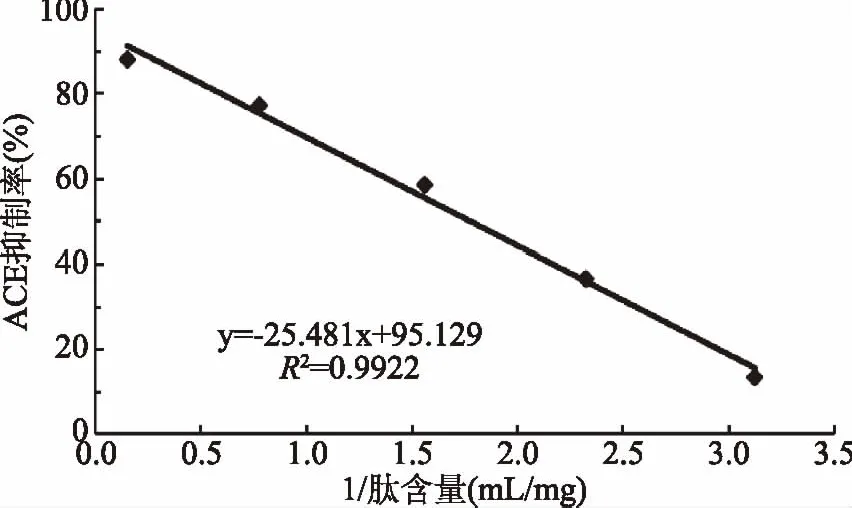
图11 肽含量倒数与抑制率关系Fig.11 The relationship of content of peptides and ACE inhibition activity
在最优酶解条件下制得具有较高的ACE抑制率的水解液,肽质量浓度为6.4 mg/mL。量效呈线性关系,用直线方程进行拟合(图11)。根据量效关系模型计算得IC50=0.269 mg/mL。
2.6 分子量分布测定
测得Sephadex G-15柱的Vo为14.98 mL,Vt为47.50 mL,根据保留各标准物时间计算相应的Ve,各标准物保留时间与Ve分别为:L-酪氨酸保留时间为100.96 min,Ve是40.38 mL;AMP保留时间为80.76 min,Ve是32.30 mL;NAD保留时间为59.82 min,Ve是23.93 mL,;Bacitracin zinc保留时间为35.60 min,Ve是14.24 mL,进而求出有效分配系数Kav,制作标准曲线(图13)。
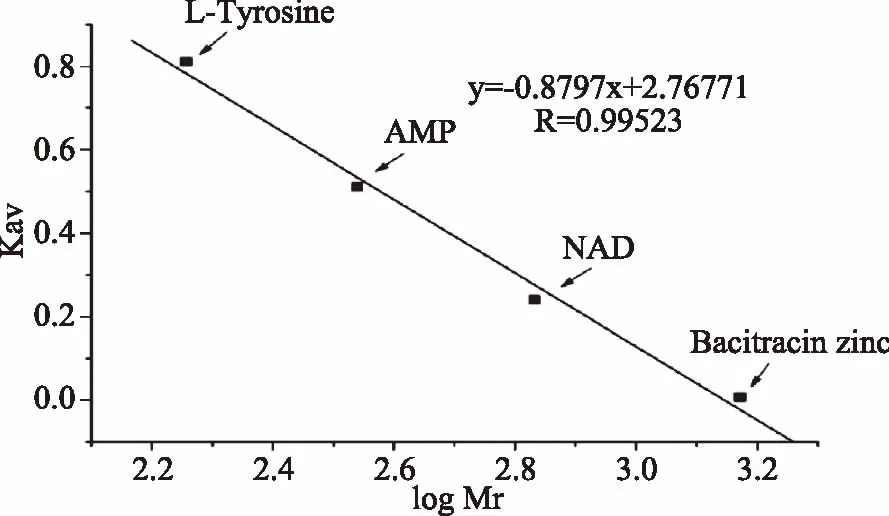
图12 SepHadex G-15柱标准物校准Fig.12 Standard curve of Standard material on SepHadex G-15

图13 酶解物Sephadex G-15层析图谱Fig.13 Chromatography of Hydrolysate of protein from Platycephalus indicus
如图13所示,样品经过Sephadex G-15凝胶分离后得到3峰。峰1的保留时间为62 min,峰2的保留时间为90 min,峰3的保留时间为132 min,经过计算得出峰1的相对分子质量为635,峰2的相对分子质量为258,峰3的相对分子质量为67。测得1号峰ACE抑制率为64.56%,2号峰ACE抑制率为89.09%,3号峰ACE抑制率为60.76%,3个组分的肽含量分别为0.65、4.72、1.02 mg/mL,综上表明活性组分是相对分子质量较小的短肽和氨基酸。
3 结论
在对鲬鱼进行酶解发现,供试的酶中Alcalase适合水解鲬鱼蛋白制备具有ACE抑制活性的水解产物;酶解的最佳条件为:温度48.9 ℃,pH7.93,加酶量为32396.6 U/g·pro,酶解时间2.5 h,固液比1∶5 g/mL,在此条件下水解物的ACE抑制率IC50=0.296 mg/mL。酶解液由相对分子质量为635、258和67的三种组分组成,其中相对分子质量为258的组分是主要活性组分。
