氯化钠添加量对鱼皮明胶凝胶性能和结构的影响
2018-10-24张成强黄轶群樊玉霞赖克强
刘 项,张成强,黄轶群,2,樊玉霞,3,赖克强,3,*
(1.上海海洋大学食品学院,上海 201306;2.长沙理工大学化学与生物工程学院,湖南长沙,410004;3.上海海洋大学食品热加工工程技术研究中心,上海 201306)
明胶是一种天然可溶高分子多肽聚合物,因具有入口即化、良好胶凝性、热可逆性等独特的物理性质和功能特性,被广泛应用于糖果、奶类、肉制品、糕点等各类食品中[1-4]。目前约98.5%明胶从哺乳动物(牛和猪)的皮、骨中提取获得,但由于宗教信仰和疯牛病、口蹄疫等安全问题,其应用受到极大限制[1-2]。鱼胶常作为替代动物明胶的食物成分被广泛应用于食品加工行业,而罗非鱼明胶是一种理想的动物明胶替代品。首先,我国罗非鱼产量为世界第一位,占世界罗非鱼养殖总产量50%以上,2016年产量为186.6万吨。其次,罗非鱼皮富含胶原蛋白,作为鱼肉加工过程中的主要副产物,丢弃会造成资源浪费和环境污染,最后,将鱼皮作为原料提取制成明胶,不仅能缓解传统哺乳动物明胶在宗教和疫病方面的使用局限性,还能延长水产品加工产业链,提高资源的利用率和企业的经济效益[1,4-6]。
在食品生产加工过程中,鱼胶的物化性质受到其它食品成分的影响,如氯化钠的影响不可忽视[7-8]。氯化钠是食品中最为常用的成分或添加剂,主要用于提供咸味及其它风味特征、降低水分活度以延长食品的货架寿命[9]。盐的添加可能会影响明胶分子间结构的变化,改变鱼胶的网状结构,进而影响鱼胶的品质和应用[8,10]。目前氯化钠对鱼明胶性能影响的研究主要集中在其对明胶溶液流变性质和明胶成膜性质的影响[7-8,10]。例如Li等[8]的研究显示,鱼胶中添加1.5%(w/w)的氯化钠,鱼胶膜中无序结构增加,导致其成膜性减弱。Alfaro等[7]发现在pH5.0时,6.67%罗非鱼鱼皮明胶溶液(w/v)的透明度、粘度随着氯化钠浓度(0、0.3、0.8 mol/L)的增加而显著增加,而凝冻强度却显著下降。目前缺乏有关氯化钠对鱼胶凝胶凝胶性能(如真实应力、杨氏模量等参数)与结构影响的系统研究,而凝胶性能是决定成功应用于很多固态(如糖果)及半固态食品(如酸奶、果冻等)中的重要参数之一。
本研究以罗非鱼鱼皮为原料,采用课题组研发的工艺[4],制备鱼皮明胶凝胶,通过单轴压缩实验、借助差示扫描量热仪和红外光谱,研究不同氯化钠添加量对鱼胶凝胶性能与结构的变化规律,实验结果能为鱼胶在食品加工中的应用提供理论依据及指导作用。
1 材料与方法
1.1 材料与仪器
罗非鱼鱼皮 海南翔泰渔业有限公司提供;罗非鱼鱼皮明胶(323 Bloom) 参照本实验组Niu等[14]的方法提取;氯化钠 分析纯,国药集团化学试剂有限公司(上海)。
DV215CD分析天平 美国Ohaus公司;HH-6型数显恒温水浴锅 金坛市金分仪器有限责任公司;IS-RDD3型台式恒温振荡器 美国精骐有限公司;SH-241恒温恒湿箱 上海恒一科学仪器有限公司;TA.XT-Plus质构仪 英国Stable Micro System公司;Nicolet-6700傅里叶变换红外光谱仪 美国赛默飞世尔科技有限公司。Q2000差示扫描量热仪 美国TA仪器沃特世科技(上海)有限公司。
1.2 实验方法
1.2.1 凝胶溶液的制备 配制不同浓度的氯化钠溶液(0、0.5%、1.0%、1.5%、2.0%、3.0%,w/v);分别称取不同质量的鱼皮明胶粉末,加入上述盐溶液,制成不同浓度(2%、4%、6.67%,w/v)的鱼胶-盐溶液(18种),称重记为m,室温下放置30 min,充分溶胀,随后置于50 ℃水浴中溶解15 min,补水至重量为m,移入恒温振荡器,在50 ℃下振荡20 min,得到不同浓度的鱼胶-盐溶液体系,立即用于随后实验。
1.2.2 单轴压缩试验 鱼胶-氯化钠溶液体系,在常温下冷却10 min后,倒入圆柱型POM模具(内径30 mm×高20 mm),封口膜封口;在恒温恒湿箱(4 ℃,RH 75%)放置24 h;取出鱼胶凝胶样品,转移到质构仪载物台托盘上,进行单轴压缩试验。压缩实验的测定条件:探头P/100,表面触发力5 g,测试速度1 mm/s,压缩样品直至样品断裂或至75%的应变[11-12]。
将由单轴圧缩实验获得的力-距离的数据转换为鱼胶凝胶样品的真实应变和真实应力,并进一步计算出杨氏模量。其中真实应力是鱼胶凝胶网络强度的指示参数,杨氏模量同鱼胶的凝胶网络硬度息息相关。真实应力和真实应变转换公式如下:
式(1)
式(2)
式中,F(t)为压缩时样品的瞬时负载力,A0为初样品的初始表面积,H0为样品的初始高度,H(t)为压缩时样品的高度。
杨氏模量的计算方法依据Mao等[12]的方法略有变化。在本实验中,通过凝胶样品应变小于10%时,工程应力和工程应变曲线线性回归时得到的斜率,即为杨氏模量。
1.2.3 差示扫描量热谱采集 称取15 mg左右的鱼胶-氯化钠溶液样品(6.67%,w/v)放入密封的铝锅中,保持温度为50 ℃ 10 min,然后以5 ℃/min 的速率扫描降温至4 ℃,扫描速率为0.5 ℃/min,保持4 ℃ 30 min,而后以相同的扫描速率升温至50 ℃。利用仪器自带软件对DSC曲线进行分析,扫描曲线上转变斜线的中点所对应的温度为明胶凝胶的玻璃化转变温度[13-15]
1.2.4 傅里叶变换红外光谱采集 取1.2.1制备的凝胶溶液,倒入ATR附件装置的ZnSe样品池,封口膜封口,在4 ℃恒温恒湿箱中放置1 h后,进行红外光谱扫描,扫描范围为4000~1000 cm-1,分辨率为4 cm-1,扫描次数为32。每个实验重复三次,取平均值用于进一步研究,所有实验在环境温度为25±0.5 ℃的条件下进行,谱图的峰扣除4 ℃去离子水背景,对波数1700~1600 cm-1范围内的图谱采用Origin 8.0数据处理软件进行基线校正、平滑、去卷积和做二阶导数图谱,通过高斯函数自动拟合直至残差最小,得到子峰图谱(各子峰峰位及峰面积),最后根据积分面积计算对应分离峰占总酰胺带百分比[16-18]。
1.3 数据处理
每次实验设置2个平行实验,重复3次,数据以平均值±标准差表示,并用统计软件SPSS 19.0软件进行显著性分析(p<0.05),用Origin 8.0软件作图。
2 结果与分析
2.1 氯化钠浓度对鱼胶凝胶强度的影响
图1为未添加氯化钠时,不同鱼胶浓度的鱼胶凝胶真实应变-真实应力的代表性曲线。由图1可知,在1.2真实应变时,2%浓度的鱼胶凝胶发生断裂现象,而4%和6.67%浓度的鱼胶中并没有发生这种现象,此时2%、4%和6.67%的鱼胶凝胶真实应力分别为25.0、44.1和70.5 kPa。随着鱼胶浓度的增大,破坏凝胶体系所需要施加的应力就越大,鱼胶凝胶强度也增大,与Czerner 等[19]的报道结果一致。这是因为在鱼胶的凝胶过程中,无序无规则卷曲结构逐渐演变到有序螺旋结构,主要取决于鱼胶分子内部亚基肽链的自身折叠,随着鱼胶浓度的增加,肽链分子间的螺旋交联几率增加,形成的胶凝网络结构更致密,分子间作用力更大,鱼胶凝胶强度增大[20]。
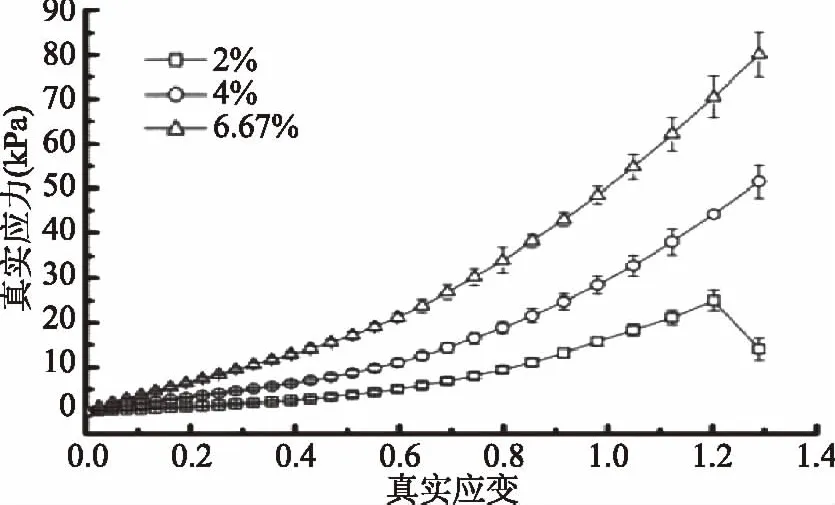
图1 不同浓度鱼胶凝胶的真实应力-真实应变曲线Fig.1 True stress versus true strain for gelatin gels
图2为不同氯化钠添加量、对不同浓度鱼胶凝胶真实应变-真实应力的代表性曲线。由图2可知,不同氯化钠添加量,不同浓度鱼胶的真实应力-真实应变曲线变化趋势相似,但在2%鱼胶浓度,真实应变1.2时发生断裂现象。鱼胶浓度较低时,氯化钠的添加对鱼胶凝胶真实应力的影响不明显,但随添加量的增加,仍呈现缓慢下降趋势,当鱼胶浓度较高时,0和0.5%浓度氯化钠的添加对鱼胶应力无明显影响,但随着氯化钠添加量的继续增加,鱼胶的凝胶强度显著降低(p<0.05),3%时达到最小值,此时2%、4%、6.67%浓度鱼胶在真实应变为1.2时,同未添加氯化钠时相比,鱼胶凝胶真实应力分别下降了14.4%、15.2%和19.5%。这是因为鱼胶浓度越低,分子间间隙越大,越有利于分子间氢键的生成,此时氯化钠的添加,对鱼胶凝胶强度影响较小;鱼胶浓度增大,分子间间隙减小,氯化钠同鱼胶多肽链接触几率增加,不利于鱼胶分子间氢键的缔合[21],随着氯化钠添加量的增大,氯化钠中和了鱼胶表面所携带的电荷,改变了鱼胶体系的静电作用力,抑制了鱼胶分子分子间的相互作用,使得鱼胶分子间的斥力减小,阻碍了鱼胶胶凝网络的形成,导致鱼胶凝胶强度下降[22-23]。

图2 氯化钠添加量对鱼胶凝胶的真实应变-真实应力曲线Fig.2 True stress versus true strain for gelatin gels added with different levels of sodium chloride注:图2a、图2b、图2c分别表示鱼胶的浓度为2%、4%、6.67%的真实应变-真实应力曲线。
2.2 氯化钠浓度对鱼胶杨氏模量的影响
由图3可知,未添加氯化钠时,2%、4%、6.67%的鱼胶凝胶的杨氏模量三次重复的平均值分别为5.88、19.53、41.33kPa,随着鱼胶浓度的增加,鱼胶的杨氏模量显著增加,这是因为鱼胶凝胶的硬度强弱主要是由其浓度决定的,浓度越大的鱼胶更容易聚集形成更多的交联结点,进而形成更复杂的三维网状凝胶结构,导致鱼胶凝胶硬度的增加[8,24]。当鱼胶浓度为2%时,0%、0.5%、1.0%和1.5%的氯化钠添加量对鱼胶杨氏模量无显著性影响(p>0.05),氯化钠浓度继续增加至2.0%时,鱼胶杨氏模量同1.5%浓度无显著性差异,但相对于0%、0.5%和1.0%浓度时显著降低至5.30 kPa(p<0.05),当氯化钠添加量增至3.0%时,鱼胶杨氏模量约为5.12 kPa,为最小值。当鱼胶浓度为4%时,氯化钠添加量小于1.5%时,鱼胶的添加对杨氏模量无显著性影响(p>0.05),当氯化钠添加量达到1.5%,鱼胶的杨氏模量同1.0%浓度无显著性差异,但相比于0%和0.5%浓度显著性降低至17.32 kPa(p<0.05)。当鱼胶浓度为6.67%时,仅仅添加0.5%的氯化钠,鱼胶杨氏模量就显著性降低至40.34 kPa(p<0.05),氯化钠添加量达到3%,杨氏模量下降了13.87%。随着鱼胶浓度的增大,氯化钠的添加対鱼胶的杨氏模量影响越大,这是因为低浓度鱼胶时,氯化钠的添加对鱼胶结构改变不明显,高浓度鱼胶时,随着氯化钠添加量的增加,对鱼胶蛋白质分子结构的破坏作用更强,导致鱼胶凝胶的硬度降低[20]。

图3 不同氯化钠添加量对鱼胶凝胶杨氏模量的影响Fig.3 Effect of different NaCl concentrations on Young’s modulus value of fish gelatin gels注:小写字母不同表示同一鱼胶添加量差异显著(p<0.05)。
2.3 差式扫描量热分析
差示扫描量热仪可以测定明胶凝胶和溶胶时的热焓值,而热焓值可以表征凝胶网状结构交联程度,网状结构的交联程度同凝胶强度正相关[13]。图4和图5分别为不同氯化钠添加量的6.67%浓度鱼胶凝胶和溶胶过程的差式扫描量热谱图。由图可知,不同氯化钠添加量的鱼胶凝胶和溶胶过程的变化趋势相似。在凝胶过程中,鱼胶分子间由无规则卷曲结构向三螺旋结构转变,形成结构致密的网络结构,同时伴随着能量变化,在图4上表现为放热峰;在溶胶过程中,鱼胶分子间由三螺旋结构向无规则卷曲结构转变,鱼胶胶体解旋,并伴随着能量变化,在图5上表现为吸热峰。取DSC曲线转换斜线中线温度为混合体系玻璃化转变温度,相应峰面积为转变过程中热焓变化[18,25]。鱼胶-氯化钠溶液凝胶、溶胶的玻璃化转换温度(Tg,Tm)和热焓值(ΔHg,ΔHm),具体数值见表1。添加氯化钠后,鱼胶在凝胶和溶胶过程中的玻璃化转换温度和热焓均降低,说明氯化钠破坏了混合体系鱼胶的有序网络结构,使凝胶处于不稳定状态。随着氯化钠浓度的增强,玻璃化转化过程中的热焓值下降,说明氯化钠和鱼胶分子间静电作用增强,抑制鱼胶凝胶网络的生成,对凝胶结构的破坏作用增强,导致凝胶中鱼胶分子间交联程度减弱[8,17]。

图4 6.67%浓度鱼胶凝胶过程的DSC曲线Fig.4 The DSC thermogram for fish gelatin gels of 6.67% upon cooling注:1~6分别表示混合凝胶中氯化钠的添加量为0、0.5%、1.0%、1.5%、2.0%、3.0%,w/v;图5同。

图5 6.67%浓度鱼胶溶胶过程的DSC曲线Fig.5 The DSC thermogram for fish gelatin gels of 6.67% upon heating

表1 不同氯化钠添加量的鱼胶的玻璃化转换温度和热焓值Table 1 Glass trasition temperature and enthalpy value of fish gelatin with different NaCl contents
2.4 傅里叶红外光谱分析
傅里叶红变换外光谱具有高精度、高分辨率、高灵敏度、扫描速度快、样品用量少、对样品无损等一系列优势,是化合物鉴定和结构分析的常用手段之一,已被应用于研究蛋白质结构,尤其是1700~1600 cm-1的酰胺Ⅰ带可用于归属蛋白质二级结构和内部氢键结合的探讨[16,18,26-28]。图6为不同浓度鱼胶红外光谱的变化曲线。本次实验鱼胶凝胶结构中的酰胺带主要涉及3个区域,分别为1700~1600 cm-1(酰胺Ⅰ带)、1600~1500 cm-1(酰胺Ⅱ带)和1300~1200 cm-1(酰胺Ⅲ带),同Muyonga等[16]的结果相似。由图6可知,随着鱼胶浓度的增加,酰胺Ⅰ带吸收峰强度逐渐增大,酰胺Ⅰ带吸收峰的位置发生位移。2%、4%、6.67%鱼胶的酰胺Ⅰ带吸收峰位分别位于1647.1、1649.9、1653.0 cm-1,酰胺Ⅰ带吸收峰向高波数方向移动,表明随着鱼胶浓度的增加,鱼胶凝胶三螺旋结构增加,鱼胶胶凝强度进一步增大[29]。

图6 不同浓度鱼胶凝胶的傅里叶变换红外光谱图Fig.6 FT-IR spectra for fish gelatin gels with different content注:1~3分别表示鱼胶凝胶中鱼胶浓度为2%、4%、6.67%。
图7为不同氯化钠添加量对6.67%鱼皮明胶凝胶傅里叶变换红外光谱变化的曲线。不同氯化钠添加量(0、0.5%、1.0%、1.5%、2.0%、3%,w/v)的鱼胶凝胶,酰胺Ⅰ带的吸收峰位置分别为1653.0、1651.0、1650.3、1650.2、1647.3、1646.9 cm-1,伴随氯化钠添加量的增加,酰胺Ⅰ带吸收峰向低波数方向移动。这表明随着氯化钠的添加,鱼胶凝胶三螺旋结构减少,鱼胶凝胶强度降低[28]。图8为酰胺Ⅰ带红外光谱二阶导数谱图,可以明显看出凝胶在1631、1659、1691 cm-1谱峰带处随氯化钠浓度增加而变化,通过对红外光谱图进行去卷积和高斯拟合后可分离出相应的子峰,不同氯化钠添加量酰胺Ⅰ带子峰和面积如表2所示。1630 cm-1谱峰带同明胶多肽链的解旋相关,随着氯化钠添加量的增加,该谱峰带强度增加,鱼胶多肽链的解旋程度增加,鱼胶分子间氢键的生成减少[29];1659 cm-1谱峰带同三螺旋结构和分子间氢键的生成相关,随着氯化钠添加量的增加,该谱峰带强度减小,三螺旋结构和氢键生成减少[28-29];1691 cm-1谱峰带对鱼胶分子内部交联程度敏感,敏感程度可用1690/1659 cm-1的比值大小来衡量,比值越小,表明鱼胶分子间交联程度越弱[30]。由表2可知,1691/1659 cm-1的比值强度,随着氯化钠添加量的增加而逐渐减少,表明鱼胶分子间内部交联程度变差,鱼胶的凝胶网络结构被削弱,鱼胶的凝胶强度下降,这与前文单轴压缩分析和差示扫描量热分析的结果一致。

图7 6.67%浓度鱼胶凝胶的傅里叶变换红外光谱图Fig.7 FT-IR spectra for fish gelatin gels of 6.67%注:1~6分别表示混合凝胶中氯化钠的添加量为0%、0.5%、1.0%、1.5%、2.0%、3.0%,w/v。图8同。

图8 6.67%浓度鱼胶凝胶的傅里叶变换红外光谱二阶导数图Fig.8 FT-IR spectra of second derivative for fish gelatin gels of 6.67%注:图a为全波段红外光谱二阶导数图;图b为酰胺I带红外光谱二阶导数图。

表2 不同氯化钠添加量酰胺Ⅰ带子峰和峰面积Table 2 Peak location and area percentage of fitted components of amide I band with selected sodium chloride concentration
3 结论
单轴压缩实验结果表明,随着鱼胶浓度的增加,鱼胶的真实应力、杨氏模量呈现显著上升的趋势;鱼胶浓度较低时,随着氯化钠添加量的增加,鱼胶凝胶的真实应力和杨氏模量无显著性变化(p>0.05),但鱼胶浓度较高时,随着氯化钠添加量的增加,鱼胶凝胶的凝胶强度和杨氏模量显著降低(p<0.05),当氯化钠添加量达到3%时,鱼胶的凝胶强度和硬度取得最小值,此时,6.67%浓度的鱼胶在70%应变时鱼胶真实应力下降了19.5%,杨氏模量下降了13.87%。差示扫描量热结果表明,随着氯化钠浓度的增加,鱼胶玻璃化转换温度和热焓值均减少,分子内部交联程度变差。傅里叶红外变换光谱结果表明随着鱼胶浓度增加,酰胺Ⅰ带特征吸收峰向高波数区域移动,说明鱼胶分子呈现更多明胶分子自身之间的相互作用,形成更致密的凝胶网络结构;随着氯化钠添加量增加,酰胺Ⅰ带特征吸收峰向低波数区域移动,曲线拟合结果表明凝胶分子肽链解旋程度逐渐增加,氢键形成受到抑制,分子间交联程度变差,说明氯化钠的添加可抑制鱼胶凝胶形成更有序的空间结构,进而削弱鱼胶的凝胶性能。上述研究结果可为鱼胶在食品加工中的应用提供理论依据。
