大蒜素的高效提取工艺研究
2018-08-13陈敏杨晓凤宋君
陈敏,杨晓凤,宋君
(1.四川省农业科学院分析测试中心,成都 610066;2.四川省农业科学院质量标准与检测技术研究所,成都 610066)
大蒜作为日常生活中常见的调味品,历史悠久,而大蒜的特殊风味源于大蒜中的含硫化合物。近年来大蒜越来越多的功效被发现,它被誉为“天然的养生化妆品”、“天然抗生素”,大蒜在改善糖代谢、心血管疾病、防癌治癌等方面有积极作用[1]。目前,以大蒜为原料生产的各种保健品层出不穷,主要因为大蒜中含有一类特殊的生物活性物质——大蒜素(allicin)[2],大蒜素的含量是衡量大蒜及大蒜制品质量的主要指标。然而,大蒜素要从大蒜中提取出来的,首先需要经过酶解过程,且大蒜素易挥发、不稳定,所以影响大蒜素提取率的因素有很多,例如酶解温度、pH值、提取溶剂、体积、温度、时间等。大蒜素主要成分二烯丙基二硫化物(DADS)和二烯丙基三硫化物(DATS)的分子量均在200以内,本文采用气相色谱法测定大蒜素,用标准NY/T 1800-2009提供的方法提取大蒜素,由于酶解温度太高等原因,导致提取率不理想。本文着重对影响大蒜素提取率的几个重要因素进行单因素实验,且在定容步骤之前增加了反萃取步骤,旨在提高大蒜素的提取率,为测定大蒜及大蒜制品中大蒜素的含量提供理论依据。
1 材料与方法
1.1 材料和试剂
新鲜无破损市售大蒜;无水乙醇(≥99.7%,四川西陇化工有限公司);精确pH试纸(上海三爱思试剂有限公司);0.01 mol/L NaOH、DADS标准品(Chromdex)、DATS标准品(TRC)、正己烷(Fisher Chemical,色谱纯)。
1.2 实验仪器
7890A FID气相色谱仪 Agilent公司;DIKW-4 电子恒温水浴锅 北京中兴伟业仪器有限公司;SHA.B 水浴恒温振荡器 金坛市精达仪器制造有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;IKA○RVORTEX GENIUS3 涡旋仪;R-210 旋转蒸发仪 BUCHI公司;JA2003 电子分析天平 上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 大蒜素的提取方法
将大蒜去皮洗净,用组织捣碎机捣成蒜泥,取5 g蒜泥,在一定温度和pH值条件下酶解一定时间,后加入一定体积的90%乙醇,在一定条件下振荡提取大蒜素。提取后过滤,取滤液10 mL,加入正己烷反萃取,然后减压浓缩至1~2 mL,最终用正己烷定容到5 mL。
1.3.2 大蒜素的检测方法
1.3.2.1 标准液的配制
称取一定质量大蒜素标准品DADS和DATS,用丙酮配成浓度分别为14908.6,15835.2 mg/L的标准溶液。分别取上述标准溶液1 mL于50 mL容量瓶中,用丙酮稀释到50 mL,配成DADS和DATS浓度分别为298.17,316.70 mg/L的混合溶液。分别取该混合标准溶液5,4,3,2 mL,用正己烷稀释到10 mL,配成一系列浓度的混合标准溶液。采用气相色谱法测定不同浓度下DADS和DATS的峰面积。
1.3.2.2 检测条件
色谱柱:HP-5(30 m×0.32 mm×0.25 μm);分流比:10∶1;进样口温度:160 ℃;柱温:50~220 ℃;检测器温度:250 ℃;载气流速:2 mL/min;空气流速:400 mL/min;H2流速:40 mL/min。
1.3.2.3 样品中大蒜素的定量
将实验中所得的大蒜素样品用气相色谱法检测,通过外标法(用较近浓度单点定量)计算出大蒜素的浓度,进而计算出大蒜素的提取率。
提取率=大蒜素质量/大蒜质量×100%。
2 结果与讨论
2.1 大蒜素成分分析
大蒜素为淡黄色粉末或淡黄色油状液体,微溶于水,易溶于乙醇、乙醚、苯等有机物,在0.2 kPa时沸点为80~85 ℃[3]。
在新鲜的大蒜中,并不存在大蒜素,其最原始的前体物质是γ-谷氨酰胺-S-烯丙基-L-半胱氨酸。γ-谷氨酰胺-S-烯丙基-L-半胱氨酸在一定条件下水解氧化产生蒜氨酸(alliin),蒜氨酸在大蒜细胞被破坏时产生不稳定的蒜素,蒜素再分解产生多种挥发性脂溶性化合物DADS(二烯丙基二硫化物)、DAS(二烯丙基硫化物)、DATS(二烯丙基三硫化物)、二烯丙基四硫化合物等含硫化合物,这些硫醚类化合物统称为大蒜素[4]。其中含量最多的是二烯丙基二硫化物(DADS)和二烯丙基三硫化物(DATS)[5]。
2.2 酶解条件对大蒜素提取率的影响实验
大蒜在未破坏之前是不存在大蒜素的,大蒜破坏之后释放其内源酶——蒜酶,在蒜酶作用下蒜氨酸酶解成大蒜素[6]。要尽可能地提取出大蒜中的大蒜素,则首先要使酶解条件最佳。一般来说,植物体内的酶最适温度在40~50 ℃,最适pH值大多在4.5~6.5。参照此条件,设计对比实验。
2.2.1 水对酶解效率的影响
称取2份5 g蒜泥,一份加入10 mL水,一份未加水,调节pH值在6.5,后续步骤参照NY/T 1800-2009,计算出大蒜素的提取率,加水之后的提取率较高,故选择酶解之前加水。
2.2.2 pH值对酶解效率的影响
称取2份5 g蒜泥,加入10 mL水,一份调节pH值在6.5,一份未调节pH值,后续步骤参照NY/T 1800-2009,计算出大蒜素的提取率,调节pH值后的提取率较高,故选择酶解之前调节pH值。
2.2.3 温度对酶解效率的影响
称取4份5 g蒜泥,加入10 mL水,调节pH值在6.5,酶解温度分别控制在30,40,50,60 ℃,酶解30 min,后续步骤参照NY/T 1800-2009,计算出大蒜素的提取量,见图1。
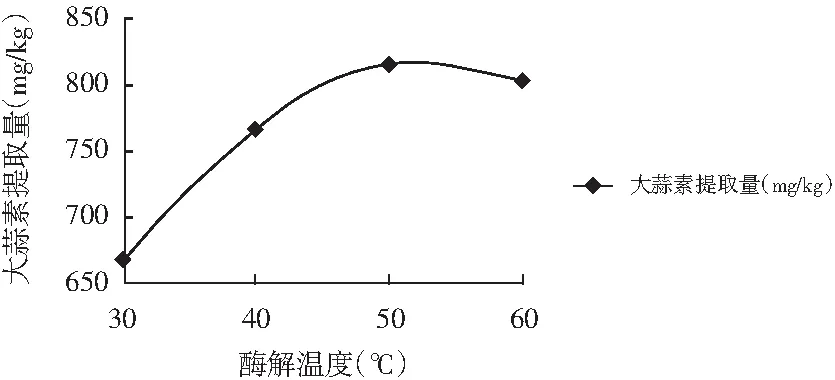
图1 酶解温度对大蒜素提取率的影响Fig.1 Effect of enzymatic temperature on the yield of allicin
由图1可知,酶解温度为50 ℃时大蒜素提取率最高,故选择50 ℃为本实验的酶解温度。
2.2.4 酶解时间对大蒜素提取率的影响
称取2份5 g蒜泥,加入10 mL水,调节pH值在6.5,在50 ℃时,酶解时间分别控制在30 min和60 min,后续步骤参照NY/T 1800-2009,计算出大蒜素的提取率为30 min和60 min相近,故选择酶解30 min。
2.3 乙醇提取大蒜素的单因素实验
目前,提取大蒜素的方法主要有水蒸气蒸馏法、有机溶剂萃取法、超临界提取法等[7]。综合各方法的优缺点以及检测要求,本文采用有机溶剂萃取法[8]。由于大蒜素易溶于乙醇、乙醚、苯等有机物,故采用无毒无害的90%乙醇作为提取溶剂。
2.3.1 料液比对大蒜素提取率的影响
称取4份5 g蒜泥,加入10 mL水,调节pH值为6.5,40 ℃酶解30 min,分别加入15,20,25,30 mL 90%乙醇(即料液比分别为1∶3,1∶4,1∶5,1∶6)振荡提取1 h(60 ℃,120 r/min)。抽滤,取10 mL滤液,然后加入20 mL正己烷于滤液中,涡旋2 min,静置,取上清液上机检测,结果见图2。

图2 料液比对大蒜素提取率的影响Fig.2 Effect of solid-liquid ratio on the yield of allicin
由图2可知,用乙醇提取大蒜中的大蒜素,料液比在1∶6时提取率较高。
2.3.2 提取温度对大蒜素提取率的影响
称取5份5 g蒜泥,加入10 mL水,调节pH值为6.5,40 ℃酶解30 min,加入30 mL 90%乙醇,分别在40,50,60,65,70 ℃振荡提取1 h(120 r/min)。抽滤取10 mL滤液,然后加入20 mL正己烷于滤液中,涡旋2 min,静置,取上清液上机检测,结果见图3。

图3 提取温度对大蒜素提取率的影响Fig.3 Effect of extraction temperature on the yield of allicin
由图3可知,用乙醇提取酶解后大蒜中的大蒜素,提取温度对提取率的影响很大,30~65 ℃呈上升趋势,且速度越来越快,70 ℃时开始下降,所以选择65 ℃作为本实验的提取温度。
2.3.3 提取时间对大蒜素提取率的影响
称取5份5 g蒜泥,加入10 mL水,调节pH值为6.5,40 ℃酶解30 min,加入30 mL 90%乙醇,分别振荡提取0.5,1.0,1.5,2.0,2.5 h(65 ℃,120 r/min)。抽滤取10 mL滤液,然后加入20 mL正己烷于滤液中,涡旋2 min,静置,取上清液上机检测,结果见图4。

图4 提取时间对大蒜素提取率的影响Fig.4 Effect of extraction time on the yield of allicin
由图4可知,当提取时间为2 h时,大蒜素提取率较高,故选择提取时间为2 h。
2.4 用正己烷反萃取乙醇中大蒜素的实验
在NY/T 1800-2009 标准中,用5 mL正己烷反萃取15 mL乙醇溶液中的大蒜素。但大蒜素在乙醇中的溶解度比在正己烷中的更大,根据萃取原理,这种情况下的萃取率是不理想的,故设计实验验证萃取体积对大蒜素提取率的影响[9]。
2.4.1 正己烷体积对大蒜素提取率的影响
取大蒜素(DADS,DATS)标准液(用丙酮配制),先用丙酮稀释成1490.86 mg/L(DADS)和1583.52 mg/L(DATS)的溶液10 mL,再用90%乙醇稀释成一定浓度的混合液。最终二烯丙基二硫化物(DADS)浓度为149.09 mg/L,二烯丙基三硫化物(DATS)浓度为158.35 mg/L(此浓度接近定容后的大蒜素浓度)。准确量取5份该混合液各10 mL于离心管中,分别加入5,10,15,20,25 mL正己烷涡旋2 min。上机检测并计算大蒜素提取率,见图5。

图5 萃取体积对大蒜素提取率的影响Fig.5 Effect of extraction volume on the yield of allicin
提取率随着正己烷体积的增大而增大,增大趋势逐渐减缓,综合提取率和绿色化学两方面考虑,用20 mL正己烷反萃取10 mL乙醇中的大蒜素。
2.4.2 旋蒸温度及真空度对大蒜素提取率的影响
取大蒜素(DADS,DATS)标准液(用丙酮配制),先用丙酮稀释成1490.86 mg/L(DADS)和1583.52 mg/L(DATS)的溶液10 mL,再用90%乙醇稀释成一定浓度的混合液。最终二烯丙基二硫化物(DADS)浓度为149.09 mg/L,二烯丙基三硫化物(DATS)浓度为158.35mg/L(此浓度接近定容后的大蒜素浓度)。准确量取12份该混合液各10 mL于离心管中,分别加入20 mL正己烷涡旋2 min[10]。其中2份直接上机检测大蒜素浓度,作为理论提取量,另外10份在不同温度和真空度下旋蒸到剩下1~2 mL正己烷,用正己烷定容到5 mL,上机检测,并计算大蒜素提取率,见表1。

表1 大蒜素提取率Table 1 The yeild of allicin
由表1可知,30 ℃,0.075 MPa时,未见明显的旋蒸馏分,故选择在30 ℃,0.078 MPa时旋蒸,损失率最低。
3 结论
3.1 本实验确定的优化方法
称取5 g蒜泥,加入10 mL水,调节pH值到6.5,在50 ℃时酶解30 min,加入30 mL 90%乙醇,65 ℃时,120 r/min在水浴振荡器中振荡提取120 min,抽滤后取10 mL滤液,并加入20 mL正己烷,涡旋2 min,取上层液体,在30 ℃,0.078 MPa时旋蒸至正己烷剩下1~2 mL,用正己烷定容到5 mL,FID上机检测。
3.2 本实验所确定方法与NY/T 1800-2009方法比较
称取2份5 g蒜泥,按NY/T 1800-2009处理[11],用FID上机检测,比较2种前处理方法的大蒜素提取率,见表2。
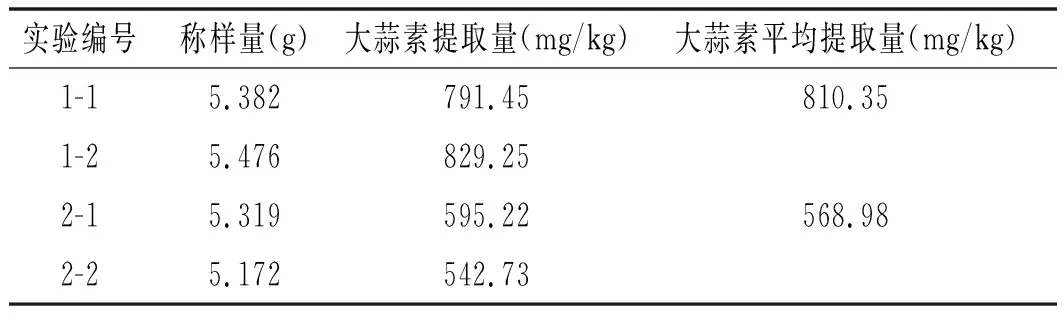
表2 2种前处理方法的大蒜素提取率Table 2 The yeild of allicin with two pretreatment methods
通过对比实验结果(见表2),优化条件下的大蒜素提取率比NY/T 1800-2009标准方法的提取率增加42.4%,且优化方法的操作简单,可以作为日常检测大蒜及大蒜制品中大蒜素含量的方法。由于影响大蒜素提取率的因素较多,在设计实验中可能存在不足,需进一步论证。
