响应面法优化乌榄果总黄酮提取工艺及体外抗氧化活性研究
2018-06-07张立夏何顺晨班峻峰梁燕玲董艳芬吕竹芬
吴 娟, 张立夏, 袁 燕, 何顺晨, 班峻峰, 梁燕玲, 董艳芬, 吕竹芬
(1.广东省药物新剂型重点实验室,广东广州 510006; 2.广东药科大学药物研究所,广东广州 510006;3.广东药科大学基础学院,广东广州 510006)
乌榄别称黑橄榄、木威子,为橄榄科橄榄属植物,分布于我国南部的福建、两广、云南等地,其果实具有止血、利水、解毒之功效,民间常用于治疗风湿性腰腿痛、手足麻木、感冒、上呼吸道炎、肺炎、乳痈等[1-2]。现代药理研究表明,乌榄果具有降压、减慢心率,舒张血管等作用[3-4]。而本课题组前期研究结果发现,乌榄果也具有抑制动脉粥样硬化(atherosclerosis,简称AS)的作用。
AS是具有慢性炎症反应特征的病理过程,其发展始终伴随炎症反应[5]。氧化应激(oxidative stress,简称OS)是指体内氧化与抗氧化作用失衡而倾向于氧化作用,导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物。而氧化应激在动脉粥样过程中扮演重要角色,活性氧簇(reactive oxygen species,简称ROS)产生的活性氧可能在信号转导系统作为一个特殊调节器去中转在细胞膜向细胞核调节信号中环境的或者物理的信号产生,致使炎症基因表达的调节[6-7]。所以抗氧化剂在一定程度上能抑制炎症和AS的发生发展。而与合成抗氧化剂相比,天然抗氧化剂具有低毒、价廉、易得等优点,这也使越来越多的药学家从天然植物中寻找具有抗氧化活性的物质。
黄酮类化合物是一种存在于植物中的天然产物,属于天然抗氧化剂,具有降脂、抗炎、抗动脉粥样硬化、抗肿瘤等活性[8-11]。已有研究表明,乌榄果具有较好的抗氧化活性[12],但有关对乌榄果中抗氧化部位及成分的研究未见报道。采用响应面法对乌榄果中总黄酮的提取工艺进行优化,并考察乌榄果总黄酮提取物的体外抗氧化活性,旨在为乌榄的进一步开发利用和乌榄果总黄酮的生物活性提供理论依据。
1 材料与方法
1.1 材料与试剂
芦丁标准品(批号100080-201409,纯度91.9%,由中国食品药品检定研究院提供);2,2-联苯基-1-苦基肼基(2,2-diphenyl-1-picrylhydrazyl,简称DPPH;上海麦克林生化科技有限公司)、2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)[2,2′-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),简称ABTS;上海阿拉丁生化科技股份有限公司]、2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,简称BHT;上海阿拉丁生化科技股份有限公司)、维生素C(纯度≥97%,广州化学试剂厂);其他所用试剂均为分析纯。
于2015年8月中旬在广东省中山市大涌镇采摘乌榄果药材,由广东药科大学中药标本馆刘基柱教授鉴定为橄榄科橄榄属乌榄的干燥果实。
1.2 仪器与设备
主要仪器有UV-2700紫外-可见分光光度计[岛津企业管理(中国)有限公司]、BS224S型电子天平、CP225D型电子天平[赛多利斯科学仪器(北京)有限公司]、Julabo TW-20水浴锅[优莱博技术(北京)有限公司]、KQ-300DA超声波清洗器(昆山市超声仪器有限公司)、TC-15恒温电热套(海宁市华星仪器厂)、RE52-05旋转蒸发器、循环水式真空泵、LXJ-IIB型低速大容量多管离心机(上海安亭科学仪器厂)、GZX-9246MBE型数显鼓风干燥箱(上海博讯实业有限公司)。
1.3 试验方法
1.3.1 乌榄果总黄酮的提取 乌榄鲜果洗净,晒干,粉碎后过10目筛得到乌榄果粉末,置于4 ℃条件下存放备用。准确称取20 g乌榄果粉末,加入一定体积分数的乙醇溶液,回流提取一定时间,过滤,离心除去药渣,取上清液,作为乌榄果总黄酮提取液(相当于生药浓度为0.05 g/mL,下同)。提取液浓缩至无醇味时,过滤,取沉淀,得到乌榄果总黄酮提取物(记为GC),备用(测体外抗氧化活性)。
1.3.2 总黄酮含量测定方法的建立 取1 mL乌榄果总黄酮提取液,用60%乙醇稀释100倍,摇匀,作为供试品溶液。
1.3.2.1 线性关系考察 总黄酮含量测定方法按照Ibrahim等所述[13],稍加修改。精确吸取0.0、0.5、1.0、2.0、3.0、4.0、5.0 mL 质量浓度为1 mg/mL芦丁标准品溶液于10 mL容量瓶中,分别加0.4 mL 5%亚硝酸钠,摇匀,静置6 min,加入 0.4 mL 10%硝酸铝,摇匀,静置6 min。加4 mL 5%氢氧化钠,用60%乙醇稀释定容,摇匀,静置15 min。以60%乙醇为空白对照,在510 nm处测定吸光度。以所测吸光度(y)对溶液浓度(x)进行回归分析,得到回归方程y=11.723 3x+0.018 798 8(r2=0.999 3),说明芦丁在0~500 μg/mL线性良好。
1.3.2.2 重复性试验 精确量取6份1 mL供试品溶液,按“1.3.2.1”节下方法测定吸光度D510 nm,所测供试品的相对标准偏差(relative standard deviation,简称RSD)为1.29%,小于2.00%,说明该方法重复性良好。
1.3.2.3 溶液稳定性试验 精确量取1 mL供试品溶液,按“1.3.2.1”节下的方法分别于1、2、3、4、5 h测定吸光度D510 nm,结果表明该方法在5 h内稳定。
1.3.2.4 回收率试验 向供试品溶液中加入一定量的芦丁对照品溶液,按“1.3.2.1”节下方法测定总黄酮含量,计算回收率为102.47%(RSD=2.075%,n=6),说明回收率良好。
1.3.2.5 乌榄果总黄酮提取率的计算
总黄酮提取率=乌榄果中总黄酮质量/乌榄果药材质量×100%。
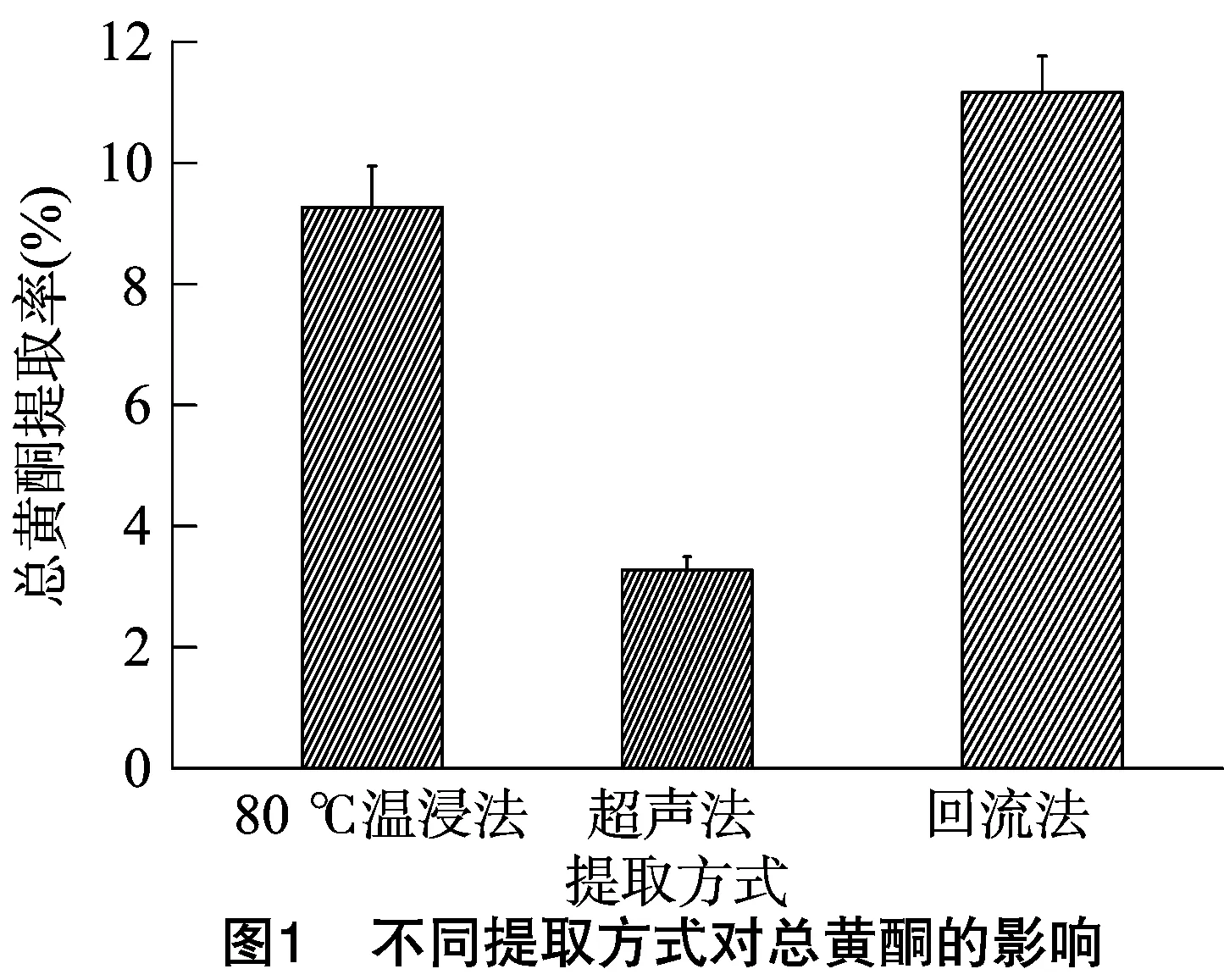
1.3.3 单因素试验 在前期的试验过程中,比较回流提取法、超声法和80 ℃温浸法对乌榄果黄酮类成分提取效果的影响,结果发现,回流提取效果最佳(图1)。因此,选择回流法作为工艺优化的提取方法,以乌榄果总黄酮提取率为指标,对提取工艺中的提取次数、乙醇体积分数、提取时间和料液比等因素进行单因素考察,为黄酮的最佳提取工艺优化提供数据支持。
1.3.3.1 料液比对总黄酮提取率的影响 称取20 g乌榄果粉末,平行5份,分别以料液比(g ∶mL)为1 ∶10、1 ∶15、1 ∶20、1 ∶30、1 ∶40的比例加入50%乙醇,回流提取1 h,按“1.3.2.1”节下方法测定总黄酮含量。
1.3.3.2 乙醇体积分数对总黄酮提取率的影响 称取20 g乌榄果粉末,平行5份,加入400 mL不同体积分数(10%、30%、50%、70%、90%)的乙醇溶液,回流提取1 h。按“1.3.2.1”节下方法测定总黄酮含量。
1.3.3.3 提取时间对总黄酮提取率的影响 称取20 g乌榄果粉末,平行4份,加入400 mL 50%乙醇,分别回流提取1、2、3、4 h,按“1.3.2.1”节下方法测定总黄酮提取率。
1.3.3.4 提取次数对总黄酮提取率的影响 称取20 g乌榄果粉末,平行3份,加入400 mL 50%乙醇,分别提取1、2、3次,每次1 h,过滤,合并提取液,按“1.3.2.1”节下方法测定总黄酮含量。
1.3.4 Box-Behnken响应面法试验设计优化提取工艺 在单因素试验的基础上,根据Box-Behnken设计原理,以乌榄果总黄酮提取率为响应值,选取提取乙醇体积分数(A)、提取时间(B)、液料比(C)3因素3水平的响应面分析法进行试验设计(表1),试验方案与结果见表2。

表1 Box-Behnken响应面试验因素与水平
1.3.5 乌榄果总黄酮体外抗氧化活性研究
1.3.5.1 DPPH·清除率 参考Santos等的方法[14],并加以修改。在10 mL具塞刻度试管中,精确加入2.0 mL 0.1 mmol/L DPPH乙醇溶液及2 mL不同质量浓度(0.001、0.005、0.010、0.050、0.100 mg/mL,以乌榄果总黄酮提取物质量计,溶剂为乙醇溶液,下同)的GC溶液,充分混合,室温避光反应30 min,517 nm波长处测定吸光度D517 nm,记为Dsample;以等体积无水乙醇代替提取液,同法操作所得D517 nm记为Dcontrol;以等体积无水乙醇代替DPPH乙醇溶液,加入不同质量浓度的提取液,同法操作所得D517 nm记为Dblank;以维生素C及BHT为阳性对照,平行测定3次,取平均值。采用SPSS 21.0软件对数据进行回归分析,计算IC50。
1.3.5.2 ABTS·清除率的测定 ABTS·清除率的测定参考Re等的方法[15],并稍加修改。取40 μL质量浓度为0.10、0.20、0.40、0.60、0.75、0.80、0.85、0.90、0.95、1.00 mg/mL的GC溶液,加入4 mL 7 mmol/L的ABTS测定液,振摇30 s,反应10 min后,在734 nm波长处测得D734 nm,平行测定3次,取平均值。同时,以维生素C为阳性对照(质量浓度为0.05、0.10、0.20、0.23、0.26、0.30 mg/mL),同法测定。
1.3.5.3 总还原力测定 总还原能力测定参考Luqman等的方法[16]。在700 nm波长下测定D700 nm,待测样品的D700 nm越大,其还原力越强,抗氧化活性就越强。准确移取20、40、60、80、100、120 μL质量浓度为0.5 mg/mL的GC溶液,加蒸馏水至0.5 mL,依次加入1.0 mL pH值为6.6的磷酸盐缓冲溶液、2.0 mL 1%铁氰化钾,于50 ℃条件下水浴20 min,急速冷却,加入1.0 mL 10%三氯乙酸、0.5 mL 0.1%三氯化铁,摇匀,室温下静置10 min;以维生素C为阳性对照(准确移取20、40、60、80、100、120 μL质量浓度为0.2 mg/mL的维生素C溶液),在700 nm波长处测定吸光度D700 nm,平行测定3次,取平均值。

表2 试验方案与结果
2 结果与分析
2.1 料液比对总黄酮提取率的影响
由图2-A可知,随着料液比的增加,总黄酮提取率随之增加,当料液比为1 g ∶40 mL时,总黄酮提取率为13.05%,考虑到实际生产,选取料液比为1 g ∶20 mL~1 g ∶40 mL进行响应面优化试验。
2.2 乙醇体积分数对总黄酮提取率的影响
由图2-B可知,当乙醇体积分数在10%~50%范围内,随着乙醇体积分数的增加,总黄酮提取率明显增加;当乙醇体积分数达到50%时,黄酮提取率达到最大值;此后黄酮提取率呈下降趋势。因此,选择乙醇体积分数50%~70%进行响应面优化试验。
2.3 提取时间对总黄酮提取率的影响
由图2-C可知,提取时间在1~3 h时,总黄酮提取率随着提取时间延长而明显增加;提取时间为3 h时,总黄酮提取率达到最大;提取时间到4 h时,黄酮提取率反而降低,这可能是由于时间的增加使部分黄酮被氧化而导致含量降低。因此,选择提取时间2~4 h进行响应面优化试验。
2.4 提取次数对总黄酮提取率的影响
由图2-D可知,随着提取次数的增加,总黄酮提取率增加不明显。考虑到实际生产,选取1次提取。

2.5 Box-Behnken响应面法试验结果
利用Design-Expert 8.0软件对试验数据进行二次多项式回归拟合,得到总黄酮提取率的数学回归模型为:总黄酮提取率(%)=10.61-1.66A+0.44B+0.99C-0.49AB+0.46AC+0.31BC-0.50A2-0.67B2-0.016C2,对此模型进行方差分析,结果如表3所示;绘制响应面和等高线,如图3所示。
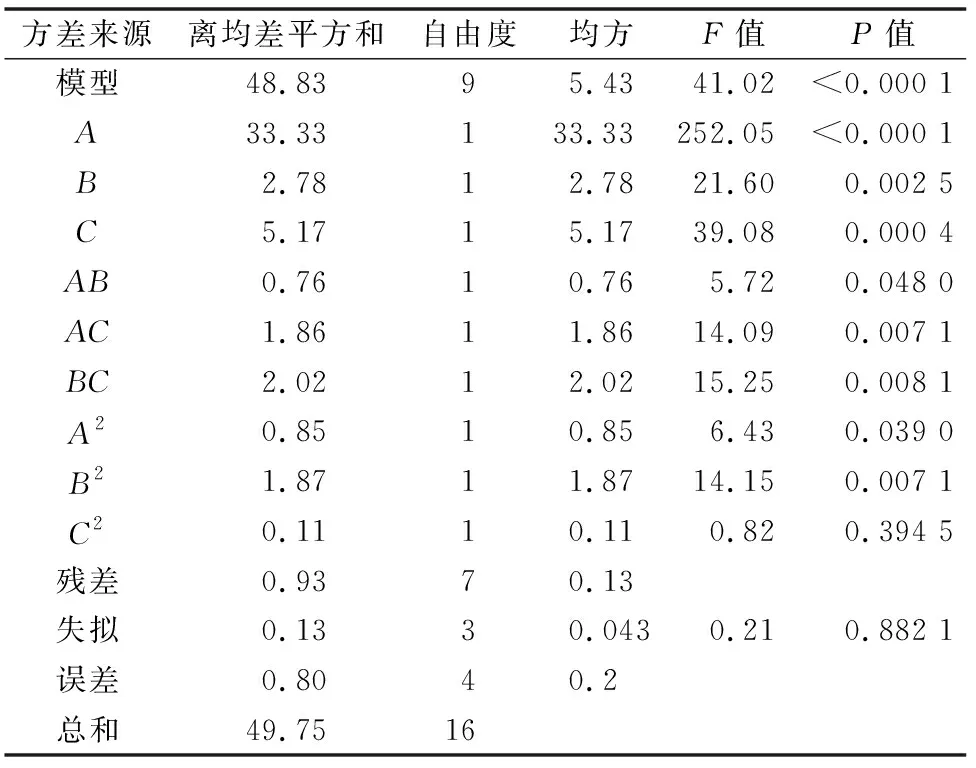
表3 回归模型的方差结果分析

由表3可知,回归模型的P<0.000 1,表明该回归模型极显著;失拟项P>0.05,不显著,说明该模型成立。模型的相关系数r2=0.981 4,校正相关系数r2=0.957 5,r2和校正r2均较高且接近,说明模型准确性和通用性较高;变异系数值为3.06%<10.00%,说明试验的可信度与精确度高,拟合程度较好,试验操作可行,可以用此模型来预测乌榄果总黄酮最佳提取工艺条件。该回归模型中的一次项A、B、C,交互项AB、AC、BC,二次项A2、B2对总黄酮提取的综合评分影响显著。各因素对乌榄果总黄酮提取率的影响大小顺序依次为乙醇体积分数(A)>料液比(C)>提取时间(B)。由图3可知,A与C的曲面变化幅度较大,说明料液比和乙醇体积分数对综合评分结果交互作用明显。
通过软件对二次多项式回归方程进行分析预测,乙醇回流提取乌榄果总黄酮的最佳提取工艺条件:乙醇体积分数为50%,提取时间为4 h,料液比为1 g ∶40 mL,此时能够得到的总黄酮提取率最高,为15.278 2%。在此条件下进行3次验证性试验,结果表明,乌榄果总黄酮提取率为(15.060±0.035)%,与理论值相比误差仅为0.218 2,验证了该模型是可行有效的。
2.6 乌榄果总黄酮体外抗氧化活性研究
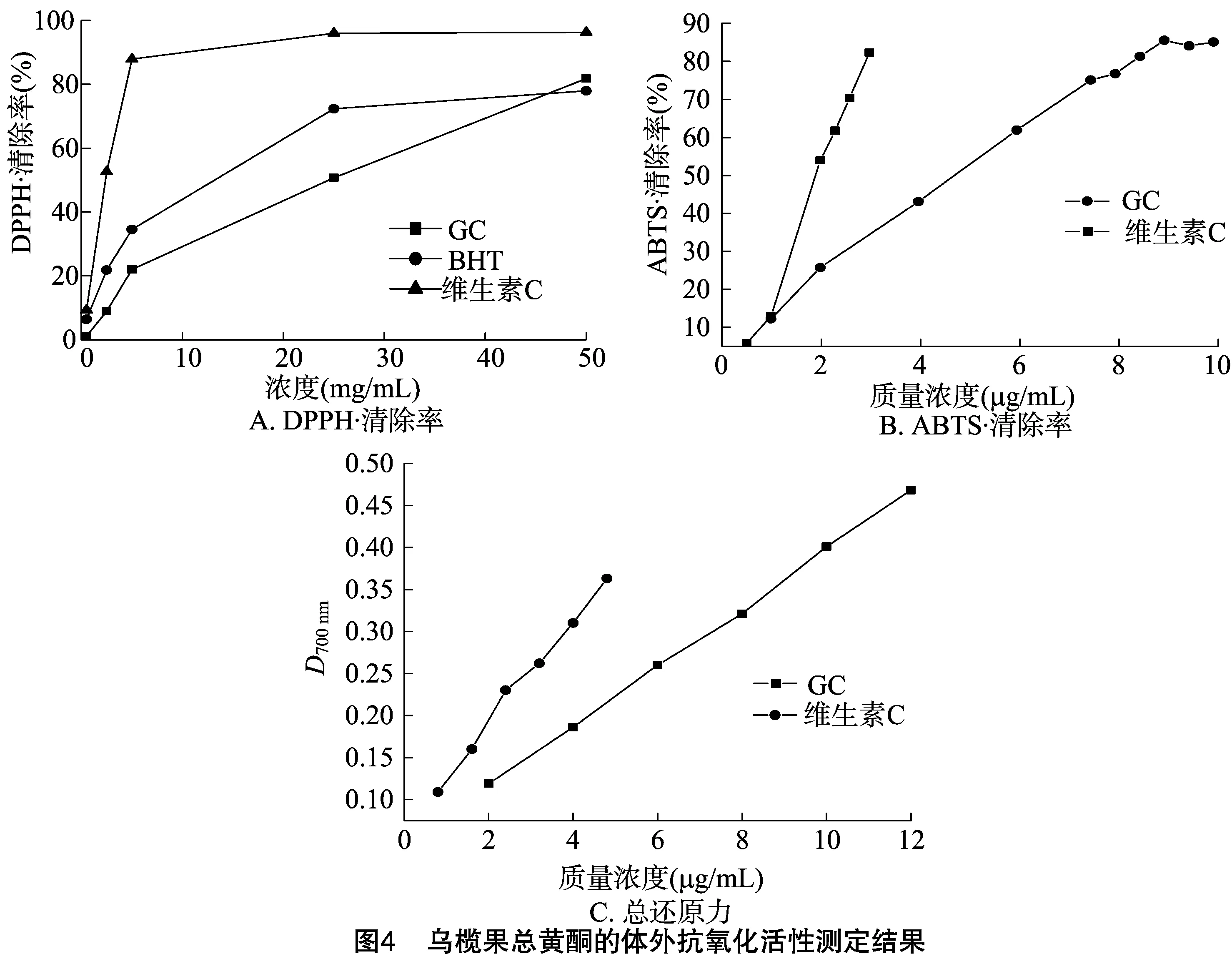
2.6.1 DPPH·清除率 由图4-A可知,在试验质量浓度(0.5、2.5、5.0、25.0、50.0 μg/mL)范围内,乌榄果总黄酮提取物、维生素C及BHT均具有清除DPPH自由基的作用,同等浓度下清除DPPH自由基的能力由高到低依次为维生素C>BHT>GC,其IC50分别为(2.08±0.10)、(10.15±0.51)、(18.18±0.71) μg/mL,且清除率随着质量浓度的增大而升高,呈明显的剂量依赖关系。
2.6.2 ABTS·清除率 当GC质量浓度为0.99、1.98、3.96、5.94、7.43、7.92、8.42、8.91、9.41、9.90 μg/mL,维生素C质量浓度分别为0.50、0.99、1.98、2.28、2.57、2.97 μg/mL时,对ABTS·的清除率进行测定。由图4-B可知,维生素C及GC均具有较高清除ABTS·的作用,其IC50分别为(1.71±0.02)、(3.88±0.10) μg/mL,且清除率随着质量浓度的增大而升高,呈明显的剂量依赖关系。
2.6.3 总还原力测定 当GC质量浓度为2.0、4.0、6.0、8.0、10.0、12.0 μg/mL,维生素C的质量浓度为0.8、1.6、2.4、3.2、4.0、4.8 μg/mL时,对总还原力进行测定。由图 4-C 可知,在试验质量浓度范围内,随着乌榄总黄酮和维生素C的质量浓度增大D700 nm明显增加,说明二者均具有良好的还原能力,在相同质量浓度下,维生素C的总还原力大于乌榄果总黄酮。
3 结论与讨论
采用响应面法对乌榄果总黄酮的提取工艺进行优化,最佳提取工艺条件:乙醇体积分数为50%、料液比1 g ∶40 mL、提取时间为4 h;3次验证试验结果为(15.060±0.035)%,与模型预测值15.278 2%接近,说明采用Box-Behnken方法优化提取总黄酮工艺行之有效,为以后乌榄果总黄酮的产业化提供指导。
从DPPH·清除率、ABTS·清除率及总还原力3个方面对乌榄果总黄酮的体外抗氧化活性进行评价。结果表明, 乌榄果总黄酮对DPPH·、ABTS·均具有较强的清除能力,其半数抑制浓度(IC50)分别为(18.18±0.71)、(3.88±0.10) μg/mL[维生素C的IC50分别为(2.08±0.10)、(1.71±0.02) μg/mL],有较强的还原能力,说明乌榄果总黄酮具有较好的体外抗氧化活性。
AS与炎症的关系相当复杂,在AS病变的发生发展过程中,从脂质条纹到纤维斑块和粥样斑块乃至不稳定斑块的生成、破裂和血栓形成,始终都有各种炎症细胞和大量炎症介质参与。乌榄果总黄酮的抗氧化活性能从减少氧化应激的角度,在一定程度上抑制AS及炎症病变的发生发展,但对于其体内抗氧化活性及其抗炎、抑制AS作用的机制还未知,而这也是本课题组下一步须要探讨的。
参考文献:
[1]萧步丹. 岭南采药录[M]. 铅印本,广东,1932(民国21年).
[2]赵国平,戴 慎,陈仁寿. 中药大辞典(上册)[M]. 2版. 上海:上海科学技术出版社,2006:661.
[3]董艳芬,梁燕玲,罗 艳,等. 乌榄果降压作用的实验研究[J]. 医学理论与实践,2006,19(8):880-882.
[4]梁燕玲,罗 艳,李永亮,等. 乌榄果对大鼠血管张力的作用[J]. 中国老年学,2011,31(16):3099-3100.
[5]Ross R. Atherosclerosis-an inflammatory disease[J]. New England Journal of Medicine,1999,340(2):115-126.
[6]Szasz T,Thakali K,Fink G D,et al. A comparison of arteries and veins in oxidative stress:producers,destroyers,function and disease[J]. Experimental Biology and Medicine,2007,232(1):27-37
[7]Alexander R W. Theodore cooper memorial lecture. Hypertension and the pathogenesis of atherosclerosis. Oxidative stress and the mediation of arterial inflammatory response:a new perspective[J]. Hypertension,1995,25(2):155-161.
[8]曹 宁,郭文洁,唐佳瑜,等. 乌药叶总黄酮对高脂血症脂肪肝小鼠模型的降脂作用[J]. 中药新药与临床药理,2011,22(2):149-153.
[9]张宝徽. 人字草抗炎物质基础及其总黄酮提取物的研究[D]. 武汉:湖北中医药大学,2012.
[10]祝晓庆,杨 洁,刘 超,等. 中草药黄酮类化合物防治动脉粥样硬化的实验研究进展[J]. 湖北科技学院学报(医学版),2017,31(4):358-361.
[11]杨 楠,贾晓斌,张振海,等. 黄酮类化合物抗肿瘤活性及机制研究进展[J]. 中国中药杂志,2015,40(3):373-381.
[12]张树球,农 嵩,李朝敢,等. 乌榄等对氧自由基清除率的影响[J]. 中国老年学,2001,21(3):237-238.
[13]Ibrahim R M,El-Halawany A M,Saleh D O,et al. HPLC-DAD-MS/MS profiling of phenolics fromSecurigerasecuridaca,flowers and its anti-hyperglycemic and anti-hyperlipidemic activities[J]. Revista Brasileira De Farmacognosia,2015,25(2):134-141.
[14]Santos S A O,Pinto P C R O,Silvestre A J D,et al. Chemical composition and antioxidant activity of phenolic extracts of cork fromQuercussuberL.[J]. Industrial Crops and Products,2010,31(3):521-526.
[15]Re R,Pellegriegrini N,Proteggente A,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999,26(9/10):1231-1237.
[16]Luqman S,Srivastava S,Kumar R,et al. Experimental assessment ofMoringaoleiferaleaf and fruit for its antistress,antioxidant,and scavenging potential usinginvitroandinvivoassays[J]. Evidence-Based Complementary and Alternative Medicine,2012,2012:1-12.
