芒果LAR基因的克隆及其表达分析
2018-06-07赵志常高爱平黄建峰罗睿雄刘宽亮
赵志常, 高爱平, 黄建峰, 罗睿雄, 刘宽亮
(1.中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创制重点开发实验室,海南儋州 571737;2.国家热带果树品种改良中心,海南儋州 571737; 3.海南大学农学院,海南海口 570228)
无色花青素还原酶(leucoanthocyantin reductase,简称LAR)催化黄烷3,4二醇转化为2,3-反式黄烷三醇,比如生成儿茶素、没食子儿茶素等[1-2]。目前已从拟南芥、茶树、苜蓿、甘肃红豆草、黑枸杞、百脉根等多种植物中克隆得到LAR基因[3-9]。LAR是由花青素还原酶(anthocyanidin reductase,简称ANR)经过MYB转录因子家族共同调控的,对其酶活性的检测也有相关的报道,如在蒺藜苜蓿中编码LAR的基因已经鉴定,并进行了重组LAR经体外纯化后的活性检测,而与金钱草的叶子纯化过的酶活相比非常低;也有研究表明,不能检测到莲属植物中重组LAR的任何活性,除非体系中只有单一蛋白且用无色花青素作底物时,可以检测到LAR的微弱活性[2]。芒果(Mangiferaindica)是重要的热带、亚热带果树,其果实色彩多样,如绿色、黄色、浅黄色、红色、橙红色等[10]。芒果果实中含有黄酮类、类胡萝卜素和花青素等物质。芒果果实的LAR基因的研究工作未见报道,本研究采用RACE方法从芒果的果实中克隆得到1个LAR基因,深入探讨该基因在芒果果实原花色素合成的作用机制及其对果实果皮的影响,借以深入揭示该基因在芒果果实作用的分子机制,为芒果果实生产提供一定的理论依据。
1 材料与方法
1.1 材料
在贵妃芒果完全成熟变黄时,用刀片取其果皮,切碎放入采样袋中用液氮速冻后立即放入-80 ℃冰箱内保存备用。
1.2 试验方法
1.2.1 果皮总RNA提取 采用植物RNA提取试剂盒,用DNase试剂盒进行基因组DNA消除,RNase-free无菌水溶解,采用SMARTerTMRACE Amplification Kit(Clontech)反转录合成cDNA。
1.2.2 PCR扩增 反应条件为94 ℃预变性4 min;94 ℃变性50 s,50 ℃退火50 s,72 ℃延伸2 min,35个循环;72 ℃继续延伸7 min。反应体系为25 μL,其中含10×PCR buffer(含Mg2+)2.5 μL、25 ng DNA模板、20 μmol引物、1.0 UTaqDNA聚合酶、5.0 mmol dNTPs。
1.3 LAR基因全长cDNA序列的获得
以合成的cDNA为模板,根据已知的LAR基因片段设计cDNA 3′ RACE和5′RACE引物,进行3′和5′端的扩增。将目的基因片段回收、连接、转化、鉴定及测序,并根据得到的cDNA 3′ 端和5′末端的序列结果拼接LAR的全长cDNA,设计特异引物,进行全长cDNA序列的扩增。
1.4 LAR基因生物信息学分析
根据Blast(http://www.ncbi.nlm.nih.gov/Blast)登录的LAR蛋白序列进行氨基酸序列的同源性分析,用DNAMAN软件进行序列多重比对,并绘制系统进化树推断其在进化过程中的亲缘关系。采用Bioedit软件对LAR蛋白中各个氨基酸的含量、亲水/疏水性进行分析。采用WoLFPSORT(http://www.genscript.com/wolf-psort.html)软件进行定位预测,采用Swissmodel(http://swissmodel.expasy.org/)进行蛋白的三级结构预测。
1.5 表达分析
分别提取3种不同色泽芒果的RNA,反转为cDNA并采用primer 5.0设计引物进行反转录PCR(reverse transcription-PCR,简称RT-PCR)的扩增。RT-PCR分析采用的内参引物序列为actin-F 5′-AATGGAACTGGAAT GGTCAAGGC-3′,actin-R 5′-TGCCAGATCTTCTCCATG TCATCCCA-3′;目的基因扩增采用的引物为:LAR-F,5′-TCG GTCATTTTGTAGCCGAC-3′,LAR-R 5′-ATACAATG GAGCAACGTAACTA T-3′,PCR 产物在1.0%的琼脂糖凝胶上进行电泳,并采用Quantity One软件进行数据分析,作出相对表达量。
2 结果与分析
2.1 LAR基因的获得
根据得到的3′端和5′端序列信息进行拼接,最后得到LAR基因的全长cDNA序列。根据拼接序列设计特异性引物进行全长cDNA序列的扩增,电泳条带回收测序后得到LAR基因的cDNA全长序列为1 221 bp,分析发现开放阅读框为 1 059 bp,编码352个氨基酸序列,通过NCBI上已经登录的茶树、草莓、大豆的LAR蛋白序列进行了比对(图1)发现,克隆的基因为芒果LAR基因。
2.2 芒果LAR基因的部分生物信息学分析
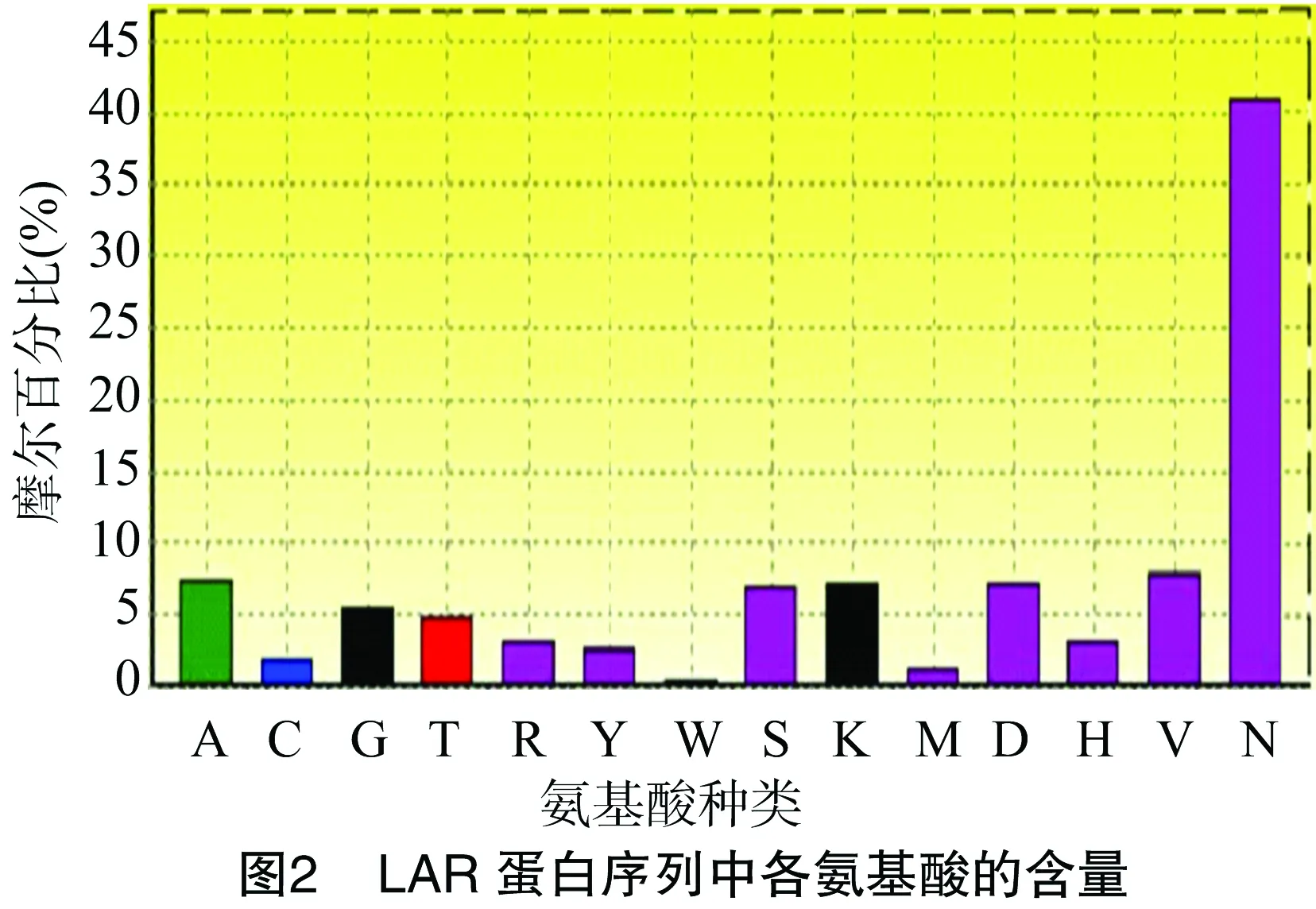
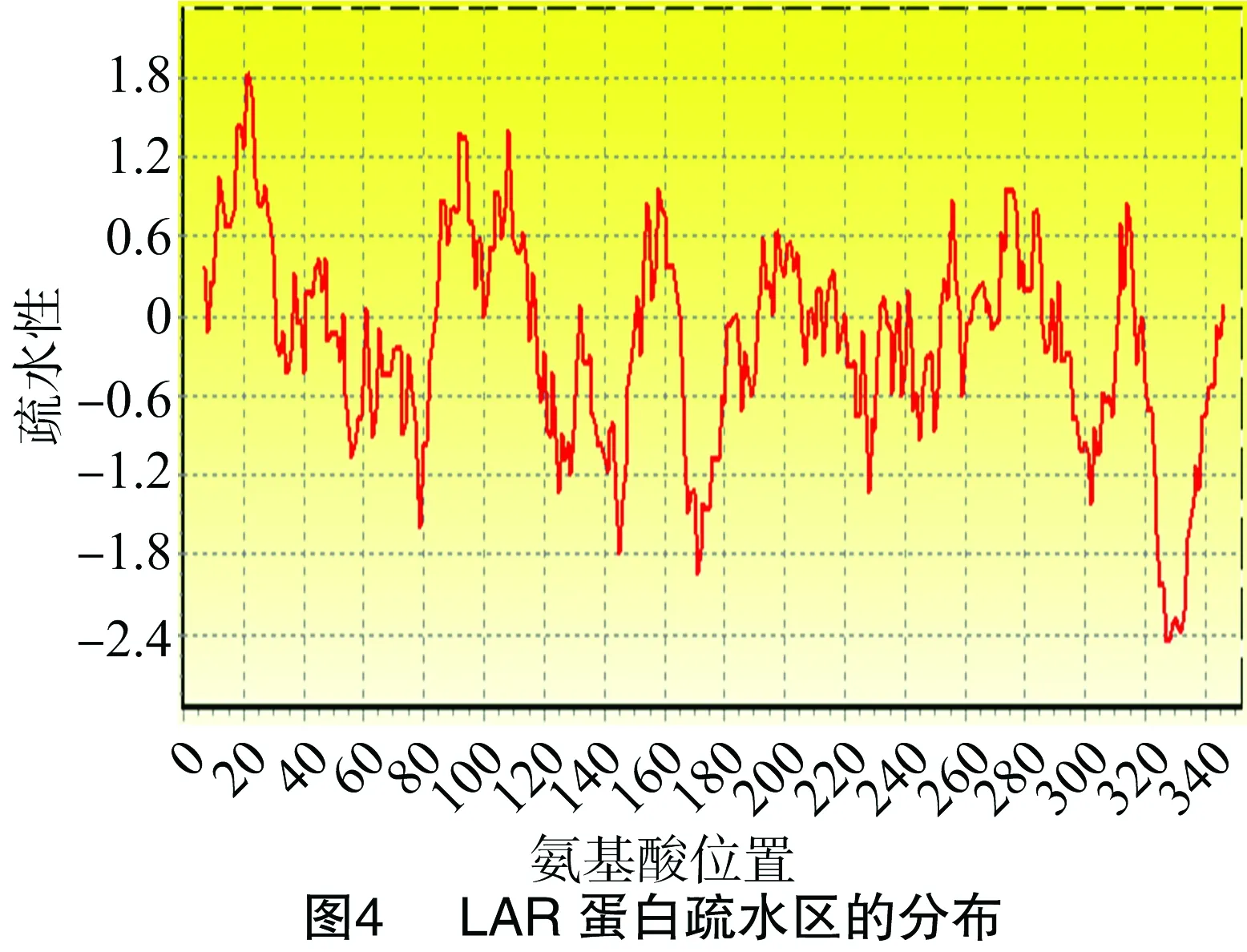
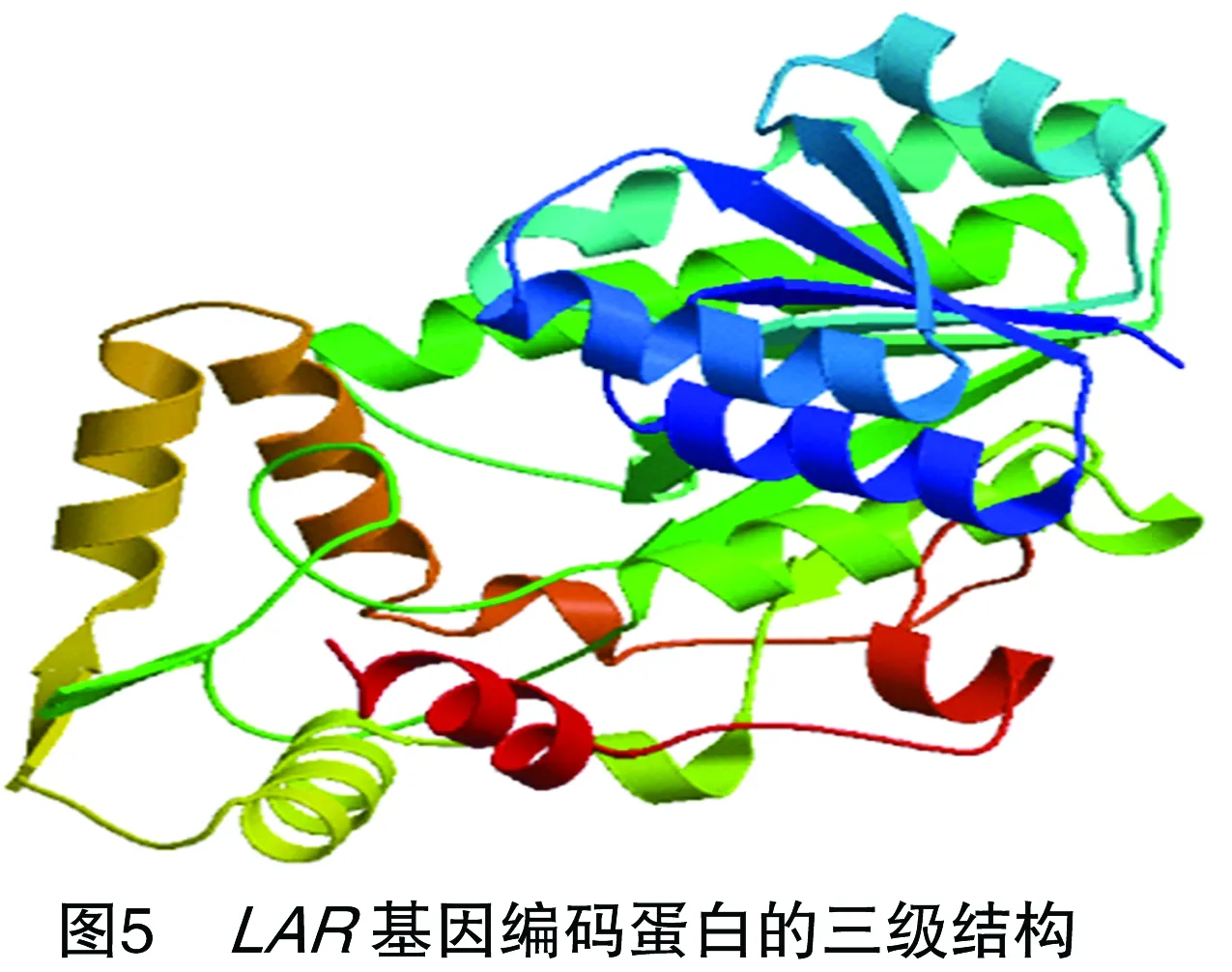
采用Bioedit软件对芒果LAR蛋白中各个氨基酸的含量进行分析发现,该蛋白天冬酰胺的含量较高,而其他的氨基酸含量相对比较低(图2),对其蛋白二级结构进行预测发现,芒果LAR蛋白的二级结构主要以无规则卷曲和β-折叠为主,也具有少量的α-螺旋结构(图3)。采用Bioedit软件的Kyte和Doolittle算法对LAR蛋白的亲水/疏水性(正值表示疏水性,负值表示亲水性)进行分析,LAR蛋白所含的氨基酸主要介于1.8~-2.4之间(图4)。采用WoLFPSORT(http://www.genscript.com/wolf-psort.html)软件对LAR蛋白进行定位预测发现,该基因定位在细胞质中,采用Swissmodel(http://swissmodel.expasy.org/)在线软件对蛋白的三级结构进行预测,推导出该蛋白可能的三级结构构型(图5)。采用DNAMAN软件进行亲缘关系聚类分析发现,芒果LAR蛋白与棉花、葡萄、蓝莓、柿等植物的蛋白序列聚为一类(图6)。
2.3 LAR基因的RT-PCR分析
提取3种不同颜色的芒果品种果皮的RNA,反转录为cDNA,通过上述RT-PCR分析的引物进行扩增,对扩增结果进行分析发现,该基因在绿色桂七品种的果实中表达较多,在红色果皮的贵妃品种中表达次之,而黄色果皮的金煌品种中相对表达较少(图7)。
3 讨论
在果树的果实中其次生代谢物合成与积累量取决于其合成途径中一些关键酶的功能和含量,这些关键酶一般位于代谢支路分叉口或途径的下游。芒果无色花青素还原酶(LAR)基因的克隆与分析有助于解析芒果果皮中儿茶素合成和积累的机制。聚类分析结果发现,芒果LAR蛋白与棉花、葡萄、蓝莓、柿等可以聚为一类,说明在这些植物中LAR蛋白具有一定的相近关系,而生长在温带的苹果、西洋梨、甜樱桃、海棠、草莓等植物聚在一类,可见,LAR蛋白序列在不种植物间的差异符合一些植物学分类学的特征,在一定程度上反映不同果树植物在进化过程中对温度的需求关系。对LAR基因的表达分析发现,在绿色果实品种中表达量较高,而在黄色品种中表达量较低,这可能与果实中原花色素、黄酮类物质的含量有一定的关系。有研究报道,在红豆草中LAR基因的表达在不同组织中有一定的差异,其中在叶片中的表达量最高,其次是花和果实,在茎秆中表达量最低[6];在毛白杨中的表达[11]与此一致。Bogs等对LAR基因在葡萄中的表达进行研究发现,在叶子、花、果实中均有表达,且随着叶子、花、果实的生长,原花色素不断增加,在成熟的果实中表达LAR基因表达量较少,原花色素也不再增加[12]。本研究发现,LAR基因在绿色桂七芒果品种中表达较高,而在黄色的金煌品种中表达量较低,这与果皮中原花色素的含量表现得一致。故推测,LAR基因表达在原花青素途径中具有重要的作用。芒果LAR基因是芒果原花色素合成代谢途径中的一个关键基因,其对芒果果皮色泽的影响具有重要作用,而其对芒果果实色泽功能的影响须要进一步转基因植物表达的验证。



参考文献:
[1]Tanner G J,Francki K T,Abrahams S,et al. Proanthocyanidin biosynthesis in plants. Purification of legume leucoanthocyanidin reductase and molecular cloning of its cDNA[J]. Journal of Biological Chemistry,2003,278(34):31647-31656.
[2]Stafford H A,Lester H H. Enzymic and nonenzymic reduction of (+)-dihydroquercetin to its 3,4,-diol[J]. Plant Physiology,1982,70(3):695-698.
[3]Stafford H A,Lester H H. Flavan-3-ol biosynthesis:the conversion of (+)-dihydromyricetin to its flavan-3,4-diol (Leucodelphinidin) and to (+)-gallocatechin by reductases extracted from tissue cultures of ginkgo biloba andPseudotsugamenziesii[J]. Plant Physiology,1985,78(4):791.
[4]Bogs J,Jaffé F W,Takos A M,et al. The grapevine transcription factor VvMYBPA1 regulates proanthocyanidin synthesis during fruit development[J]. Plant Physiology,2007,143(3):1347-1361.
[5]马春雷,乔小燕,陈 亮. 茶树无色花色素还原酶基因的克隆及表达分析[J]. 茶叶科学,2013,30(1):27-36.
[6]陈春燕,马晖玲,董文科. 甘肃红豆草无色花青素还原酶LAR基因的克隆和表达分析[J]. 草业学报,2015,24(6):177-187.
[7]Paolocci F,Robbins M P,Madeo L,et al. Ectopic expression of a basic helix-loop-helix gene transactivates parallel pathways of proanthocyanidin biosynthesis. structure,expression analysis,and genetic control of leucoanthocyanidin 4-reductase and anthocyanidin reductase genes inLotuscomiculatus[J]. Plant Physiology,2007,143(1):504-516.
[8]Pang Y Z,Peel G J,Wright E,et al. Early steps in proanthocyanidin biosynthesis in the model legumeMedicagotruncatula[J]. Plant Physiology,2007,145(3):601-615.
[9]Shen X F,Zeng S H,Wu M,et al. Characterization of proanthocyanin-related leucoanthocyanidin reductase and anthocyanidin reductase genes inLyciumruthenicumMurr[J]. Journal of Chinese Pharmaceutical Sciences,2014,23(6):369-377.
[10]Litz R E. The mango:botany,production and uses[M]. UK:CABI Head Office,2005.
[11]Wang Y P,Yang Z M,Zhang B. Identification of protein related to biosynthesis of condensed tannin inOnobrychistanaiticaSpreng[J]. Acata Agrestia Sinica,2000,8(2):126-131.
[12]Bogs J,Downey M O,Harvey J S,et al. Proanthocyanidin synthesis and expression of genes encoding lecoanthocyanidin reductase in developing grape berries and grapevine leaves[J]. Plant Physiology,2005,139(2):652-663.
