半胱胺对局灶性脑缺血大鼠氧化应激及神经元凋亡的影响
2018-05-08徐玉振赵大鹏杨海燕
徐玉振,王 茜,赵大鹏,赵 林,杨海燕,王 涛
(泰山医学院附属泰山医院:1神经内科,2中心实验室,山东 泰安271000)
0 引言
局灶性脑缺血可引起缺血区神经损伤,进而影响神经功能的恢复导致幸存患者永久性的神经功能障碍。脑卒中是一种急性脑血管疾病,已成为成年人致死和致残的首要原因。研究[1]发现,脑梗死急性期继发全脑的急性损伤,包括颅内压升高、脑灌注压下降、微循环紊乱、脑水肿形成,氧化应激和迟发性脑血管痉挛以及微血管系统损伤等,称为早期脑损伤。其中,氧化应激往往引起血管平滑肌和内皮细胞损伤,血脑屏障破坏,缩血管物质生成和诱导促细胞凋亡酶的产生[2]。因此,抗氧化剂曾被用来治疗局灶性脑缺血的氧化应激,从而减轻脑损伤,改善预后[3]。
半胱胺是一种安全的抗氧化剂,是辅酶A的降解产物,已被美国食品及药品管理局批准用于治疗胱氨酸贮积症。近期研究[4]表明,半胱胺或可用于亨廷顿舞蹈症和非酒精性脂肪肝病的临床疗效;因其能通过血脑屏障进入脑组织,在治疗神经变性疾病动物模型中,半胱胺表现出抗氧化作用和神经保护作用[5],但半胱胺治疗局灶性脑缺血的研究较少。我们推测半胱胺对局灶性脑缺血后早期脑损伤的神经起保护作用。本研究探讨半胱胺对大鼠局灶性脑缺血后的氧化应激和皮层神经元凋亡的抑制作用。
1 材料和方法
1.1 实验动物与主要试剂研究采用雄性Wistar大鼠,体质量250~300 g,由山东大学实验动物中心提供。大鼠饲养于恒温24℃±1℃恒湿 (60%±5%环境鼠笼中,12 h昼夜循环。半胱胺购自美国Sigma公司,丙二醛试剂盒及还原型谷胱甘肽检测试剂盒购自中国南京建成生物工程研究所,兔抗鼠caspase⁃3抗体、抗兔IgG二抗购自美国Cell Signaling Technology公司,Alexa Fluor 568⁃结合山羊抗小鼠抗体购自美国Life technologies公司。
1.2 实验步骤与分组实验分为假手术组(n=20),MCAO组(n=20)和半胱胺组(n=20)。 根据 Longa改良线栓法制备大鼠MCAO模型[6]。简要说明手术过程:大鼠腹腔注射水合氯醛(350 mg/kg)麻醉,以电热板及电灯泡保温,使动物身体核心温度不低于37℃。颈部正中皮肤切开,钝性分离暴露左侧颈总动脉、颈内动脉和劲外动脉分岔口处,结扎颈外动脉远心端及颈总动脉近心端,动脉夹夹闭颈内动脉,于颈总动脉远心端上做一切口,插入预备的硅胶头线栓,使其沿着颈总动脉进入颈内动脉,深度为1.8~2.0 cm到达大脑中动脉起始部,后固定线栓,检查无出血后缝合颈部皮肤。假手术组大鼠10 mL/DL水合氯醛腹腔注射麻醉后,颈部正中皮肤切开,钝性分离,暴露出左侧颈总动脉、颈内动脉和劲外动脉分岔口处,后缝合颈部皮肤。半胱胺配制成200 mg/mL无菌生理盐水浓缩溶液。MCAO造模后,给予大鼠半胱胺(0.1 mL,20 mg/kg/d)或安慰剂(0.1 mL,无菌生理盐水)腹腔注射,1次/d,1周后处死大鼠。各组大鼠断头取脑,冰盐水冲洗干净血液及血凝块,右侧脑组织标本用于活性氧族检测,左侧脑组织迅速用液氮冷冻保存于-80℃,用于生物化学检验。
1.3 脑组织氧化应激检测脑匀浆活性氧族(reac⁃tive oxygen species,ROS)水平通过 DCDHF⁃DA 方法测定[7],在 ROS 存在时,DCDHF⁃DA 在细胞内被氧化并转化成一种荧光复合物DCF被限制于细胞内。0.45 mL脑匀浆与 5 μL DCDHF⁃DA 加入 24 孔板37℃ 避光 30 min,然后使用 SpectraMax M5e多模式酶标仪 (Molecular Devices,美国)检 测 DCF。ROS生成通过 DCF标准曲线定量,数值表示为pmol/mg/min。脑匀浆氧化应激损伤标志物检测步骤:脑组织样品匀浆后收集上清液,测定蛋白浓度,使用商业化试剂盒检测丙二醛(malondialdehyde,MDA)及还原型谷胱甘肽(glutathione,GSH)含量。
1.4 免疫组织化学染色大鼠于MCAO造模1周后麻醉并经心脏灌注固定。取出脑组织保存于4%多聚甲醛溶液中固定6 h,再浸于30%蔗糖溶液4℃下3 d。脑冰冻切片(层厚 18 μm)磷酸盐缓冲溶液(PBS)冲洗 3次,10 mL/DL山羊血清封闭,PBS冲洗,0.1 mL/DL Triton X⁃100 室温 2 h,切片与 caspase⁃3抗体(1 ∶100)4℃共同孵育12 h,二抗孵育1 h。 孵育完成后,切片滴加抗淬灭溶液后加盖玻片保存。将载玻片置于共聚焦显微镜(Nikon,日本)下观察,采用恒定参数采集图像。从脑皮质切片的3个显微镜视野(20×)中选择活化caspase⁃3阳性的细胞采集图像[8]。 计数 caspase⁃3阳性细胞,取 3 幅图像的平均数。
1.5 Tunel染色模型大鼠以10% 水合氯醛深度麻醉,经心脏以0.9%氯化钠灌洗,处死大鼠,留取脑组织制作冰冻切片。每隔100 μm取1张切片,共取3张,复温后用冰丙酮固定15 min,PBS洗涤10 min×3遍,后用5%山羊血清室温封闭1 h。Tunel染色严格按照试剂盒说明书进行操作。Tunel工作液中加入Dylight.羊抗兔 IgG 荧光二抗(1 ∶300),室温孵育1 h,后PBS避光洗涤5 min×3遍,抗荧光淬灭封片剂封片,于荧光显微镜下拍照[9]。每张切片随机选取3个视野,运用Image ProPlus 6.0软件进行图像分析。
1.6 统计学处理使用SPSS20.0统计学软件进行单因素方差分析(one⁃way ANOVA)。数据使用±s表示。多个组间比较先行方差齐性检验,方差齐者再行单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 半胱胺对局灶性脑缺血后MDA及GSH表达的影响与对照组相比,MCAO组和Cysteamine组大鼠脑组织的 MDA表达量明显升高(P<0.05);与MCAO组相比,Cysteamine组大鼠脑组织的MDA表达量明显降低(P<0.05,图 1)。
与对照组相比,MCAO组和Cysteamine组大鼠脑组织的GSH表达量明显降低(P<0.05);与MCAO组相比,Cysteamine组大鼠脑组织的GSH表达量明显升高(P<0.05,图 1)。

图1 半胱胺对局灶性脑缺血后MDA及GSH表达的影响
2.2 半胱胺抑制局灶性脑缺血后神经元凋亡半胱胺对局灶性脑缺血后caspase⁃3表达的影响及脑组织Tunel染色(图 2)。与对照组相比,MCAO组和Cysteamine组大鼠脑组织的 caspase⁃3的表达量及Tunel阳性细胞数表达量明显升高(P<0.05);与MCAO组相比,Cysteamine组大鼠脑组织的caspase⁃3的表达量及Tunel阳性细胞数明显降低(P<0.05)。
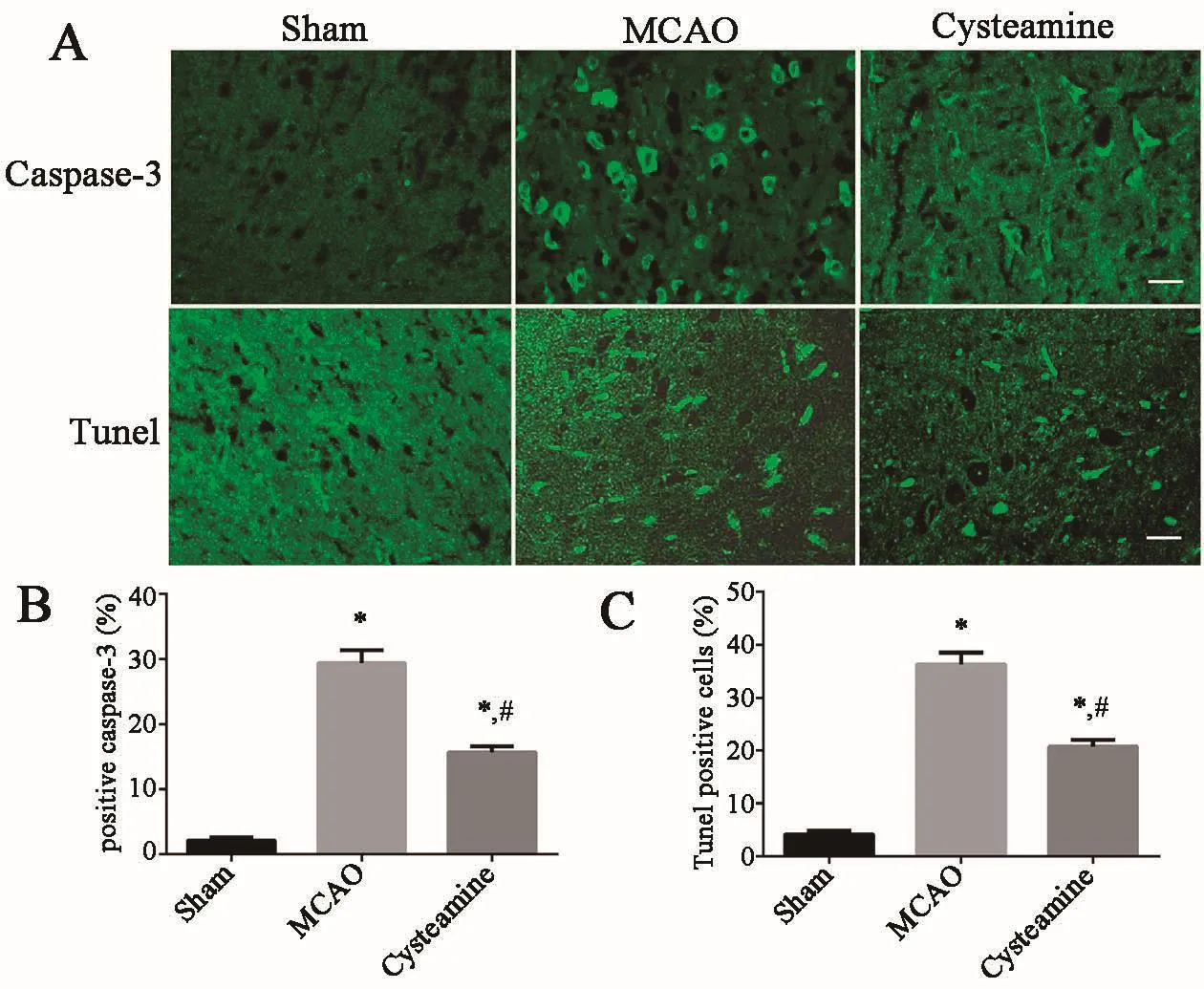
图2 各组大鼠脑组织caspase⁃3的表达及Tunel染色
3 讨论
本研究显示,腹腔内注射半胱胺(20 mg/kg/d),能够显著抑制局灶性脑缺血大鼠的氧化应激以及神经元的凋亡。半胱胺治疗可显著抑制局灶性脑缺血诱导的MDA生成,上调GSH的表达,同时减少凋亡蛋白caspase⁃3的表达及Tunel阳性细胞数。这些发现提示半胱胺对局灶性脑缺血大鼠具有神经保护作用,可能是治疗局灶性脑缺血神经损伤的有效方法。
氧化应激介导的脂质过氧化主要发生在内皮细胞和神经元,可导致细胞的功能障碍和凋亡,内皮细胞的凋亡与血脑屏障破坏和脑水肿相关,神经细胞的凋亡与神经功能缺失的发生有关[10]。 Shin 等[11]的研究表明,过氧化氢诱导氧化应激导致角膜内皮细胞凋亡,半胱胺可降低氧化应激水平从而阻止细胞凋亡;Okamura等[12]的研究表明,半胱胺可通过降低氧化应激水平改善慢性肾病的纤维化改变。上述研究与本研究结果一致,但均未涉及神经系统。在本研究中,半胱胺治疗改善了局灶性脑缺血大鼠的氧化应激,降低了神经元的凋亡水平,说明抗氧化应激是半胱胺在局灶性脑缺血后发挥保护作用的潜在机制之一。
细胞凋亡发生于局灶性脑缺血后的神经元、星形胶质细胞、少突胶质细胞、平滑肌细胞和内皮细胞,在早期脑损伤的发病机制中发挥关键作用[13]。Besouw等[14]的研究表明,半胱胺治疗可阻止真皮细胞的凋亡。而本研究结果显示,半胱胺能够降低大鼠局灶性脑缺血后caspase⁃3水平的升高,半胱胺抗凋亡的作用在Tunel实验中得到进一步证实。本研究结果证实了在神经系统中半胱胺的抗凋亡作用,这与前人的结果一致[15]。以上发现提示抗凋亡作用也是半胱胺在局灶性脑缺血脑损伤过程中发挥保护作用的潜在机制之一。
半胱胺的神经保护作用机制复杂。Besouw等[16]指出,半胱胺能够在胱氨酸病中耗竭溶酶体的胱氨酸,升高细胞的谷胱甘肽水平,通过交联到硫醇组中改变酶活性,并能调控多个基因表达,尚待进一步研究。 综上所述,腹腔内注射半胱胺(20 mg/kg/d)能够抑制氧化应激及神经元凋亡,从而对大鼠局灶性脑缺血诱导的早期脑损伤提供保护作用。
【参考文献】
[1]张 斌.多发腔隙性脑梗死患者血纤维蛋白原水平分析[J].转化医学电子杂志,2015,2(11):102-103.
[2] Sajja RK,Rahman S,Cucullo L.Drugs of abuse and blood⁃brain barrier endothelial dysfunction:A focus on the role of oxidative stress[J].J Cereb Blood Flow Metab,2016,36(3):539-554.
[3] Xue F,Huang JW,Ding PY,et al.Nrf2/antioxidant defense path⁃way is involved in the neuroprotective effects of Sirt1 against focal cerebral ischemia in rats after hyperbaric oxygen preconditioning[J].Behav Brain Res,2016,309:1-8.
[4] Zhao Y,Feng Y,Zhang H,et al.Inhibition of peripubertal sheep mammary gland development by cysteamine through reducing proges⁃terone and growth factor production[J].Theriogenology,2017,89:280-288.
[5] Elmonem MA,Veys KR,Soliman NA,et al.Cystinosis:a review[J].Orphanet J Rare Dis,2016,11(1):47.
[6] Shahjouei S,Cai PY,Ansari S,et al.Middle cerebral artery occlu⁃sion model of stroke in rodents:a step⁃by⁃step approach[J].J Vasc Interv Neurol,2016,8(5):1-8.
[7] Guo F,Jin WL,Li LY,et al.M9,a novel region of amino⁃Nogo⁃A,attenuates cerebral ischemic injury by inhibiting NADPH oxidase⁃de⁃rived superoxide production in mice[J].CNS Neurosci Ther,2013,19(5):319-328.
[8] Xu Y,Wang Q,Li D,et al.Protective effect of lithium chloride against hypoglycemia⁃induced apoptosis in neuronal PC12 cell[ J].Neuroscience,2016,330:100-108.
[9]卢晓闻,陈 哲,许烈鹏,等.高压氧联合谷氨酰胺对创伤性颅脑损伤大鼠神经功能和神经细胞凋亡情况的影响[J].转化医学电子杂志,2017,4(8):29-32,35.
[10] Muche A,Arendt T,Schliebs R.Oxidative stress affects processing of amyloid precursor protein in vascular endothelial cells[J].PloS One,2017,12(6):e0178127.
[11] Shin YJ,Seo JM,Chung TY,et al.Effect of cysteamine on oxidative stress⁃induced cell death of human corneal endothelial cells[J].Curr Eye Res,2011,36(10):910-917.
[12] Okamura DM,Bahrami NM,Ren S,et al.Cysteamine modulates oxidative stress and blocks myofibroblast activity in CKD[J].J Am Soc Nephrol,2014,25(1):43-54.
[13] Dong Y,Fan C,Hu W,et al.Melatonin attenuated early brain injury induced by subarachnoid hemorrhage via regulating NLRP3 inflammasome and apoptosis signaling[J].J Pineal Res,2016,60(3):253-262.
[14] Besouw M,Van den Heuvel L,van Eijsden R,et al.Increased human dermal microvascular endothelial cell survival induced by cysteamine[J].J Inherit Metab Dis,2013,36(6):1073-1077.
[15] Zhu M,Sun L,Zhang Y,et al.Protective effects of cystamine on apoptosis of hippocampal neurons in rats with cerebral ischemia[J].Biomed Res,2017,28(19):8243-8248.
[16] Besouw M,Masereeuw R,van den Heuvel L,et al.Cysteamine:an old drug with new potential[J].Drug Discov Today,2013,18(15-16):785-792.
